Урок з хімії для 8 класу на тему "Амфотерні гідроксиди"
Тема: Поняття про амфотерні гідроксиди
Мета: Закріпити знання учнів про властивості оксидів, кислот, основ. Дати поняття про амфотерність як здатність сполук проявляти подвійний характер: кислот та основ. Удосконалювати вміння складати рівняння реакцій, на основі експерименту робити висновки і узагальнення. Розвивати спостережливість, логічне мислення.
Обладнання: розчин цинк хлориду, натрій гідроксиду, сульфатної кислоти,
штатив з пробірками
Форми і методи: робота в групах, демонстраційний експеримент, розповідь з елементами бесіди проблемного характеру, фронтальна бесіда, самостійна робота з підручником, робота в парах.
Тип уроку: комбінований.
Хід уроку.
«Зібратися разом – це початок,
триматися разом – це прогрес,
працювати разом – це успіх»
(Генрі Форд)
І. Організація класу.
ІІ. Актуалізація опорних знань.
Вправа «Гадання на ромашці» ( робота в групах)
Клас ділиться на 5 груп. Учитель пропонує представнику кожної групи відірвати пелюстку від паперової ромашки, повернутися в групу і виконати завдання:
- Із виданих карток відібрати ті, які характеризують речовину, формула якої зображена на пелюстці ромашки. Учні, виконавши завдання, прикріплюють на дошці за допомогою магнітів відібрані картки, захищають свою роботу.

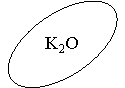
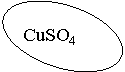


Зміст карток, які учні повинні розподілити:
- Луг
- Оксид
- Кислота
- Основний
- Сіль
- Кислотний
- Речовина, що складається із металічного елемента та кислотного залишку
- Йому відповідає калій гідроксид
- Сульфатна кислота
- Калій оксид
- Двохосновна
- Середня
- Сульфідна
- Одноосновна
- Двохосновна
- Нерозчинна основа
- Розчин цієї речовини забарвлює лакмус у червоний колір
- Розчин цієї речовини забарвлює фенолфталеїн у малиновий колір
- Йому відповідає карбонатна кислота
- Він реагує із сульфатною кислотою, утворюючи сіль та воду
- Цю речовину можна добути при взаємодій купрум(ІІ) оксиду із сульфатною кислотою.
Завдання.
Складіть рівняння реакцій нейтралізації, в результаті яких утворюються солі: натрій ортофосфат, ферум(ІІІ) сульфат, калій хлорид.
ІІІ. Мотивація навчальної діяльності
Завдання.
Дано речовини: CaO, Ca(OH)2, Zn(OH)2, H2CO3, SO2, ZnO, H2ZnO2, NaOH, Mg(OH)2. Випишіть з переліку: а) основні оксиди; б)кислотні оксиди; в) луги; г)кислоти, нерозчинні основи.
Розподіляючи речовини за классами, ви, мабуть, зіткнулися із рядом проблем:
- До якого класу сполук відноситься речовина H2ZnO2 ? З такою кислотою ви раніше не були знайомі. Чи існує така сполука?
- Чи можна твердити, що H2ZnO2 і Zn(OH)2 одна і та ж речовина? Адже вони мають один і той же якісний і кількісний склад.
- До яких оксидів (кислотних чи основних) відноситься ZnO ?
Ці проблеми ми розв’яжемо, познайомившись детальніше із амфотерними гідроксидами.
ІV. Засвоєння нових знань.
- Що таке амфотерні гідроксиди?
Демонстраційний експеримент.
До 1 мл розчину цинк хлориду ZnCl2 додаємо декілька краплин розчину натрій гідроксиду.
- Що спостерігається? (Утворюється драглистий осад білого кольору)
- Запишіть рівняння реакції взаємодії цих речовин.
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
- Яка речовина випала в осад? (учні по таблиці розчинності визначають, що осадом є цинк гідроксид)
- Які властивості найбільш характерні для нерозчинних основ? (Взаємодія з кислотами)
Утворений осад учитель ділить на дві частини. До однієї додає розчину сульфатної кислоти до розчинення осаду.
- Чи відбулася реакція між цинк гідроксидом та сульфатною кислотою?
- Так, бо осад розчинився, а це ознака хімічної реакції.
До пробірки, де знаходиться друга частина осаду, учитель додає надлишок розчину натрій гідроксиду.
- Чи відбулася реакція?
- Так, бо осад розчинився?
- Чи вивчали ви раніше, щоб нерозчинна основа взаємодіяла одночасно і з лугом, і з кислотою?
- Ні, нерозчинні основи не взаємодіяли з лугами.
Висновок: Отже, існують основи, які виявляють як властивості основ, так і властивості кислот, бо взаємодіють і з кислотами, і з основами, Такі гідроксиди називаються амфотерними. Вони проявляють подвійний характер.
Zn(OH)2 → H2ZnO2.
При взаємодії з кислотою амфотерний гідроксид виступає як основа:
Zn(OH)2 + H2SO4 = Zn SO4 + 2H2О
При взаємодії з основами амфотерний гідроксид виступає як кислота:
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2О
(натрій цинкат)
- Представники амфотерних гідроксидів.
Робота в групах гетерогенного складу.
Завдання для групи №1:
Користуючись підручником, запишіть, у вигляді яких кислот може виступати алюміній гідроксид. Напишіть рівняння реакцій, які підтверджують подвійний характер алюміній гідроксиду.
Al(OH)3 → H3AlO3
↓
HAlO2
Al(OH)3 + 3HCl = AlCl3 + 3H2O – гідроксид проявляє основний характер
![]() Al(OH)3 + NaOH = NaAlO2 + 2H2O (при сплавлянні) гідроксид проявляє
Al(OH)3 + NaOH = NaAlO2 + 2H2O (при сплавлянні) гідроксид проявляє
Al(OH)3 + NaOH= Na [Al(OH)4] (в розчинах) кислотний характер
Завдання для групи № 2:
Користуючись підручником, запишіть, у вигляді яких кислот може виступати хром(ІІІ) гідроксид. Напишіть рівняння реакцій, які підтверджують подвійний характер хром(ІІІ) гідроксиду
V. Закріплення вивченого.
Бесіда:
- які гідроксиди називаються амфотерними?
- Назвати амфотерні гідроксиди.
- Які гідроксиди відповідають таким амфотерним оксидам: BeO, ZnO, Fe2O3, Al2O3, Cr2O3?
Тестові завдання.
- Вкажіть правильне твердження: «Гідроксиди, які утворюють солі під час взаємодії як з кислотою, так і з основою, називаються …»
А) нерозчинними гідроксидами;
Б) типовими гідроксидами;
В) амфотерними гідроксидами;
Г)лугами.
2. Вкажіть елементи, які утворюють амфотерні гідроксиди:
А) К, Рв, Б)Al, Cr, В) Zn, Ba Г) Be, Mg.
3. Вкажіть групу речовин, що складається з амфотерних основ
А) Be(OH)2, Ba(OH)2, Zn(OH)2,
Б) Al(OH)3, Cr(OH)3, Fe(OH)3,
В) Al(OH)3, Ca(OH)2, Be(OH)2,
Г) Mn(OH)2, Al(OH)3, Ba(OH)2
4. Вкажіть речовину, з якою реагує цинк гідроксид:
А) купрум(ІІ) оксид; Б) калій гідроксид, В) калій хлорид; Г) вода.
5. Вкажіть правильне твердження: «амфотерність – це властивість речовин реагувати із …»
А) з розчинними солями;
Б) з кислотами;
В) з лугами
Г) і з кислотами і злугами.
6. Вкажіть речовину Х у схемі перетворень: Ве(OH)2 + Х = Na2ВеO2 + 2H2О
А) Na2O, Б) NaOH, В) NaCl, Г) NaNa.
7. Вкажіть назву продукту реакції цинк гідроксиду із їдким натром при сплавлянні:
А) цинк карбонат,
Б) цинк гідроксокарбонат,
В) натрій цинкат,
Г) натрій тетрагідроксоцинкат.
VІ. Домашнє завдання.
Вивч. § 39, впр. № 6, ст..216.


про публікацію авторської розробки
Додати розробку
