Урок з хімії для учнів 8 класу на тему: " КИСЛОТИ: КЛАСИФІКАЦІЯ, ФІЗИЧНІ ВЛАСТИВОСТІ, ПОШИРЕНІСТЬ ТА ЗАСТОСУВАННЯ"
Урок № 47 Дата: 01. 03. 2022
Клас: 8 - Б
Тема уроку: КИСЛОТИ: КЛАСИФІКАЦІЯ, ФІЗИЧНІ ВЛАСТИВОСТІ, ПОШИРЕНІСТЬ ТА ЗАСТОСУВАННЯ
Мета: освітня – сприяти розширенню знань про класифікацію неорганічних речовин на прикладі кислот, ознайомити учнів із поняттям „кислота”, класифікацією кислот за складом та номенклатурою кислот; з’ясувати фізичні властивості кислот, поширення їх у природі;
розвиваюча – розвивати логічне мислення, пам’ять, вміння визначати та класифікувати кислоти, давати назви кислотам; розвивати інтелектуальну культуру учня; розвивати уміння узагальнити і робити висновки при вивченні матеріалу теми;
виховна – виховувати науковий світогляд, вміння брати відповідальність за прийняте рішення; продовжити формувати дисциплінарність, працьовитість;
Тип уроку: урок засвоєння нових знань, урок – подорож.
Обладнання й матеріали: ПСХЕ, роздатковий матеріал, зразки кислот, ноутбук, мультимедійний проектор, презентація «Кислоти».
Методи навчання: пояснювально – ілюстративні - бесіда, розповідь; наочні – демонстрація; практичні – виконання завдань; репродуктивні, інтерактивні.
Міжпредметні зв’язки: хімія, основи здоров’я, біологія.
Очікувані результати: учень складає формули кислот; класифікує кислоти; характеризує склад, фізичні властивості; встановлює причинно-наслідкові зв’язки між властивостями кислот та їх дією на організм людини.
ХІД УРОКУ
- ОРГАНІЗАЦІЙНИЙ МОМЕНТ.
Вчитель: Добрий день! Сьогодні у нас відкритий урок і до нас завітали гості . Черговий, будь-ласка, назвіть відсутніх на уроці.
II. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ ТА АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ.
1.Бліц-опитування.
Вчитель. Сьогодні на уроці ми з вами здійснимо наукову подорож у дивовижну країну, яка зветься Неорганія. Вона має чотири міста, а править ними гордовита цариця Хемі. Міста мають назви, а жителі – прізвища. Мешканці міст добрі знайомі, між ними давно утворились міцні зв’язки. Неорганійці дружні, толерантні, хоча серед них є і досить імпульсивні особи, але Хемі всім дає раду. Діти, а ви знаєте назви міст Неорганії?
- А який клас неорганічних сполук ми вивчили?
- Що ми називаємо оксидами ?
- Які оксиди називають основними?
- Які оксиди називають кислотними?
2. Гра «Оксиди».
З метою узагальнення й закріплення знань з теми «Оксиди», яку ми з вами вивчили на минулому уроці, пропоную знайти відповідності назв оксидів та їх хімічних формул ось на цих картках.

Вчитель. Серед дивовижного царства неживої природи є чимало речовин, про існування яких ми й не підозрюємо. Вони постійно навколо нас, і ми користуємось ними в повсякденному житті. На сьогоднішньому уроці розмова піде саме про них.
3. «Мозковий штурм».
- Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (кислий смак)
- Чому від кропиви подразнення шкіри? (до складу соку входить кислоти)
- Чому чай після додавання лимону світлішає? (кислота змінює забарвлення)
- Чому кефір, ряжанка, сметана, простокваша відноситься до молочно - кислих продуктів? ( до їх складу входить молочна кислота)

- ОГОЛОШЕННЯ ТЕМИ ТА МЕТИ УРОКУ.
Отже, сьогодні ми поговоримо про органічні та неорганічні кислоти, які надзвичайно важливі для людини, так як вона використовує їх у своїй практичній діяльності.
А що таке кислота і які бувають кислоти ви дізнаєтесь, вивчивши тему нашого уроку. В зошитах запишіть, будь ласка, тему уроку: «: КИСЛОТИ: КЛАСИФІКАЦІЯ, ФІЗИЧНІ ВЛАСТИВОСТІ, ПОШИРЕНІСТЬ ТА ЗАСТОСУВАННЯ» (слайд)
Мета уроку:
- розширити знання про складні речовини на прикладі кислот;
- вивчити склад і назви кислот;
-
навчитися класифікувати кислоти.
- ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ.
Розповідь вчителя.
- Поширення кислот.
У природі існують органічні та неорганічні кислоти. Вони входять до складу фруктів, щавлю, шлункового соку. У 8 класі ви ознайомитеся з неорганічними кислотами.
Декілька уроків тому деякі учні отримали випереджальне завдання дослідити питання поширення кислот.
Будь-ласка, прошу учнів презентувати свої роботи.
Презентація проекту І групи.
Учень. Наша група, опрацювавши додаткову літературу, створила колаж, який ознайомить вас із вмістом органічних кислот у продуктах харчування.
Учень. Органічні кислоти містять молочні продукти: сир, сметана, молоко, масло, а також овочі. Багаті на органічні кислоти і ягоди ( чорна смородина, шипшина). Фрукти також містять органічні кислоти (вишні, черешні, яблука, груші).
Презентація проекту ІІ групи.
Учень. Наша група працювала над проектом «Кислоти у природі». Результатом нашої роботи – є створення презентації.
У житті нам постійно трапляються кислоти. Фрукти постачають нам цілий букет кислот. Аскорбінова кислота, відома як вітамін С, міститься в шипшині. Навіть синильна кислота, що вважається отрутою, знайома кожному, хто розбивав кісточки слив чи вишень. Вона має дуже характерний запах – запах гіркого мигдалю. Кількість її в кісточках мізерна, але відчути запах можна.
Учень. Якщо влітку підійти до мурашника, то можна надовго запам’ятати жалкі укуси її мешканців. Мурашки не лише кусають, вони вприскують у ранку мурашину кислоту.
Цю ж мурашину кислоту містить і кропива.
Бджолина та осина отрути являють собою речовини кислої природи. Біль від укусу можна зменшити, втираючи у ранку розчин соди або нашатирного спирту.
Презентація проекту ІІІ групи.
Учень. Наша група досліджувала питання наявності кислот в організмі людини. Ми хочемо вам довести, що кислоти мають важливе значення для організму людини. Результатом нашої діяльності – є створення презентації.
Наприклад, ДНК ( дезоксирибонуклеїнові кислоти) є носіями генетичної інформації.
Людський організм складається з білків, основними складовими частинками яких є амінокислоти.
Учень. Аскорбінова, фолієва кислоти – це вітаміни. До складу шлункового соку входить хлоридна кислота, яка допомагає перетравлювати їжу.
Молочна кислота утворюється у м’язах при фізичних навантаженнях.
Карбонатна кислота міститься в мінеральних джерелах, сульфідна у вулканічних газах. Оксиди Нітрогену та Сульфуру розчиняються у крапельках води хмар і утворюють сульфатну та нітратну кислоти, що випадають на землю у вигляді кислотних дощів.
- Склад кислот. Визначення.
Завдання: Знайдіть у підручнику (протягом 1 хв) та прочитайте визначення поняття „кислота”.
Всі разом говорять визначення.
Кислоти– це складні речовини, що містять атоми Гідрогену, здатні заміщуватися на метал та кислотний залишок. (слайд)
n
Нn КЗ
Валентність кислотного залишку дорівнює кількості атомів Гідрогену(n) у кислоті.
Наприклад: H2SO4 – cульфатна кислота (слайд)
КЗ (валентність ІІ)
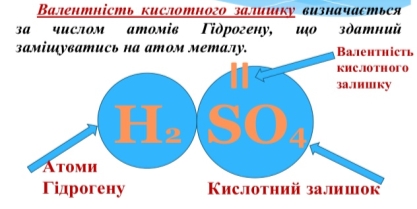
- Номенклатура кислот.
Робота з підручником, слайдами.
У 1870 році в Петербурзькій Академії наук обговорювалося питання про застосування для цієї речовини назви «Водород Серович Четырехкислов». Як ви вважаєте про яку кислоту йшла мова? Назви кислот були запропоновані уперше хіміками Лавуаз’є, Бертоле. (Ознайомлення учнів з назвами кислот)
Таблиця
|
Формула кислоти |
Назва кислоти |
Кислотний залишок |
Валент-ність кислот-ного залиш-ку |
Назва солі |
Формула відповід-ного оксиду |
|
HCl |
Хлоридна (соляна) |
Cl- |
І |
Хлорид |
- |
|
HBr |
Бромідна |
Br- |
І |
Бромід |
- |
|
HI |
Йодидна |
I- |
І |
Йодид |
- |
|
HF |
Фторидна |
F- |
І |
Фторид |
- |
|
H2S |
Сульфідна |
S2- |
ІІ |
Сульфід |
- |
|
HNO3 |
Нітратна (V) (азотна) |
NO3- |
І |
Нітрат |
N2O5 |
|
H2CO3 |
Карбонатна (вугільна) |
CO32- |
ІІ |
Карбонат |
CO2 |
|
H2SiO3 |
Силікатна (кремнієва) |
SiO32- |
ІІ |
Силікат |
SiO2 |
|
H2SO3 |
Сульфітна (ІV) (сірчиста) |
SO32- |
ІІ |
Сульфіт |
SO2 |
|
H2SO4 |
Сульфатна (VI) (сірчана) |
SO42- |
ІІ |
Сульфат |
SO3 |
|
H3PO4 |
Ортофосфат-на (фосфорна) |
PO43- |
ІІІ |
Ортофос-фат (фосфат) |
P2O5 |
Сучасна назва кислот відповідає назві кислотних залишків, це необхідно пам’ятати, щоб добре засвоїти назви солей.
Демонстрація. Вчитель демонструє зразки кислот.
- Класифікація кислот.
Бесіда:
- Зверніть увагу на дані формули кислот. (Таблиця)
- Що спільного? (кожна має атоми Гідрогену)
- Чим відрізняються? (кількістю атомів Гідрогену та наявністю атомів Оксигену).
«Хімічний тренінг»
- Розділіть формули кислот, які ви бачите на роздавальних картках, на групи за вмістом Оксигену.
Висновок: За складом Оксигену кислоти діляться на оксигеновмісні та безоксигенові. (слайд)
![]()
![]() к и с л о т и
к и с л о т и
оксигеновмісні безоксигенові
H2CО3, HNО3 HBr, HCl, H2S
- Розділіть формули кислот на групи за кількістю атомів Гідрогену.
Висновок: за кількістю атомів Гідрогену кислоти діляться на одноосновні, двох-, трьохосновні кислоти. (слайд)
![]()
![]()
![]() к и с л о т и
к и с л о т и
одноосновні двоосновні трьохосновні
HBr, HCl H2S, H2CО3 H3РО4
5. Фізичні властивості кислот
Робота з підручником. Бесіда.
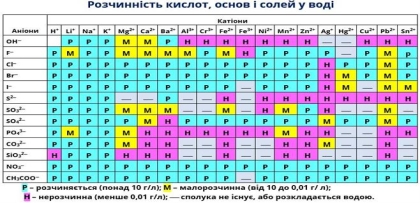
Більшість кислот кислі на смак. Пригадайте смак деяких кислот, що вам траплялися в повсякденному житті: оцтової кислоти, лимону, вітаміну С, щавлевої, яблучної кислот. Виняток: саліцилова – солодка, нікотинова – гірка. Багато кислот за звичайних умов рідини, але є й тверді кислоти (фосфатна), драглиста маса – силікатна кислота. Усі кислоти важчі за воду, здебільшого добре розчинні у воді. Деякі леткі (НСІ, НNО3) мають задушливий запах. Майже всі кислоти безбарвні. Кислоти – їдкі речовини, особливо небезпечні сульфатна, нітратна, хлоридна кислоти.
Демонстрація. Розчинність кислот за таблицею розчинності.(слайд)
6. Правила техніки безпеки.
Щоб отримати розведений розчин кислоти, потрібно лити кислоту у воду, а не навпаки. «Золоте правило» хімії:
Спочатку – вода, потім - кислота.
Бо трапитись може велика біда.
Це пояснюється тим, що вода маючи меншу густину, ніж кислота, опиниться на поверхні, закипить і її бризки можуть потрапити на руки, обличчя, викликавши опіки.
Якщо сталося так, що краплі кислоти потрапили на шкіру, шкіру слід промити 5% розчином соди.

Демонстраційний дослід. (Розведення сульфатної кислоти)
V. ПЕРВИННА ПЕРЕВІРКА ЗАСВОЄННЯ ТА ЗАКРІПЛЕННЯ ЗНАНЬ
Робота з технологічною картою.
- «Впізнай»: з наведеного переліку формул виписати формули кислот та дати їм назви:
СаО, H2SiО3, K2SО4, HNО3, NaОН, СО2, Н3РО4, H2S, AgCl, HF, H2О, HCl, LiОH, H2SО4.
- «Третій зайвий»
а) H2S, Н3РО4, H2SО4; (H2S – безоксигенові кислота)
б) HNО3, H2CО3, Al(ОH)3; (Al(ОH)3 – не є кислота)
в) HF, H2SiО3, HNО3. (H2SiО3 – двоосновна кислота)
3. Гра «Хрестики – нулики»: знайти правильну відповідь.
|
HBr |
HCl |
HI |
|
H2SО4 |
Н3РО4 |
HNО3 |
|
H2S |
H2SiО3 |
H2CО3 |
а) Виграшний шлях – формули безоксигенових кислот
Відповідь: HBr, HCl, HI – безоксигенові кислоти.
|
HCl |
HI |
|
|
H2SО4 |
Н3РО4 |
HNО3 |
б) Виграшний шлях – формули двоосновних кислот
Відповідь: H2S, H2SiО3, H2CО3– двоосновні кислоти.
|
SO3 |
NaOH |
H2CO3 |
|
HNO3 |
HCl |
H2S |
в) Виграшний шлях – формули оксигеновмісних кислот
Відповідь: HNO3, H3PO4, H2SO4 – оксигеновмісні кислоти.
- ПІДСУМОК УРОКУ. РЕФЛЕКСІЯ.
А зараз давайте підведемо підсумок уроку.
-
Вправа «Про що ? + Що? + Як ? + Навіщо ?» (слайд)
- Про що ми говорили на уроці?
- Що вони собою являють?
- Як правильно розбавляти кислоти ?
- Навіщо ми вивчаємо кислоти ?
- Складання сенкану. (слайд)

Кислоти
Кислі, їдкі
Розчиняються, подразнюють, знешкоджують
Кислоти необхідні для життя
Речовини
Діти, я хочу подякувати вам за урок, ще раз побажати успіху і сказати, що я вірю у ваш успіх.
«Успіх - це тільки 10% таланту і 90% щоденної наполегливої праці».
VII. ДОМАШНЄ ЗАВДАННЯ.
- Опрацювати параграф
- Переписати таблицю із формулами кислот в зошити.
- Вивчити формули й назви кислот.
- Скласти ребус на тему „Кислоти”. (слайд)
VIII. ОЦІНЮВАННЯ НАВЧАЛЬНИХ ДОСЯГНЕНЬ УЧНІВ.
1


про публікацію авторської розробки
Додати розробку
