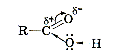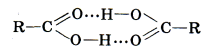Урок з хімії "Карбонові кислоти"
Х І Д З А Н Я Т Т Я
структура заняття
|
Час |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
55 |
60 |
65 |
70 |
75 |
80 |
85 |
90 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
№ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Використання |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Зміст заняття |
|||||||||||||||||||
|
методи |
|
||||||||||||||||||
|
1 |
2 |
3 |
|||||||||||||||||
|
1.
2.
3.
4.
5.
6.
7.
|
Організаційний момент. 1.1. Звіт чергового. 1.2. Перевірка домашнього завдання.
Актуалізація опорних знань.
МЕТА: повторити і закріпити раніше набуті знання та підготувати до свідомого сприйняття нових знань. Методи контролю: фронтальне усне опитування та тестове опитування на ПК.
2.1. Тестове опитування на ПК. 2.2. Індивідуальне самостійне опитування. 2.3. Фронтальне усне опитування:
2.3.1. Які сполуки називають альдегідами? Назвіть основні представники гомологічного ряду альдегідів. 2.3.2. Які види ізомерії характерні для альдегідів? 2.3.4. Які фізичні властивості альдегідів? 2.3.5. Які органічні сполуки утворюються при частковому окисненні альдегідів? Наведіть приклади реакцій. 2.3.6. Які органічні сполуки утворюються при відновленні альдегідів? Наведіть приклади реакцій. 2.3.7. Які основні способи добування альдегідів Вам відомі? 2.3.8. Які сполуки називають кетонами? Що відмінного у структурі альдегідів і кетонів? 2.3. 9. Які основні галузі застосування альдегідів Вам відомі?
Мотивація навчальної діяльності, повідомлення теми та мети заняття.
Мурашина кислота застосовується в промисловості як сильний відновник. Її спиртовий розчин (мурашиний спирт) застосовується в медицині, текстильній промисловості. Оцтова кислота використовується для синтезу барвників, лікарських препаратів, у харчовій промисловості. Велике значення мають вищі насичені та ненасичені кислоти.
Тема заняття: “Карбонові кислоти”. 3.1 План заняття. 3.1.1. Класифікація карбонових кислот. 3.1.2. Склад, будова молекули карбонових кислот. 3.1.3. Гомологічний ряд, номенклатура та ізомерія насичених одноосновних кислот. 3.1.4. Добування карбонових кислот. 3.1.5. Фізичні та хімічні властивості карбонових кислот. 3.1.6. Застосування карбонових кислот. Характеристика представників карбонових кислот. Вивчення нового матеріалу. Метод: інформаційно-повідомлюючий, частково-пошуковий, навчання. Прийом: бесіда, повторювально-узагальнююча бесіда. 4.1. Класифікація карбонових кислот.
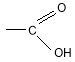
Карбоновими кислотами називають органічні речовини, молекули яких містять одну або кілька карбоксильних груп Карбонові кислоти класифікують:
4.2. Склад, будова молекули карбонових кислот. Як відомо, у карбонільній групі зв’язок полярний: електронна густина від атома Карбону зміщена до атома Оксигену, тому на карбонільному атомі Карбону з’являється частковий позитивний заряд. Намагаючись компенсувати свій заряд, атом Карбону відтягує до себе неподілену пару електронів атома Оксигену гідроксильної групи. У свою чергу атом Оксигену відтягує електронну густину зв’язку О–Н, внаслідок чого атом Гідрогену стає рухливим і легше відщеплюється у вигляді протона:
Більша полярність зв’язку О–Н в карбоксилі, ніж у спиртів, зумовлює міцніші міжмолекулярні водневі зв’язки, утворені за рахунок карбонільного Оксигену однієї молекули і Гідрогену карбоксилу іншої молекули кислоти. Рідкі кислоти, складаються із спарених молекул – димерів:
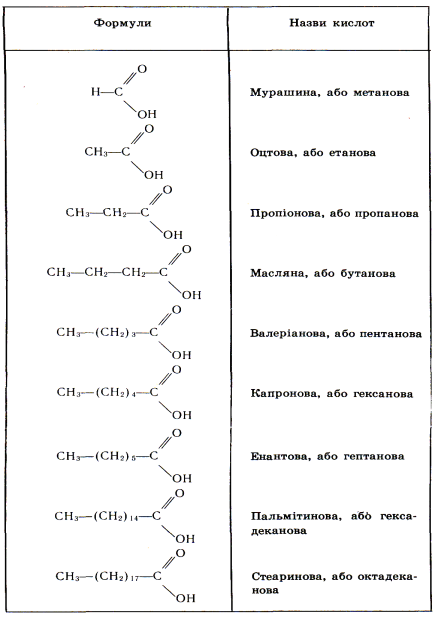
Завдяки тому, що кислоти легко утворюють два водневі зв’язки, димери їх міцні, а температури кипіння вищі, ніж у спиртів. Таким чином, водневий зв’язок у кислотах зумовлює їх відносно високі температури кипіння і розчинність у воді. Розчинність кислот знижується зі збільшенням їхньої молекулярної маси, тобто зі збільшенням в їхніх молекулах вуглеводневого радикала. 4.3. Гомологічний ряд, номенклатура та ізомерія насичених одноосновних кислот. Для найпоширеніших карбонових кислот часто використовуються такі історичні назви, як мурашина, масляна, валеріанова тощо. Ці назви пов’язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурашина – з мурашок (лат. formica – мураха), оцтова – з оцту, масляна – з масла. За систематичною номенклатурою(ІЮПАК) назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них закінчення -ова і слово кислота. Головний ланцюг у молекулі кислоти вибирають так, щоб у нього обов’язково входила карбоксильна група. Положення радикалів у вуглеводневому ланцюзі позначають цифрами. Нумерацію ланцюга починають з атома Карбону карбоксильної групи. Наприклад: НСООН – метанова кислота; СН3СООН – етанова кислота; 2,4-диметилпентанова та 2,3-диметилгексанова кислота.
Ізомерія. Для кислот характерна ізомерія карбонового ланцюга та ізомерія з естерами (С3Н6О2 – пропанова (пропіонова) кислота та оцтовометиловий естер (метилетаноат).
Гомологічний ряд насичених одноосновних карбонових кислот.
4.4. Методи добування карбонових кислот. 1. Окиснення альдегідів:
2. Окиснення спиртів:
3. Окиснення алканів:
4. З солей карбонових кислот:
натрій стеарат стеаринова кислота
4.5. Фізичні та хімічні властивості карбонових кислот. Фізичні властивості. Перші три представники гомологічного ряду кислот – мурашина, оцтова, пропіонова – безбарвні рідини з гострим подразливим запахом, які змішуються з водою в будь-яких співвідношеннях. Починаючи з масляної кислоти, йдуть маслянисті рідини з неприємним запахом (запах згірклого масла), вищі кислоти (з С10) – тверді речовини, без запаху і нерозчинні у воді. Температури кипіння наведених кислот монотонно підвищуються. Кислоти мають вищі температури кипіння, ніж спирти з такою самою кількістю атомів Карбону у молекулі, що зумовлено асоціацією молекул кислот за рахунок водневого зв’язку. Хімічні властивості карбонових кислот.
Хімічні властивості карбонових кислот зумовлені передусім наявністю в їхніх молекулах гідроксильної групи. На відміну від спиртів розчинні у воді кислоти мають характерний кислий смак, забарвлюють лакмус у червоний колір, проводять електричний струм.
Проте порівняно з мінеральними кислотами, такими, як НС1, H2SO4 та іншими, органічні кислоти набагато слабкіші, але сильніші від карбонатної кислоти. Усі карбонові кислоти – слабкі електроліти (НСООН – середньої сили). Зі збільшенням вуглеводневого радикала сила кислот знижується. Введення галогену до вуглеводневого радикала збільшує силу карбонових кислот. Карбонові кислоти вступають у реакції, властиві неорганічним кислотам. Вони взаємодіють з активними металами, основними оксидами, основами, солями вугільної кислоти. 2. Взаємодія з металами з виділенням водню і утворенням солей.
|
Персональний комп’ютер
Презентація мультимедійний проектор, ПК
Завдання здобувачам освіти: написати структур- ну формулу пропіл- бутаноату та визна- чити ізомером якої кислоти він є.
Завдання здобувачам освіти: назвати вихідні продукти реакцій.
Хімічний експеримент
Хімічний експеримент
Хімічний експеримент
Завдання здобувачам освіти: написати реакцію «срібного дзеркала» для пропаналю.
|
|||||||||||||||||
В – 1
1. Здійснити перетворення, назвати всі речовини: (6 балів)
![]() CH3ONa
CH3ONa
![]() CH4 → CH3Cl → CH3OH
CH4 → CH3Cl → CH3OH
CO2
2. Написати два ізомера 1-гексанолу, назвати за ІЮПАК номенклатурою. (4 бали)
3. Які органічні сполуки називають спиртами ? (2 бала)
В – 2
1. Здійснити перевторення, назвати всі речовини: (6 балів)
O O
// //
С2Н2 → СН3 – С → CH3 – C
↓ \ \
C2H4 H OH
↓
С2Н5ОН
2. Написати два ізомера пентаналю, назвати за ІЮПАК номенклатурою. (4 бали)
3. Які органічні сполуки називають альдегідами ? (2 бала)
В – 3
1. Здійснити перетворення:
![]() етанол → етилен → дихлоретан
етанол → етилен → дихлоретан
оцтовий альдегід → етанол
2. Написати два ізомера 2-октанолу, назвати за ІЮПАК номенклатурою. (4 бали)
3. Поясніть різницю між гомологами та ізомерами. (2 бала)


про публікацію авторської розробки
Додати розробку

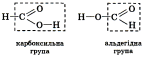
 , сполучених з вуглеводневим радикалом. Карбоксильна група називається так тому, що складається з карбонільної групи
, сполучених з вуглеводневим радикалом. Карбоксильна група називається так тому, що складається з карбонільної групи 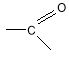 і гідроксильної –ОН. Загальна формула речовин цього класу С
і гідроксильної –ОН. Загальна формула речовин цього класу С