Урок з теми:"Арени"
10 клас.
ПЛАН УРОКУ №____ Група______
Дата_______
Тема програми: Вуглеводні
Тема уроку: Арени. Загальна формула, ізомерія, номенклатура. Фізичні та хімічні властивості бензену
Мета уроку:
формування ключових компетентностей:
- основні компетентності у природничих науках і технологіях – пояснювати природні та технологічні процеси на основі знань про арени;
- спілкування державною мовою – використовувати в мовленні хімічні терміни, поняття, терміни, сучасну українську термінологію і номенклатуру;
- екологічна грамотність і здорове життя – використовувати хімічні знання про алкани для пояснення користі і шкоди здобутків хімії і хімічної технології для людини і довкілля;
- соціальна і громадська компетентності – співпрацювати з іншими в групі для розв’язання поставлених питань з використанням хімічних знань;
формування предметних компетентностей:
- формувати знання здобувачів освіти про насичені вуглеводні, їх номенклатуру та ізомерію, вміння давати назви насиченим вуглеводням розгалуженої будови та складати формули можливих структурних ізомерів;
- розвивати хімічну мову, логічне й екологічне мислення;
- виховувати творчу особистість з креативним мисленням, зацікавлену вивченням предмету, з бережливим ставленням до використання енергоресурсів на прикладі алканів.
Тип уроку: урок формування компетентностей.
Методи та форми навчання: фронтальна робота, індівідуальна робота, бесіда, робота в парах .
Базові поняття та терміни: арени, гомологи, гомологічний ряд, радикал, ізомери, систематична номенклатура.
Обладнання та матеріали: підручник О.Г.Ярошенко, Хімія 10 клас, моделі вуглеводнів, роздавальний матеріал (опорні конспекти), картки-завдання.
Ключові компетентності: спілкування державною мовою, уміння вчитись впродовж життя, естетична компетентність.
Очікувані результати: здобувач освіти називає арени за систематичною номенклатурою; загальну формулу аренів; наводить приклади аренів, їх назви; хімічні властивості.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ МОМЕНТ-2*
Привітання. Перевірка готовність робочого місця здобувачів освіти до уроку, та присутніх.
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ І МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ.
1.Що таке насичені вуглеводні? Наведіть приклад.
2.Як утворюються назви алкенів та алкінів?
3.назвіть правила назви вуглеводнів.
4.Назвіть формулу алканів, алкенів, алкінів.
IІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
https://www.youtube.com/watch?v=MtVSdpymzv8
Існують сполуки Карбону з Гідрогеном, у молекулах яких атоми Карбону сполучаються один з одним у замкнуті цикли. Це циклічні вуглеводні. Особливу групу серед циклічних складають арени (ароматичні) сполуки. Загальна формула ароматичних вуглеводнів — CnH2n−6. Найпростіший представник — бензен.Молекулярна формула бензену — C6H6. Структурну формулу бензену можна зобразити наступним чином:
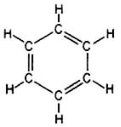
Скорочені структурні формули:
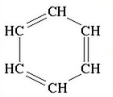
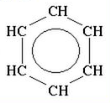
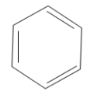
Точніше будову бензену відображає остання формула, оскільки у його молекулі відсутні подвійні зв'язки, а утворюється особливий вид ковалентного зв'язку — шестиелектронна система, зображена у вигляді кільця всередині шестикутного циклу. Використовують також скелетні формули бензолу, в яких не вказані атоми Карбону:
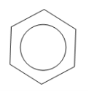
Назви аренів
Назва аренів за систематичною номенклатурою складається з назви вуглеводневого замісника і слова «бензен»:
метилбензен (толуол): C6H5−CH3 або 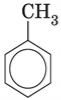 ;
;
етилбензен: C6H5−C2H5;
пропілбензен: C6H5−C3H7.
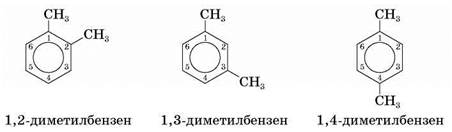
Якщо замісників декілька — положення кожного з них зазначається номером атома Карбону, з яким від зв'язан:
1, 2 — диметилбензен: 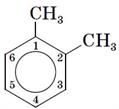 ;
;
1, 3 — диметилбензен: 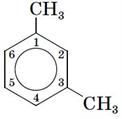 .
.
Бензен є стійким проти дії окисників. Подібно до насичених вуглеводнів, він не змінює забарвлення розчину калій перманганату та не знебарвлює бромну воду.
ФІЗИЧНІ ВЛАСТИВОСТІ АРЕНІВ.
Бензен — безбарвна рідина з характерним запахом, нерозчинна у воді й легша за неї. Він добре розчиняється в різних органічних розчинниках, і сам є розчинником багатьох органічних речовин. Бензен — дуже токсична речовина, вдихання навіть незначної кількості парів якої викликає запаморочення й головний біль. За більш високої концентрації бензену в повітрі людина може втратити свідомість. Бензен здатний проникати через шкіру. Так само небезпечні для довкілля викиди підприємств і смог, до складу яких входить бензен. У роботі з бензеном необхідно неухильно дотримуватися правил безпеки, усі досліди проводити під витяжкою, уникати потрапляння на відкриті ділянки шкіри.
ХІМІЧНІ ВЛАСТИВОСТІ БЕНЗЕНУ.
Наявність особливого ароматичного хімічного зв'язку, в утворенні якого беруть участь відразу шість р-електронів, визначає хімічні властивості бензену та його гомологів.
Характерними для бензену є реакції, що відбуваються зі збереженням ароматичного зв'язку. Приклад — реакції заміщення атома Гідрогену атомом галогену.
1.Реакції заміщення
На відміну від ненасичених вуглеводнів, для бензену характерні реакції заміщення.
Реакції галогенування.
Бензен вступає в реакцію з хлором (або бромом) у присутності каталізатора (хлоридів або бромідів Феруму(III) або Алюмінію). При цьому утворюються хлоробензен і гідроген хлорид:
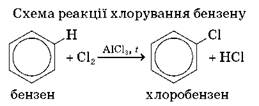
або
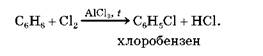
2. Реакції приєднання. Бензен вступає також у реакції приєднання, але важче, ніж алкени чи алкіни. У цих реакціях ароматичний зв'язок руйнується, внаслідок чого в молекулі з'являється шість (по одному біля кожного атома Карбону) неспарених електронів. Вони беруть участь в утворенні шести одинарних ковалентних хімічних зв'язків з атомами реагенту (водню чи галогену). Розглянемо це на прикладах.
2.1. Гідрування. Приєднання водню до бензену відбувається за підвищеної температури в присутності каталізаторів.
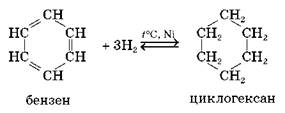
2.2. Приєднання галогенів. Як і приєднання водню, ця реакція відбувається за участю всіх атомів Карбону бензенового кільця завдяки розриву ароматичного зв'язку. Для її проведення реагенти опромінюють ультрафіолетом і нагрівають.
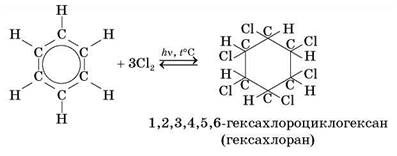
Хлорування бензену має практичне значення. Одержану речовину — гексахлоран — використовують у боротьбі з комахами (шкідниками полів і садів).
3. Окиснення бензену. Бензен стійкий до дії окисників і не знебарвлює розчин калій перманганату. Більш сильні окисники окиснюють його.
3.1. Горіння (повне окиснення) бензену. Бенезен легкозаймистий на повітрі й згорає кіптявим полум'ям унаслідок високого вмісту Карбону в молекулі.
2С6Н6 + 15О2 → 12СО2 + 6Н2О; ΔΗ = 3135,6 кДж
З повітрям і киснем бензен утворює вибухонебезпечні суміші.Від будови молекули бензену залежать його властивості. У реакції заміщення він вступає легше, ніж алкани, у реакції приєднання — важче, ніж алкени. Бензен використовують у виробництві пластмас, барвників, отрутохімікатів, лаків, вибухових речовин, синтетичних волокон, ліків та багатьох інших органічних речовин.
Сторінка ерудита
Назва аренів за систематичною номенклатурою складається з назви вуглеводневого замісника (префікс) і слова бензен (корінь).

Якщо замісників два чи більше, положення кожного зазначають номером атома, з яким він зв'язаний. Нумерацію кільця проводять так, щоб локанти замісників були найменшими. Наприклад:
ІV. УЗАГАЛЬНЕННЯ ТА ЗАКРІПЛЕННЯ ЗНАНЬ
1. Установіть відповідність між вуглеводнем і класом, до якого він належить.
Вуглеводень Клас речовин
1 Гексин Алкан
2 Гексен Арени
3 Бензен Алнін
4 Гексан Алкен
Алкадієни
2. Вкажіть правильне твердження щодо фізичних властивостей бензену.
А важчий за воду
Б має специфічний запах
В темно-бурого кольору
Г розчинний у воді
3. Проаналізуйте твердження, та з’ясуйте правильне.
I. Бензен і бутан мають однаковий якісний склад.
II. Гідрування бензену належить до реакцій розкладу.
III. Бензен — оксигеновмісна органічна речовина.
IV. Бензен — отруйна речовина.
Правильні з-поміж них лише...
- А І і III
- Б І і IV
- В II і III
- Г II і IV
4. Розташуйте речовини за збільшенням кількості атомів Гідрогену в молекулі.
А етен
Б пропан
В бензен
Г етин
• Бензен С6Н6 — найпростіший представник вуглеводнів класу арени.
• Молекула бензену має особливий ковалентний хімічний зв'язок, утворений одночасним перекриванням електронних хмар шести р-електронів. Тому, незважаючи на різницю в кількісному складі молекул гексену й бензену, якісні реакції з бромною водою та розчином калій перманганату для бензену не властиві.
• Для бензену більш характерні реакції заміщення зі збереженням бензенового кільця, ніж приєднання з його розривом.
VІ. ВИСТАВЛЕННЯ ОЦІНОК ТА ЇХ МОТИВАЦІЯ
Оцінки виставляю в електронний журнал, в журнал теорії та в щоденники.
Опрацювати конспект. § 8 підручнику О.Г Ярошенко– Хімія 10 кл.



про публікацію авторської розробки
Додати розробку
