урок "Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Одержання етанової кислоти"
Тема уроку: Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Одержання етанової кислоти.
Мета уроку:
• формування ключових компетентностей:
• спілкування державною мовою;
• уміння вчитися впродовж життя;
• екологічна грамотність і здорове життя;
• інформаційно-цифрова компетентність;
• математична компетентність;
• соціальна та громадська компетентність;
• формування предметних компетентностей:
• формувати знання учнів про хімічні властивості одноосновних карбонових кислот;
• показати взаємний вплив карбоксильної групи та вуглеводневого радикала;
• формувати поняття про кислотність карбонових кислот;
• показати подібність властивостей карбонових кислот до властивостей неорганічних кислот і ознайомити зі специфічними властивостями карбонових кислот (реакції за карбоксильною групою й вуглеводневим радикалом);
• одержання етанової кислоти;
• з’ясувати галузі використання карбонових кислот;
• розвивати вміння й навички складання структурних формул і рівнянь хімічних реакцій на прикладі властивостей карбонових кислот;
• розвивати хімічну мову;
• виховувати інтерес до вивчення хімії.
Тип уроку: комбінований.
Форма роботи: групова, фронтальна, начальна лекція, евристична бесіда, демонстрація.
Обладнання:ноутбуки або мобільні пристрої.
Хід уроку
I. Організація групи. Під’єднання учасників до зустрічі
ІІ. Актуалізація життєвого досвіду і опорних знань
Кислоти оточують нас скрізь. Розглянемо кілька прикладів, у яких кислоти утворюються за рахунок процесів у неживій природі. Так, у воді, за рахунок розчинення вуглекислого газу з атмосфери, завжди є карбонатна кислота.
Після грози в дощовій воді опиняється ще й нітратна кислота. Виверження вулканів сприяють появі в дощовій воді сульфатної кислоти H2SO4 (мал. 65).
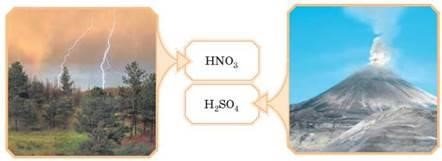
Мал. 65. Утворення кислот у неживій природі
У живій природі кислот більше. Здебільшого це органічні кислоти, ви будете вчити їх пізніше. Вони є в нашій їжі. Фрукти, овочі, молочні продукти, ліки містять кислоти: яблучну, щавлеву, лимонну, мигдальну, молочну, масляну, кавову, оцтову, аскорбінову та інші. Молочна кислота є й у квашених овочах. Вона охороняє їх від гниття. Взагалі кисле середовище пригнічує розвиток гнильних бактерій.
Фронтальне опитування
1. До якого класу сполук належить оцтова кислота?
(карбонові кислоти)
2. Що таке карбонові кислоти?
(це органічні оксигеновмісні сполуки, що містять одну або кілька карбоксильних груп –COOH, сполучених з вуглеводневим радикалом)
3. Загальна формула карбонових кислот? ( R ― COOH )
4. Молекулярна формула оцтової кислоти?
CH3COOH
Проаналізуйте дані таблиці
«Фізичні властивості карбонових кислот» та охарактеризуйте фізичні властивості карбонових кислот:
Таблиця Фізичні властивості карбонових кислот
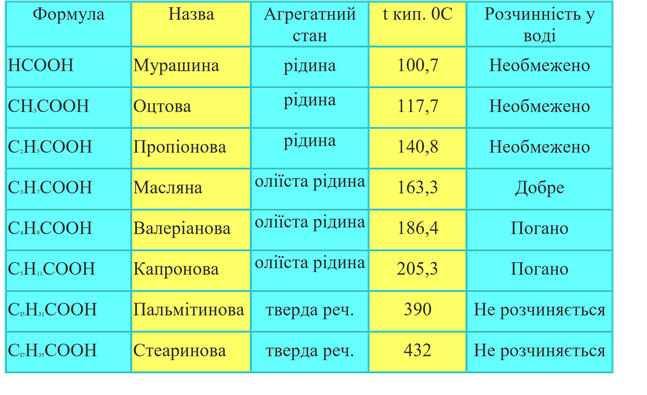
Орієнтовна відповідь:
Якщо число атомів вуглецю в ланцюзі не перевищує п'яти, то ці різко пахнуть, рухливі і леткі рідини.
Вище п'яти - важкі маслянисті речовини, ще більше - тверді, парафіноподібні.
Щільність перших двох представників перевищує одиницю.
Всі інші легше води.
Температура кипіння: чим більше ланцюг, тим вище показник. Чим більш розгалужена структура, тим нижче.
Температура плавлення: залежить від парності кількості атомів вуглецю в ланцюгу. У парних вона вище, у непарних нижче.
У воді розчиняються дуже добре.
Здатні утворювати міцні водневі зв'язки.
ІІІ. Повідомлення теми, мети, мотивація навчальної діяльності
 Які завдання стоять перед нами?
Які завдання стоять перед нами?
1. Хімічні властивості карбонових кислот на прикладі етанової кислоти.
2. Специфічні властивості етанової кислоти.
3. Добування карбонових кислот 4. Застосування етанової кислоти ІV. Вивчення нового матеріалу Хімічні властивості карбонових кислот на прикладі етанової кислоти.
Що ми знаємо про оцтову кислоту?
Оцтова кислота — представник насичених карбонових кислот. Її молекула містить два атома Карбону, один з яких входить до складу функціональної групи. Інша назва оцтової кислоти — етанова, ацетатна.
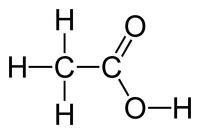
Скорочена формула оцтової кислоти CH3COOH, молекулярна — C2H4O2.
Оцтова кислота — безбарвна рідина з характерним різким запахом, необмежено розчинна у воді.
Нагадати учням правила безпеки під час роботи з кислотами
Порвняємо хімічні властивості органічних кислот (на прикладі етанової)
та неорганічних

Висновок: Карбонові кислоти виявляють усі загальні властивості, які характерні для неорганічних кислот, але в хімічних взаємодіях поводяться як слабкі кислоти.
Специфічні властивості етанової (оцтової) кислоти:
1. Реакції відновлення, які не характерні для неорганічних кислот. Так, вони взаємодіють з воднем при нагріванні в присутності каталізаторів, утворюючи спирти:
СН3COOH (етанова кислота) + 2Н2 → CH3CН2OН (етанол) + Н2О
2. Реакція естерифікації
Карбонові кислоти вступають у реакції етерифікації зі спиртами.
Розглянемо реакцію між етановою кислотою і етанолом:
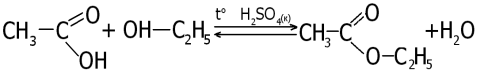
Дана реакція називається рекцією естерифікації, оскільки внаслідок реакції утворюється естер — етиловий етанової кислоти (етилацетат або етилетаноат).
Реакція, яка відбувається в протилежному напрямку, називається гідролізом.
3. Повне окиснення (горіння)
CH3COOH + 2O2 = 2H2O + 2CO2
Цікаві історичні факти 1. Римський історик Кай Пліній Старший (23-79 рр. до н.е.) переказав легенду про перлини Клеопатри. Єгипетська цариця влаштувала бенкет на честь римського полководця Марка Антонія. А треба сказати, що серед скарбів казково багатої Клеопатри найбільше славилися сережки з величезними грушоподібними перлинами, масу яких історики оцінювали в 40,2 г. Бажаючи вразити римського гостя, Клеопатра розчинила одну з перлин в кубку з вином і випила це вино за здоров’я Антонія.
Ось як це описано в повісті Г. Хаггарда „Клеопатра – володарка зорі”: „...Вона вийняла з вуха одну з величезних перлин...і... опустила її в оцет. Запала мовчанка, вражені гості, завмерши, спостерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. От від неї не залишилось і сліду, і тоді Клеопатра підняла кубок, покрутила його, і випила весь до останньої краплі.”
Перли – це перламутр, який складається з шестикутних пластинок арагоніту. Хімічна формула його CaCO3 (кальцій карбонат). А кальцій карбонат легко взаємодіє навіть з дуже слабкими кислотами (до яких відноситься і оцтова). Відбувається реакція нейтралізації. Чим свого часу і скористалася знаменита Клеопатра.
СаСО3 + 2СН3СООН = (СН3СОО)2Са + Н2О + СО2 ↑

На полотні «Бенкет Клеопатри» зображено композицію, яка є одним з варіантів улюбленого Тьєполо сюжету. Клеопатра, єгипетська цариця, знявши із себе перлину небаченої величини, показує її Антоніо перед тим, як опустити в келих з оцтом (його тримає вартий позаду мавр). Клеопатра, розстаючись із безцінним скарбом, показує своєму коханому, що ніщо у світі, крім його любові, нецінне для неї.
 2. Герої роману Жюля Верна «Діти капітана Гранта» тільки збиралися повечеряти м’ясом підстреленої ними дикої лами (гуанако), як раптом з’ясувалося, що воно абсолютно не їстівне. «Можливо, воно занадто довго лежало?» – Спантеличено запитав один з них. «Ні, воно, на жаль, занадто довго бігло! – Відповів учений-географ Паганель. – М’ясо гуанако смачне тільки тоді, коли тварина вбита під час відпочинку, але якщо за нею довго полювати і тварина довго біжить, тоді її м’ясо неїстівне». Навряд чи Паганель зумів би пояснити причину описаного ним явища. Але сьогодні зробити це зовсім неважко. Саме молочна кислота зробила несмачним м’ясо тварини, підстреленої героями Жуля Верна.
2. Герої роману Жюля Верна «Діти капітана Гранта» тільки збиралися повечеряти м’ясом підстреленої ними дикої лами (гуанако), як раптом з’ясувалося, що воно абсолютно не їстівне. «Можливо, воно занадто довго лежало?» – Спантеличено запитав один з них. «Ні, воно, на жаль, занадто довго бігло! – Відповів учений-географ Паганель. – М’ясо гуанако смачне тільки тоді, коли тварина вбита під час відпочинку, але якщо за нею довго полювати і тварина довго біжить, тоді її м’ясо неїстівне». Навряд чи Паганель зумів би пояснити причину описаного ним явища. Але сьогодні зробити це зовсім неважко. Саме молочна кислота зробила несмачним м’ясо тварини, підстреленої героями Жуля Верна.
Добування етанової кислоти
Зараз в світі природним методом видобувається лише 10% загального обсягу виробництва оцтової кислоти.
Але натуральний метод бродіння по колишньому важливий, тому що в багатьох країнах діють закони, згідно з якими в харчовій промисловості повинна використовуватися лише оцтова кислота біологічного походження.
При біохімічному виробництві добавки Е260 використовується здатність деяких бактерій окислювати етанол (спирт).
Даний метод відомий як оцтовокисле бродіння. В якості сировини для виробництва добавки Е260 використовуються загравші соки, вино або ж розчин спирту у воді.
Існує також ряд методів синтезування оцтової кислоти в промисловості.
Найпопулярніший з них, на який припадає більше половини світового синтезу оцтової кислоти, полягає в карбонилювания метанолу в присутності каталізаторів. Вихідними складовими для даної реакції є метанол (CH3 OH) і окис вуглецю (CO)
1. Основним промисловим способом добування етанової кислоти є окислення етаналю
![]()
Сировиною служить метан –головна частина природного газу, з якого добувають етин, а з етину – етаналь, який і окислюють до етановою кислоти.
2. У харчовій промисловості етанову кислоту добуають біохмічним окисленням (за допомогою бактерій) окисленням етанолу:
С2Н5ОН + О2 → СН3СООН + Н2О
Деякі бактерії, зокрема, роди Acetobacter і Clostridium, виробляють кислоту в процесі своєї життєдіяльності.
Використання людиною подібних ферментаційних процесів відоме ще з давніхдавен. Таким чином утворюється низькоконцентрована оцтова кислота, яка цілком задовольняє побутові потреби.
5. Застосування етанової кислоти
Кислоти є одними з найважливіших речовин у промисловості, і не тільки в хімічній. Найбільша увага приділяється сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх добувають на хімічних заводах у величезних кількостях, особливо сульфатну. Часто навіть про рівень розвитку якої-небудь країни судять по тому, скільки вона виробляє сульфатної кислоти. А це саме тому, що сульфатну кислоту (як і інші кислоти) використовують майже у всіх галузях народного господарства. Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні добрива тощо. Величезні об`єми сульфатної кислоти витрачаються у виробництві кольорових металів, мийних засобів, ліків і барвників, вибухових матеріалів, акумуляторів і сірників. У великих кількостях кислоти використовує і харчова промисловість, і не тільки як смакові приправи для надання кислого смаку. В більшості випадків кислоти (оцтова, лимонна, бензойна, винна, щавлева) використовуються як консерванти – речовини, які уповільнюють псування харчових продуктів.
Майже в кожному домі є оцет (розчин оцтової кислоти) і лимонна кислота для приготування їжі. В домашній аптечці завжди знайдеться аскорбінова кислота (вітамін С), ацетилсаліцилова кислота (аспірин) і борна кислота (її розчин використовується для дезінфекції). (Учитель демонструє добавки та ліки, про які йде мова.)
Етанова кислота використовується для виробництва штучного шовку, пластмас, барвників, ліків (аспірину).

Є відмінним консервантом, тому застосовується для консервування харчових продуктів.
З етанової кислоти отримують гербіциди для боротьби з бур'янами.

Складні ефіри етанової кислоти входять до складу фруктових есенцій.

V. Закріплення нових знань
Бліц опитування:
1. Яку кислоту використовують для консервування та маринування? (Оцтову кислоту)
2. Яку кислоту містять молочнокислі продукти? (Молочну кислоту)
3. Про утворення якої кислоти свідчать прогірклий смак і специфічний запах масла? (Масляної кислоти)
4. Як по-іншому називається метанова кислота? (Мурашина кислота)
5. Чому болять ікри ніг після тривалого бігу? (У м’язах утворюється молочна кислота)
6. Яка кислота міститься в бурштині? (Бурштинова кислота)
7. Ви отримали опіки кропивою. Місце укусів свербить і болить. Що це за речовина? Що будете робити?
Напишіть формулу кислоти. (НСООН)
Напишіть назву речовини, яка є в кожного з нас вдома (харчова сода – NaHCO3), за допомогою якої ви можете зменшити біль і свербіж.
Складіть рівняння реакції:
HCOOH + NaHCO3 = HCOONa + H2O + CO2↑
Справа в тому, що так кропива захищається від травоїдних тварин. На її листочках і стеблі знаходиться велика кількість волосків, які за своєю будовою схожі на ампули в яких всередині є «отрута». Коли ми торкаємося до цих волосків, їх кінчики відламуються, проколюють поверхню шкіри і залишаються на зразок жала.
VІ. Підведення підсумків уроку
VІІ. Домашнє завдання
1. Опрацювати за електронним підручником «Хімія (рівень стандарту)» підручник для 10 класу закладів загальної середньої освіти (авт.
Ярошенко О. Г.), сторінки 99-102 https://drive.google.com/file/d/1elbAxBsmZgRQLYbD_kvBazfeypY6Y arD/view
3. Виконати інтерактивну вправу на закріплення матеріалу
https://learningapps.org/16889802

4. Творче завдання: підготувати слайд-шоу, учнівські газети (плакати) на такі теми:
• Перше застосування оцтової кислоти.
• Підготувати з допомогою батьків “Рецепти консервування овочів”.
• З’ясуйте де в світі є музей оцту.
• Які мистецькі твори присвячені цій смакові приправі.

про публікацію авторської розробки
Додати розробку
