Урок з теми: "Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20."
№ 8
Дата: ____________
Тема: Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20.
Очікувані результати: учень характеризує розподіл електронів (за енергетичними рівнями та підрівнями) в атомах перших 20 хімічних елементів; аналізує інформацію, закладену в періодичній системі, та використовує її для характеристики хімічного елемента;
Тип уроку: засвоєння вмінь і навичок.
Методи навчання: словесні, наочні, практичні.
Клас: 8 клас.
Обладнання: ПСХЕ Д. І. Менделєєва.
Хід уроку
I. Організаційна частина.
II. Актуалізація опорних знань.
Фронтальна бесіда
- Як визначити кількість електронів у атомі?
- Чому атоми електронейтральні, адже вони складаються з позитивних протонів, негативних електронів і нейтральних нейтронів?
- Чому говорять, що електрон має двоїсту природу?
- Чи всі електрони в атомі однакові?
- Чим вони відрізняються?
- Що таке орбіталь?
- Які форми може мати електронна хмарина?
- Яка максимальна кількість електронів може перебувати:
а) на s-підрівні;
б) на p-підрівні;
в) на d-підрівні;
г) на f-підрівні.
- Як розподіляються електрони в атомі?
- Яка кількість енергетичних рівнів може бути в атомі?
- Як визначити їх кількість за положенням у періодичній системі?
- Як визначити кількість електронів на зовнішньому енергетичному рівні?
- Як розподіляються електрони по енергетичних рівнях?
Аналіз самостійної роботи.
III. Вивчення нового матеріалу.
На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2.
|
Номер рівня |
Максимальна кількість електронів |
Підрівні |
|
1 |
2 |
s |
|
2 |
8 |
s, p |
|
3 |
18 |
s, p, d |
|
4 |
32 |
s, p, d, f |
|
5 |
50 |
s, p, d, f, g |
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду – два, третього – три і т. д. Кожний енергетичний рівень складається з орбіталей певної форми: перший містить одну s - орбіталь, другий – s- і р - орбіталі, третій – s-, р-, d -орбіталі.
Число орбіталей на енергетичних рівнях різне, воно дорівнює п2, де п — номер рівня. На першому рівні (п = 1) одна s-орбіталь, на другому (п = 2) — чотири: одна s- і три р - орбіталі, на третьому (п = 3) – дев'ять: одна s-, три р- і п'ять d-орбіталей. Зважаючи на те, що на кожній з орбіталей може перебувати не більше двох електронів, максимальна кількість електронів на тому чи іншому енергетичному рівні дорівнює 2n2.
Розміщення електронів по енергетичним рівням:
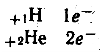


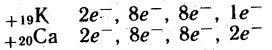
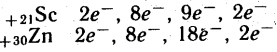
![]()
IV. Закріплення знань.
1) Загальне число електронів у атомі дорівнює номеру елемента в періодичній системі хімічних елементів.
2) Число енергетичних рівнів у атомі дорівнює номеру періоду, в якому знаходиться елемент.
3) Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, в якій знаходиться хімічний елемент.
4) Заповнення електронами р-підрівня здійснюється відповідно до правила максимального сумарного спіну.
Для пояснення будови електронних оболонок атомів слід знати три наступних основних положення:
1. Принцип Паулі.
В атомі не може бути двох електронів у яких всі чотири квантові числа були б однакові.
2. Принцип найменшої енергії (правило В. М. Клечковського, також використовується назва «правило Маделунга»).
Для побудови електронної конфігурації основного стану атома або йона необхідно заповнювати електронами вільні орбіталі з найменшою енергією.
(електрон займає в основному стані рівень не з мінімально можливим значенням n , а з найменшим значенням n+l)
1 2 3 4 5 6 7
![]()
![]()
![]()


1 s
2 s 2 p
3 s 3 p 3 d
4 s 4 p 4 d 4 f
5 s 5 p 5 d 5 f
6 s 6 p 6 d 6 f
7 s 7 p 7 d 7 f
Отже, розподіл підрівнів за енергіями виражається рядом:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 6f, 7d, 7f
![]() менша енергія більша енергія
менша енергія більша енергія
3. Правило Гунда.
В основному стані (тобто у стані з найменшою енергією) атом (йон) моє максимально можливе число неспарених електронів у межах однієї орбіталі.
Характеристика розподілу електронів (за енергетичними рівнями та підрівнями) в атомах перших 20 хімічних елементів.
V. Підсумок уроку.
VІ. Домашнє завдання.
Опрацювати §
Письм. №


про публікацію авторської розробки
Додати розробку
