Урок з теми "Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники"."
Розробка уроку для 9 класу з теми "Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники" за новою програмою. Тип уроку: урок засвоєння нових знань, вироблення умінь та навичок.
Тема. Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники.
Навчальна мета:
- повторити зміст і взаємозв’язок процесів окиснення та відновлення;
-визначити місце окисно-відновних реакцій серед основних типів хімічних реакцій;
- закріпити знання основних понять та вміння визначати й застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення»;
-ознайомити зі значенням окисно-відновних реакцій у природі та на виробництві;
- сприяти вдосконаленню вміння визначати ступінь окиснення елементів у хімічних формулах, підбирати коефіцієнти методом електронного балансу, визначити тип окисно-відновної реакції
Розвиваюча мета: розвивати навички виконання простих хімічних експериментів
Виховна мета: формувати вміння працювати в парі, самостійно розподіляючи обов’язки; виховувати пізнавальний інтерес до предмета хімії, виховувати почуття відповідальності за спільну справу.
Тип уроку .Урок засвоєння нових знань
Форми роботи: фронтальна, групова, самостійна,керована практика.
Обладнання: гранули цинку , хлоридна кислота, мідний дріт, натрій гідроксид, картки із завданнями, штативи з пробірками, періодична система хімічних елементів.
«ВЧИМОСЯ НЕ ЗАРАДИ ШКОЛИ,
А ДЛЯ ЖИТТЯ»
Сенека
Хід уроку
I. Організація класу
II. Актуалізація опорних знань учнів
а) Фронтальне опитування у формі «мікрофону»
Кожен учень отримує питання від вчителя і дає відповідь у мікрофон
- За якими ознаками класифікують хімічні реакціі?
- Що таке реагенти і продукти хімічної реакції?
- Які реакції називаються реакціями сполучення?
- Які реакції називаються реакціями розкладу?
- Які реакції називаються реакціями заміщення?
- Які реакції називаються реакціями обміну?
- Що таке ступінь окиснення?
- Які реакції називаються окисно-відновними?
- Що таке відновник?
- Що таке окисник?
- Що таке електронегативність?
- Які є типи хімічного зв’язку?
б) Робота учнів біля дошки
1 учень. Визначити ступінь окиснення кожного елемента в формулах, речовин
HCl, N2, MgO, H2SO4, Ca3(PO4)2 , KMnO4 , H2S, SO2, K2Cr2O7, Cu(NO3)2, FeCl3, SO3.
2 учень Допишіть схеми, вкажіть процеси окиснення та відновленя:
Mn +2 --- Mn+7
N+5 ---N-3
N02 +6e ---
Al0 - 3e ---
S+6 ----S 0
Fe0 -3e ---
3 учень Здійснити перетворення. Вказати тип реакції.
Zn → ZnO → ZnCl2→Zn(OH)2 → ZnO
4 учень
Обчисліть масу розчину сульфатної кислоти ( масова частка кислоти 10%), необхідного для повного розчинення зразка цинку масою 13 г.
III. Мотивація навчальної діяльності
Учитель. Заслухаємо повідомлення учнів про значення окисно-відновних реакцій у природі та на виробництві. Презентація.
1-й учень. Людина здавна використовує окисно-відновні реакції у повсякденному житті, не замислюючись над природою цих процесів. Ще із сивої давнини людина навчилася використовувати ці процеси для обігрівання житла, приготування їжі, для виплавлення металів з руд та їх обробки. Людині були відомі процеси корозії (іржавіння) металів.
2-й учень. Так, крок за кроком, накопичувався практичний досвід використання окисно-відновних реакцій. Чимало їх було відкрито ще алхіміками. Вивчення окисно-відновних процесів продовжується і в наш час. І це легко пояснити. Але окисно-відновні процеси відіграють надзвичайно важливу роль у природі, виробництві, техніці та побуті.
3-й учень. Завдяки окисно-відновним процесам на ранніх стадіях існування нашої планети утворилися гірські породи та мінерали. Такі процеси, як виверження вулканів, згоряння метеоритних тіл, грозові розряди в атмосфері завжди супроводжувалися окисно-відновними реакціями.
4-й учень. У живій природі окисно-відновні реакції є основою всіх процесів обміну речовин, які є джерелом енергії (це фотосинтез, дихання, бродіння, гниття).
5-й учень. Окисно-відновні процеси використовуються у металургії під час виплавки чавуну та сталі, одержання та очищення кольорових, рідкісних металів.
6-й учень. В основі виробництв найважливіших неорганічних сполук, таких, як амоніак, сульфатна, нітратна, хлоридна кислоти, покладені процеси окиснення та відновлення.
Учитель. Отже, з цих коротких повідомлень ви довідалися про значення окисно-відновних процесів у житті людини та розвитку виробництва.
III. Вивчення нового матеріалу
Інструктаж з техніки безпеки. Проводять самі учні
1. Робота в групах з виконанням лабораторних дослідів (кожна група отримує картку із завданням).
Прешій групі пропонується виконати лабораторний дослід: «Взаємодія цинку з хлоридною кислотою».

Друга група виконує дослід з прожарювання мідного дроту.
Третя група виконує реакцію нейтралізації.
Na+1O-2H+1 + H+1Cl-1 = Na+1Cl-1 + H2+1O-2
Ця реакція не є окисно-відновною.
Після виконання лабораторних дослідів учні кожної групи доповідають класу про свої спостереження (1-ша група: виділення газу водню; 2-га група: утворення чорного нальоту на мідному дроті; 3-тя група: зникнення малинового забарвлення індикатора). Записують рівняння реакції на дошці методом електронного балансу і доводять чи є воно окисно-відновним чи ні.
Отже, ви побачили, що не у всіх реакціях змінюється ступінь окиснення елементів.
Окисно-відновні реакції часто важко урівняти, тому є певні секрети їх урівнювання . Презентація.
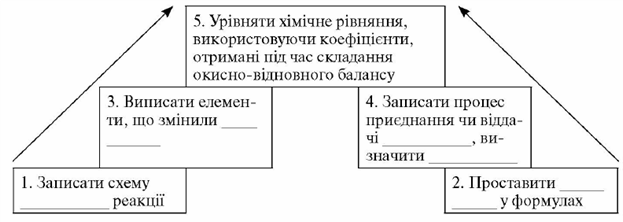
1. Запишіть схему хімічної реакції.
2. Проставте ступені окиснення елементів у формулах.
3. Випишіть елементи, які змінили ступінь окиснення.
4. 3апишіть процес приєднання чи віддачі електронів, визначте окисник та відновник.
5. Урівняйте схему хімічної реакції, використовуючи коефіцієнти, підібрані методом електронного балансу.
Алгоритм складання окисно-відновного рівняння методом електронного балансу
V. Закріплення навчального матеріалу
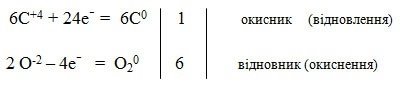
Скласти елктронний баланс до реакції процесу фотосинтезу:
6C+4O2-2 + 6H2+1O-2 = C60H12+1O6-2 + 6O20
Скласти електронний баланс до реакції спалювання вугілля:

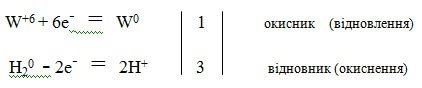
Скласти елктронний баланс до реакції добування вольфраму:
W+6O3-2 + 3H20 = W0 + 3H2+1O-2
Учні роблять висновки про значення окисно-відновних реакцій. Для закріплення поняття «окисник», «відновник» учням пропонується виступити з оповіданням – казкою, які вони готували, виконуючи домашнє завдання. (дивись додаток)
Метод «Мікрофон»
Продовжте речення:
Окисно-відновна реакція — це...
Ступінь окиснення — це...
За зміною ступеня окиснення реакції бувають: ...
Окисно-відновні реакції класифікують: ...
VI. Рефлексія
• Що нового ви дізналися на уроці?
• Що вам найбільше сподобалося?
• Що є найбільш складним у цій темі?
IV. Підбиття підсумків уроку
Учитель коротко характеризує роботу кожної групи. Пропонує учням зробити самооцінку та оцінку своїх товарищів за роботу на уроці.
V. Домашнє завдання
§15, вправа 118,121 ст.88
«Флуор – найсильніший окисник».
У Флуора , як і у всіх галогенів була своя заповітна мрія. Лише одного електрона не вистачало йому для нового щастя, щоб стати таким спокійним та горділивим як Неон. І вирішив він вкрасти електрон. Довго ходив таблицею, приглядався, в кого ж можна поцупити електрон. Оксиген, спостерігаючи за ним, трішки побоювався і швиденько подружився з двома Гідрогенами, утворивши Воду. «Ось тепер я переможу Флуор» - подумав зв’язаний з Гідрогеном Оксиген.
Вода вирішила побороти Флуор! Та де там! Флуор виявився сильнішим. Вода, якою гасили пожежу, сама загорілася у Флуорі.
2F2 + 2H2O = 4HF + O2.
Оксиген, який вважався окисником, у цій реакції перетворився на відновника. Так Флуор продемонстрував, що він найсильніший окисник.
1 учень. Визначити ступінь окиснення кожного елемента в формулах, речовин
HCl, N2, MgO, H2SO4, Ca3(PO4)2 , KMnO4 , H2S, SO2, K2Cr2O7,
Cu(NO3)2, FeCl3, SO3.
2 учень Допишіть схеми, вкажіть процеси окиснення та відновленя:
Mn +2 --- Mn+7
N+5 ---N-3
N02 +6e ---
Al0 - 3e ---
S+6 ----S 0
Fe0 -3e ---
3 учень Здійснити перетворення. Вказати тип реакції.
Zn → ZnO → ZnCl2→Zn(OH)2 → ZnO
4 учень
Обчисліть масу розчину сульфатної кислоти ( масова частка кислоти 10%), необхідного для повного розчинення зразка цинку масою 13 г.
Лабораторний дослід «Взаємодія цинку з хлоридною кислотою».
Покладіть у пробірку гранулу цинку. Додайте до неї 2 мл хлоридної кислоти
Що спостерігаєте? Складіть рівняння реакції.
Визначте, чи є дана реакція окисно-відновною? Чому?
Лабораторний дослід "Прожарювання мідного дроту".
Виготовте із мідного дроту спіраль та прожарте її у полум'ї спиртівки
Що спостерігаєте? Складіть рівняння реакції.
Визначте, чи є дана реакція окисно-відновною? Чому?
Лабораторний дослід "Реакція нейтралізації".
Налийте у пробірку 2 мл розчину натрій гідроксиду. Додайте до нього краплю фенолфталеїну,. Що спостерігаєте? Чому?
Додайте 2 мл хлоридної кислоти.
Що спостерігаєте? Чому зникло забарвлення? Складіть рівняння реакції.
Визначте, чи є дана реакція окисно-відновною? Чому?


про публікацію авторської розробки
Додати розробку
