Урок "Загальна характеристика металічних елементів та металів, особливості будови атомів, металічний зв’язок. Фізичні властивості металів."
Тема. Загальна характеристика металічних елементів та металів, особливості будови атомів, металічний зв’язок. Фізичні властивості металів.
Мета:
Навчальна: Засвоєння учнями знань про особливості будови атомів металів, їх положення у періодичній системі, фізичні властивості. Показати загальні закономірності та істотні відмінності у властивостях металічних елементів, будові та властивостях їхніх сполук.
Розвиваюча: Розвивати і поглиблювати знання учнів про періодичну систему на прикладі металічних елементів; розвивати вміння аналізувати, порівнювати і співвставляти будову та фізичні властивості атомів металічних елементів.
Виховна: Заохочувати учнів до праці. Пробуджувати почуття відповідальності, бажання оберігати все оточуюче.
Тип уроку: засвоєння нових знань.
Форми роботи: лекція, бесіда, хімічний диктант, робота з текстом підручника, робота біля дошки, демонстраційний експеримент, доповіді учнів. (випереджувальне домашнє завдання), інтерактивна гра «мікрофон», розв’язок хімічного кросворду.
Обладнання: періодична система хімічних елементів Д.І. Мендєлєєва, ряд
активності металів, моделі металевих кристалічних ґраток, таблиці «Метали», « Металічні кристалічні ґратки», колекція металів та їх сплавів.
Хід уроку
І. Організаційний момент а) привітання б) фіксація відсутніх в) повідомлення теми уроку
ІІ. Актуалізація опорних знань
Хімічний диктант.
а) Напишіть символи хімічних елементів: Cr, Hg, Os, Sb, Pb, Co, Ni, Al, K, Na,
Fe, Be, Zn, Cu, Mg, Ba.
б) Визначити кількість електронів, протонів, нейтронів у атомів елементів:
І варіант ІІ варіант
Натрій, Аргентум Станум, Купрум
в) Напишіть електрону будову атомів елементів
І варіант ІІ варіант
Магній, Скандій Алюміній, Тітан
г) Що в будові цих атомів спільне та відмінне?
д) Чи вплине це на їх властивості?
ІІІ. Мотивація навчальної діяльності
Вчитель. Звернімось до періодичної системи Д.І. Мендєлєєва:
Скільки в ній хімічних елементів? (відповідь класу)
Більшу їх частину складають метали. Протягом всієї історії людства метали – є найбільш розповсюдженими матеріалами і вживаними в практичній діяльності.
Пригадайте, які метали є у вас вдома? (відповідь класу)
А чому вони такі вживані в нашому сьогоденні? (відповідь класу)
Сьогодні ми продовжимо наше знайомство с металами. Почнемо з будови металів та їх фізичних властивостей.
ІV. Вивчення нового матеріалу.
1. Положення металів у періодичній системі
Вчитель. Подивиться на таблицю періодичної системи елементів. Де саме у таблиці розміщені метали? (обговорення з учнями розміщення металів у ПСХЕ)
2. Будова атома металів
Робота біля дошки. Учні записують електронні конфігурації атомів елементів:
Учень 1: елемент №11 11Na 1S2 2S22P6 3S 13Р0
Учень 2: елемент №12 12Mg 1S2 2S22P6 3S2 3Р0
Учень 3: елемент №13). 13Al 1S2 2S22P6 3S2 3Р1
Вчитель. Знайдіть спільне та відмінне? (відповідь учнів)
Як ми бачимо, на зовнішньому електронному шарі металів невелика кількість електронів – від 1 до 3. Порівняно з радіусами атомів неметалів того ж періоду, радіуси атомів металів великі. Тому сила тяжіння електронів останнього енергетичного рівня до ядру атома в атомах металах менше, ніж у атомів неметалів. Саме тому Метали мають невелике значення електронегативності, легко віддають валентні електрони і виявляють відновні властивості.
Na – 1e- → Na+ (11Na+ 1S22S22P63So)
Mg – 2e- → Mg2+ (12Mg 1S22S22P63So)
3. Метали – прості речовини
Вчитель. Металічні елементи утворюють прості речовини – метали.
Назви металічних елементів і простих речовин – металів іноді не збігаються.
Робота біля дошки. Робота всього класу. Складання таблиці.
Доповніть невистачаючого:
|
Символ |
Назва елемента |
Проста речовина – метал
|
|
Fe |
Ферум |
Залізо |
|
Cu
|
?
|
? |
|
? |
Aргентум
|
? |
|
Hg
|
? |
?
|
|
? |
Плюмбум
|
Свинець
|
|
? |
Алюміній |
?
|
|
? |
Аурум |
?
|
4. Метали утворюють металічні кристалічні ґратки.
Вчитель. Металевий зв’язок обумовлений наявністю спільних електронів, катіонів металу та електронегативних атомів.
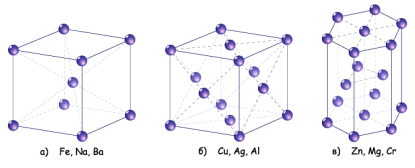
Атоми металічних eлементів перетворюються в позитивно заряджені іони – катіони. Валентні електрони забезпечують з’вязок між усіма йон-атомами кристалу метала. В металах існує особливий зв’язок – металічний. Знайдіть в підручнику означення металічного зв’язку
Робота з підручником.
- О.В. Григорович. Хімія (рівень стандарту): підручник для 11 класу Хімія 10 клас, Харків: Ранок, 2019.
- Хімія (рівень стандарту), підручник для 11 класу, Київ, ВЦ «Академія» П.П. Попель, Л.С. Крикля 2019р.
Учні разом з вчителем пояснюють сутність металічного зв’язку.
Висновок: Будова металів визначає їх властивості.
5. Фізичні властивості металів. Доповіді учнів. (випереджувальне домашнє завдання)
Учень 1: Металічний блиск. Метали мають характерну сріблясту (частіш за все) поверхню і відбивають промені світла. Срібло найкраще відбиває світло, тому має найбільший блиск (дзеркала, ялинкові іграшки).
Учень 2: Забарвлення: у більшості металів колір сріблясто – білий: Аl, Аg, Nі; або сріблясто – сірий: Fе, Рb. Два метали мають нетипове забарвлення: жовтий – Аu; і рожево – червоний Сu.
Відповідно до кольору метали поділяють на:
чорні: Fе, Мn, Сr;
кольорові: Zn, Аl, Рb, Сu, Са, Мg, Нg і т.д.
Учень 3: Висока електропровідність і теплопровідність. Метали добре проводять тепло і електричний струм. Це пояснюється наявністю вільних електронів, які в електричному полі набувають спрямованого руху.
Вчитель. Проведемо експеримент. Покладіть на долоню однієї руки невеличкий металічний предмет, а на другу – пластиковий. Чи відразу Ви з’ясуєте різницю? Поясніть чому ви відчули холод від металічного предмета? Чи різняться вони за вагою?
Здатність металів проводити електричний струм зумовлена наявністю спільних електронів, які здатні відносно вільно рухатися по шматку метала. Подивиться на таблицю. Зробіть висновок, який з металів має найбільшу електропровідність? Чому використовується для виготовлення електронних дротів інший метал?
|
Питома провідність приведена при темпе-ратурі +20°C |
Ag
625·105 |
Сu
581·105 |
Au
455·105 |
Al
370·105 |
227·105 |
Zn
169·105 |
Fe
100·105 |
Pt
93.5·105 |
|
|
|
|
||||||||
Учень 4: Пластичність, ковкість. Пластичність – здатність необоротно деформуватися під дією механічних навантажень. Пластичність обумовлена будовою металічної кристалічної ґратки. На практиці пластичність металів проявляється у тому, що під ударами молота вони не подрібнюються на шматки, а розплющуються, бо метали ковкі. Серед металів перше місце щодо ковкості займає золото. Його можна прокатувати в найтонші най прозорі листи і витягувати в найтонший дріт (1г – 1м2 – 10м). Дуже крихким металом є Стибій. Його можна розтерти.
Учень 5: Магнітні властивості. Залежно від магнітних властивостей метали поділяють на парамагнітні, які втягуються в магнітне поле, і діамагнітні, які виштовхуються з магнітного поля. Парамагнетизм обумовлений наявністю в атомах неспарених електронів, діамагнетизм – їх відсутністю. Високі парамагнітні властивості мають d-елементи, в атомах яких d-підрівень частково заповнений електронами: V, Ti, Ni, Mo. Метали р-родини, а також d-елементи з повністю заповненим d-підрівенєь мають діамагнітні властивості.
Учень 6: Температура плавлення. Твердість. Густина. Метали поділяються на легкоплавкі та тугоплавкі, тверді та м’які, легкі та важкі. Розглянемо таблицю:
|
Температура плавлення |
|
|
Легкоплавкі Тпл < 1000° С Метали І, ІІ групи головної підгрупи, Al, Pb, Sn, Zn та ін. |
Тугоплавкі Тпл > 1000° С Cu, Fe, Cr, Ti, Mo, W та ін. |
|
Твердість |
|
|
М’які (ріжуться ножем) Лужні метали, свинець |
Тверді Хром, вольфрам |
|
Густина |
|
|
Легкі ρ < 5 г/см3 Li, Na, Mg, Al, Pb |
Важкі ρ> 5 г/см3 Zn, Fe, Au, Os |
V. Закріплення і узагальнення знань.
1. Інтерактивна гра «Мікрофон»
- Зв’язок між атомами металів називається (Металевим)
- Які частинки лежать у вузлах ґратки? (Катіони металу)
- Скільки електронів містять метали га зовнішньому енергетичному рівні? (1-3)
- Який метал має найбільший блиск? (Ag)
- Метали за температурою плавлення поділяються на (Легко- та тугоплавкі)
- Який з металів зустрічається в самородному вигляді? (Аu)
- Найбільш електропровідні метали (Срібло, мідь, алюміній)
- До м’яких металів відносяться (Лужні метали)
- Корисні копалини, з яких отримують метали, називаються (Рудами)
- Який метал зумовлює міцність кісток? (Кальцій)
- Руйнація металів та їх сплавів під дією на них оточуючого середовища називається (Корозія)
- Назвіть порівняння, де вживаються метали.
(Золоті руки, залізна воля , срібна сивина…)
2. Хімічний кросворд (назвіть ключове слово)
Запитання до кросворду:
1. Який метал має найбільшу пластичність? (Au)
2. Природна тверда кристалічна речовина (Мінерал)
3. Найбільш легкий метал? (Lі)
4. Твердий розчин одного металу в іншому (Сплав)
5. Який елемент називають крилатим? (Алюміній)
6. Метал, який через його тугоплавкі властивості використовують в електричній лампочці? (W)
7. Явище відбивання світла з поверхні металу? (Фотоефект)
8. Метал, що за електропровідністю стоїть на першому місці (Ag)
9. Який метал найбільш легкоплавкий? (Hg)
10. Які частинки лежать у вузлах металічної ґратки? (Катіони)
11. Промислова галузь, основою якої є метали (Машинобудування)
12. Властивість металів, що зумовлена здатністю відбивати світлові промені (Блиск)
13. Метал, найбільш розповсюджений в земній корі (Залізо)
Відповіді:
|
|
1. |
а |
у |
р |
у |
м |
|
|
|
|
|
|
||||
|
2. |
м |
і |
н |
е |
р |
а |
л |
|
|
|
|
|
||||
|
|
3. |
л |
і |
т |
і |
й |
|
|
|
|
|
|
||||
|
4. |
с |
п |
л |
а |
в |
|||||||||||
|
|
5. |
а |
л |
ю |
м |
і |
н |
і |
й |
|||||||
|
6. |
в |
о |
л |
ь |
ф |
р |
а |
м |
|
|||||||
|
7. |
ф |
о |
т |
о |
е |
ф |
е |
к |
т |
|
||||||
|
8. |
с |
р |
і |
б |
л |
о |
|
|
|
|
|
|
||||
|
9. |
р |
т |
у |
т |
ь |
|||||||||||
|
|
10. |
к |
а |
т |
і |
о |
н |
и |
|
|
|
|
|
|
||
|
11. |
м |
а |
ш |
и |
н |
о |
б |
у |
д |
у |
в |
а |
н |
н |
я |
|
|
|
12. |
б |
л |
и |
с |
к |
|
|
|
|
|
|
|
|||
|
13. |
з |
а |
л |
і |
з |
о |
|
|
|
|
||||||
V. Домашнє завдання
І рівень Хімія 11 клас О.В. Григорович 2019 р, стор. 162,
№443 (які характерні особливості металічних елементів)
№ 445 (схарактеризуйте поширеність хімічних елементів у природі)
№ 446 (схарактеризуйте загальні фізичні властивості металів. Чим вони зумовлені?)
ІІ рівень Порівняйте електронну конфігурацію Натрію і Алюмінію, Магнію і Кальцію. Що в них є спільного та відмінного?
ІІІ рівень - Як змінюються металічні і неметалічні властивості хімічних елементів та їх оксидів у періодах та групах зі зростанням протонного числа?
ІV рівень Задача: Яку масу солі можна отримати, якщо у реакцію вступили 100 г 10% розчину натрій гідроксиду і 200 г 10% розчину сульфатної кислоти?
Список літератури:
- О.В. Григорович. Хімія: підручник для 11 класу (рівень стандарту) Видавництво: Харків: Ранок, 2019.
- Попель П.П., Крикля Л.С. Хімія : підручн. для 11 кл. загальноосвіт. навч. закл. (рівень стандарту). – К. : ВЦ «Академія», 2019.
- Попель П.П. Хімія учителю 9-10 кл. : навч.-метод. посіб. – К. : ВЦ «Академія», 2010.
- Хімія: довідник для абітурієнтів та учнів загальноосвітніх навчальних закладів. М.В Гриньова, Н.І Шиян, Ю.В. Самусенко (та ін..). – К.:Літера ЛТД, 2013.

про публікацію авторської розробки
Додати розробку
