Урок "загальна характеристика неметалів"
Про матеріал
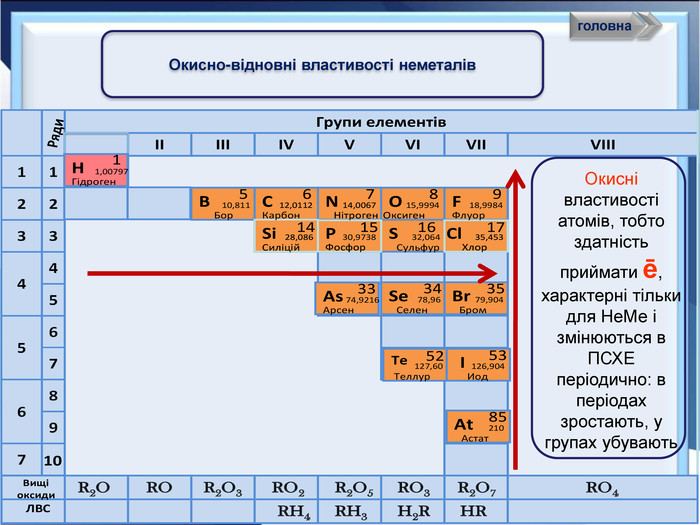
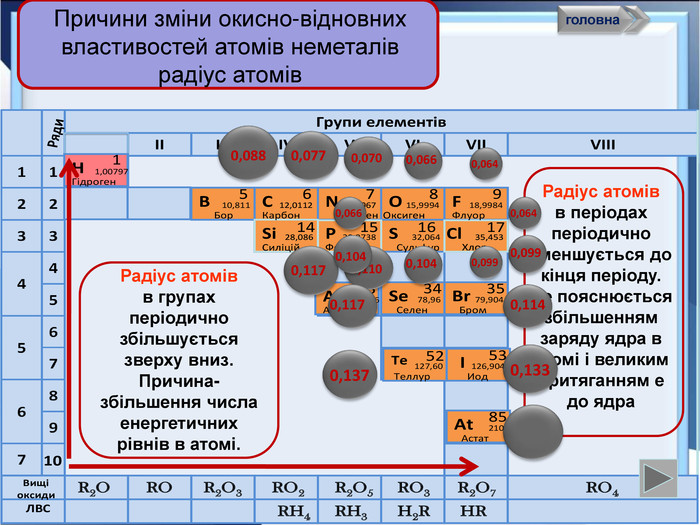
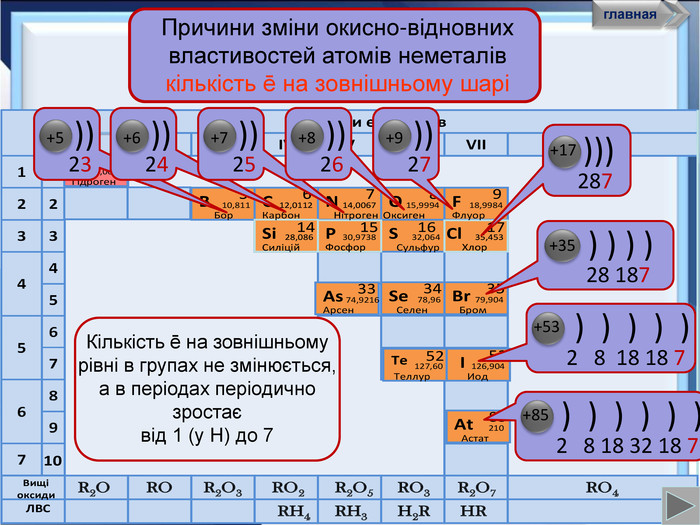
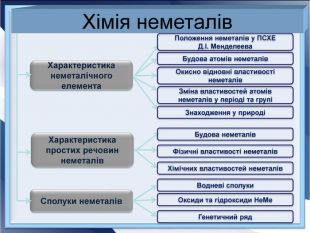
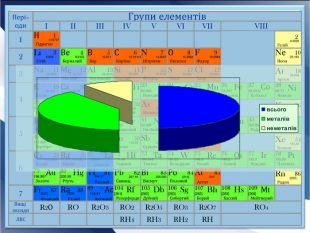
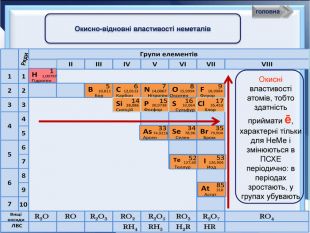
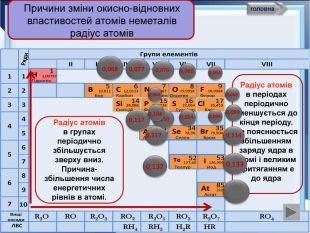
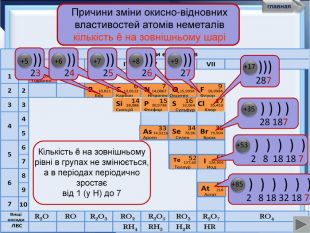
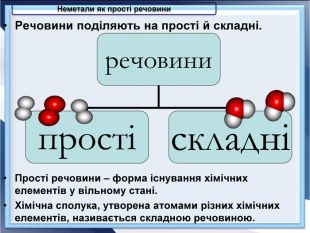
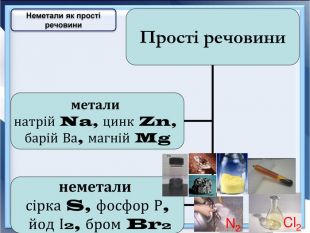
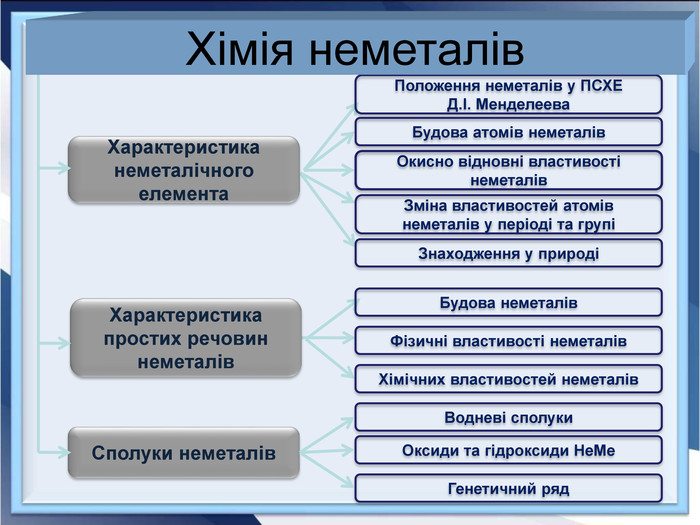
- Розробка уроку з хімії на слайдах. 10 клас.Загальна характеристика неметалічних елементів. Характеристика неметалічного елемента: положення неметалів у ПСХЕ Д.І,Менделеєва; будова атома елемента; окисно-відновні властивості неметалів; зміна властивостей атомів неметалів у періоді та групі; знаходження у природі. Характеристика простих речовин неметалів: будова неметалів; фізичні властивості неметалів; хімічні властивості неметалів. Сполуки неметалів: водневі сполуки; оксиди та гідроксиди неметалів; генетичний ряд.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дуже сподобалась презентація. Дякую за ідеї.
-
Дякую, дуже вдала розробка1
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




![7 Rа Радий 88 [226] Fr Франций 87 [223] Ас 89 138,81 Актиний ** Борий 107 [262] Bh Сиборгий 106 [263] Sg Резерфордий 104 [261] Rf Дубний 105 [262] Db Хассий 108 [265] Hs Мейтнерий 109 [266] Мt RO4 RH R2O7 RO3 RH2 R2O5 RH3 RO2 RH4 R2O3 RO R2О Вищі оксиди ЛВС Кr Криптон 36 83,80 Xe Ксенон 54 131,30 Групи елементів VIII Не Гелій 2 4.0026 Ar Аргон 18 39,948 Nе Неон 10 20,183 Никель 28 58,71 Ni Палладий 46 106,4 Pd Платина 78 195,09 Рt Rn Радон 86 [222] 1 2 4 5 6 3 I II III IV V VI VII Na Натрій 11 22,9898 Мg Магний 12 24,312 Al Алюминий 13 26,9815 Cl Хлор 17 35,453 Si Силіцій 14 28,086 P Фосфор 15 30,9738 S Сера 17 32,064 К Калій 19 39,102 Сa Кальций 20 40,08 Н Гідроген 1 1,00797 Li Літій 3 6.939 Ве Бериллий 4 9,0122 F Флуор 9 18,9984 О Оксиген 8 15,9994 N Нітроген 7 14,0067 С Карбон 6 12,01115 В Бор 5 10,811 Скандий Sc 21 44,956 Титан Ti 22 47,90 Ванадий V 23 50,942 Хром Cr 24 51,996 Марганец 25 44,956 Мn Железо 26 55,847 Fe Кобальт 27 58,9332 Со Цинк 30 65,37 Zn Медь 29 63,546 Сu Ge Германий 32 72,59 Ga Галлий 31 26,9815 Br Бром 35 79,904 Se Селен 34 78,96 As Мышьяк 33 74,9216 Sr Стронций 38 87,62 Rb Рубидий 37 85,47 Y 39 88,905 Иттрий Рутений 44 101,07 Ru Родий 45 102,905 Rh Технеций 43 [99] Тс Молибден 42 95,94 Мо Ниобий 41 92,906 Nb Цирконий 40 91,22 Zr Кадмий 48 112,40 Сd Серебро 47 107,868 Ag In Индий 49 114,82 Sb Сурьма 51 121,75 Sn Олово 50 118,69 Тe Теллур 52 78,96 I 53 126,9044 Йод Ва Барий 56 137.34 Cs Цезий 55 132,905 La 57 138,81 Лантан * Гафний 72 178.49 Hf Тантал 73 180,948 Та Вольфрам 74 183.85 W Рений 75 186,2 Re Осмий 76 190,2 Оs Иридий 77 192,2 Ir Ртуть 80 200,59 Hg Золото 79 196,967 Аu ТI Таллий 81 204,37 Ро Полоний 84 [210] Вi Висмут 83 208,980 Pb Свинец 82 207,19 At 85 210 Астат Пері– оди 7 Rа Радий 88 [226] Fr Франций 87 [223] Ас 89 138,81 Актиний ** Борий 107 [262] Bh Сиборгий 106 [263] Sg Резерфордий 104 [261] Rf Дубний 105 [262] Db Хассий 108 [265] Hs Мейтнерий 109 [266] Мt RO4 RH R2O7 RO3 RH2 R2O5 RH3 RO2 RH4 R2O3 RO R2О Вищі оксиди ЛВС Кr Криптон 36 83,80 Xe Ксенон 54 131,30 Групи елементів VIII Не Гелій 2 4.0026 Ar Аргон 18 39,948 Nе Неон 10 20,183 Никель 28 58,71 Ni Палладий 46 106,4 Pd Платина 78 195,09 Рt Rn Радон 86 [222] 1 2 4 5 6 3 I II III IV V VI VII Na Натрій 11 22,9898 Мg Магний 12 24,312 Al Алюминий 13 26,9815 Cl Хлор 17 35,453 Si Силіцій 14 28,086 P Фосфор 15 30,9738 S Сера 17 32,064 К Калій 19 39,102 Сa Кальций 20 40,08 Н Гідроген 1 1,00797 Li Літій 3 6.939 Ве Бериллий 4 9,0122 F Флуор 9 18,9984 О Оксиген 8 15,9994 N Нітроген 7 14,0067 С Карбон 6 12,01115 В Бор 5 10,811 Скандий Sc 21 44,956 Титан Ti 22 47,90 Ванадий V 23 50,942 Хром Cr 24 51,996 Марганец 25 44,956 Мn Железо 26 55,847 Fe Кобальт 27 58,9332 Со Цинк 30 65,37 Zn Медь 29 63,546 Сu Ge Германий 32 72,59 Ga Галлий 31 26,9815 Br Бром 35 79,904 Se Селен 34 78,96 As Мышьяк 33 74,9216 Sr Стронций 38 87,62 Rb Рубидий 37 85,47 Y 39 88,905 Иттрий Рутений 44 101,07 Ru Родий 45 102,905 Rh Технеций 43 [99] Тс Молибден 42 95,94 Мо Ниобий 41 92,906 Nb Цирконий 40 91,22 Zr Кадмий 48 112,40 Сd Серебро 47 107,868 Ag In Индий 49 114,82 Sb Сурьма 51 121,75 Sn Олово 50 118,69 Тe Теллур 52 78,96 I 53 126,9044 Йод Ва Барий 56 137.34 Cs Цезий 55 132,905 La 57 138,81 Лантан * Гафний 72 178.49 Hf Тантал 73 180,948 Та Вольфрам 74 183.85 W Рений 75 186,2 Re Осмий 76 190,2 Оs Иридий 77 192,2 Ir Ртуть 80 200,59 Hg Золото 79 196,967 Аu ТI Таллий 81 204,37 Ро Полоний 84 [210] Вi Висмут 83 208,980 Pb Свинец 82 207,19 At 85 210 Астат Пері– оди](/uploads/files/76879/49313/52219_images/5.jpg)
![Положення в ПСХЕ Д.І. Менделеева головна Периоды II VI V III IV VIII Групи елементів VII Si 14 28,086 Силіцій 30,9738 Р 15 Фосфор S 32,064 Сульфур 16 Cl 17 35,453 Хлор I 10 Ряди 18 Ar Аргон 39,948 He 4,0026 Гелій 2 (H) N 15,9994 18,9984 С 12,0112 6 Бор 10,811 Карбон 5 В F 14,0067 Нітроген 7 10 8 O Оксиген Неон Ne 20,163 9 Флуор Н 1,00797 Гідроген 1 Kr 83,80 Криптон 36 Xe 131,30 Ксенон 54 Rn [222] Радон 86 Br 79,904 Бром 35 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Тe 127,60 Теллур 52 As 74,9216 Арсен 33 R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Вищі оксиди ЛВС У ПСХЕ Д.І. Менделєєва межа, яка відокремлює металічні від неметалічних елементів, проходить по наступним неметалам - елементам головних підгруп: B; Si;As; Te; At. Положення в ПСХЕ Д.І. Менделеева головна Периоды II VI V III IV VIII Групи елементів VII Si 14 28,086 Силіцій 30,9738 Р 15 Фосфор S 32,064 Сульфур 16 Cl 17 35,453 Хлор I 10 Ряди 18 Ar Аргон 39,948 He 4,0026 Гелій 2 (H) N 15,9994 18,9984 С 12,0112 6 Бор 10,811 Карбон 5 В F 14,0067 Нітроген 7 10 8 O Оксиген Неон Ne 20,163 9 Флуор Н 1,00797 Гідроген 1 Kr 83,80 Криптон 36 Xe 131,30 Ксенон 54 Rn [222] Радон 86 Br 79,904 Бром 35 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Тe 127,60 Теллур 52 As 74,9216 Арсен 33 R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Вищі оксиди ЛВС У ПСХЕ Д.І. Менделєєва межа, яка відокремлює металічні від неметалічних елементів, проходить по наступним неметалам - елементам головних підгруп: B; Si;As; Te; At.](/uploads/files/76879/49313/52219_images/6.jpg)