Урок "Закон Авогадро. Молярний об'єм газів. Розв'язування розрахункових задач"
Тема : «Закон Авогадро. Молярний об’єм газів. Розв’язування розрахункових задач»
Мета: систематизувати знання учнів про поняття кількості речовини, числа Авогадро, молярну масу, на їх основі сформувати уявлення про молярний об’єм газоподібних речовин; розкрити сутність закону Авогадро і його практичного застосування; формувати здатність до адекватного самоконтролю й самооцінки; розвивати вміння логічно мислити, висувати гіпотези, робити аргументовані висновки; працювати в групах.
Тип уроку: урок застосування знань, умінь і навичок.
Форми роботи: групова, фронтальна.
Характеристика навчальної діяльності: пояснювально-ілюстративний, репродуктивний. Учні працюють у складі малих гетерогенних груп
Хід уроку
І. Організаційний момент
Добрий день, діти! Я рада вас вітати у цьому класі. Напередодні мені надійшов дуже цікавий лист.
ІІ. Мотивація навчальної діяльності
Це дуже незвичайний лист! Давайте разом ознайомимося з його змістом.
«Шановні жителі планети Земля! Людство багато років намагається пізнати космічні простори, заглянути в глибини всесвіту. Ми запрошуємо вас у міжгалактичну подорож. На вас чекають пригоди, незабутні враження і багато цікавого! Тож не гайте часу, скоріше вирушайте, бо найдорожчий скарб для людини – це знання. Ми залишаєм вам карту, яка і буде вказівкою до вашого маршруту. Чим активніше ви працюватимете, тим вищий бал отримаєте на уроці. Бажаємо успіхів!»
Ваші космічні сусіди
А й справді, давайте зараз вирушимо в подорож. Я запрошую здійснити мандрівку у галактику «Хімічний шлях». А подорожувати ми будемо на космічному кораблі «Атом». В кожній зоряній системі будуть завдання, які обов’язково потрібно виконати ,щоб потрапити до наступної зоряної системи. Ваші зошити перетворюються на бортові журнали.
ІІІ. Актуалізація опорних знань.
Поглянемо на карту. Отже перша зоряна система «Теоретичні знання». (Опитування класу)
- Яку інформацію можна дізнатися з хімічної формули?
- Яка величина називається кількістю речовини?
- Дайте визначення поняття «моль».
- Яке число називають числом Авогадро, що воно показує?
- Продовжте вислів « Молярна маса – це…». За якою формулою її визначають?
- З чим співпадає числове значення молярної маси?
Отже першу зоряну систему ми розглянули. Летимо до наступної – зоряна система «Формули». А тут потрібно виконати завдання.(Кожна група отримує картку із завданням)
1)Встановіть відповідність між формулою і хімічним поняттям:
- Молярна маса а) N=NA•v
- Кількість речовини б) m = ν • M;
-
Маса в)
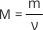
4.Число структурних частинок г) ν = N/NA;
д) ![]()
2) Розвяжіть задачу:
Яка маса водню Н2 кількістю речовини 15 моль? (Відповідь: 30 г)
ІV. Вивчення нового матеріалу
Наша подорож вимагає розумових зусиль, знань, навичок і вміння рахувати. Тож відкриваємо свої бортові журнали і записуємо число і тему уроку «Закон Авогадро. Молярний об’єм газів. Розв’язування розрахункових задач».
Ну, ось ми і підлітаємо до найцікавішої зоряної системи «Задачі». О! Так нас тут чекають наші космічні сусіди. У жителів цієї зоряної системи є одна умова. Вони дозволять нам приземлитися на першій планеті, якщо ми розв’яжемо задачу І типу.
І тип. Обчислення кількості речовини за відомим об’ємом.
Задача 1. Яка кількість речовини карбон(IV) оксиду об’ємом 67,2 л?
Так, здається ми таких задач ще не розв’язували. Що ж нам робити? Будемо розв’язувати, а я вам допоможу. Та спершу слід розглянути саме поняття молярний об’єм.
Досліджуючи гази, італійський учений А. Авогадро у 1811 р. висловив думку, яка пізніше підтвердилася численними дослідами і була сформульована у вигляді закону:
В однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул (атомів).
Нам відомо, що 1 моль будь-якої речовини містить 6,02 • 1023 структурних частинок (атомів, молекул, йонів). Рідкі й тверді речовини кількістю 1 моль займають порівняно незначні й, до того ж, різні об’єми і мають різні маси.
У твердих і рідких речовин частинки зближені до стикання. Об’єм рідин і твердих речовин через це залежить головним чином від розмірів самих частинок. А в газах відстані між молекулами великі і значно більші від самих молекул (у 15-20 разів). Об’єм газу визначається головним чином відстанями між молекулами, а ці відстані за однакових умов (температури 0ºС і тиску 760 мм рт. ст.) в усіх газах приблизно однакові. Тому справедливим є і зворотне твердження, відоме як наслідок із закону Авогадро:
Однакове число молекул (атомів) будь-яких газів за однакових умов займають однаковий об’єм
1 моль будь-якого газу за н. у. займає об’єм 22,4 л. Цей об’єм називають молярним об’ємом. Молярний об’єм чисельно дорівнює об’єму 1 моль речовини і позначається Vm («ве-ем»):
Vm = 22,4 л/моль, м3/моль.
Молярний об’єм газу (Vm) визначається за відношенням об’єму (V) порції даного газу до кількості речовини (n) в цій порції:
Vm = V / υ,
де V – об’єм газу за н. у., (л, м3); ν – кількість речовини газу, (моль).
Молярний об’єм газу – це величина, що дорівнює відношенню молярної маси газу до його густини:
Vm = M / ρ,
де M – молярна маса газу; ρ – густина газу.
Тепер розв’яжемо задачу.
|
Дано: V (СO2) = 67,2 л |
υ = V/Vm |
Розв’язання:
1. Визначаємо кількість речовини СО2: |
|
υ (СO2) – ? |
Відповідь: υ (СO2) = 3 моль.
А тепер розв’яжіть задачі, які ви бачите на слайді, у складі груп.(Додаток 1)
Що ж вирушаємо до другої планети.
Жителі цієї планети просять нас про допомогу. У них закінчуються запаси кисню. Їм необхідно порахувати
ІІ тип. Обчислення об’єму речовини за відомою масою .
Задача 2. Який об’єм займає кисень масою 3,2 г?
|
дано: m(O2) = 3.2 г |
V = υ · Vm |
Розв’язання:
1. Визначаємо кількість речовини О2:
2. Знаходимо об’єм О2: |
|
V(O2) – ? |
Відповідь: V(O2) = 2,24 л.
Виконайте завдання у групах. .(Додаток 2)
А ось і третя планета. Тут щось трапилось. Зник їхній король. Нам потрібно допомогти жителям цієї планети. То ж не гаємо часу і приступаємо до задач третього типу.
ІІІ тип. Обчислення маси речовини за відомим об’ємом.
Задача 3. Яку масу займає кисень обємом 44,8 л?
|
дано: V(O2) = 44,8 л |
m = υ · M |
Розв’язання:
1. Визначаємо кількість речовини О2:
2. Знаходимо масу О2: |
|
m(O2) – ? |
Відповідь: m (O2) =64(г)
А тепер завдання в групах. .(Додаток 3)
Що ж нам час повертатися додому. Але що це? Наш зореліт захопили космічні пірати. Вони не покинуть наш корабель поки ми не виконаємо їхні умови. Ось вони передали свій ультиматум. Подивимося що це. Це задачі, які учні повинні виконати самостійно. Якщо ви хочете повернутися додому, то повинні розв’язати кожен свою задачу.(Додаток 4)
Ось так непомітно наша подорож добігла кінця. Сподіваюся вона була для вас цікавою і пізнавальною. А як би ви оцінили свої знання? Заповніть будь-ласка картку самооцінювання.
V. Рефлексія
Учні заповнюють картки самооцінки. (Додаток 5)
VI. Підсумки уроку
Аналіз роботи учнів, виставлення оцінок.
Додаток 1
Задачі І типу
- Обчисліть кількість речовини газу, який займає об’єм 44,8 л.
- Обчисліть кількість речовини газу, який займає об’єм 89,6 л;
- Обчисліть кількість речовини газу, який займає об’єм 6,72 л?
- Обчисліть кількість речовини газу, який займає об’єм 2,24 л?
Додаток 2
Задачі ІІ типу
- Який об’єм за нормальних умов займає О2 масою 8 г;
- Який об’єм за нормальних умов займає СО2масою 11 г;
- Який об’єм за нормальних умов займає N2 масою 7 г;
- Який об’єм за нормальних умов займає Н2 масою 12 г;
Додаток 3
Задачі ІІІ типу
- Обчисліть масу СО2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу О2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу Н2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу N2, який за нормальних умов займає обєм 24 л.
Додаток 4
Середній рівень (розв’язати за зразком)
І Варіант
Обчислити об’єм, що займе при нормальних умовах водень кількістю речовини 1,5 моль.
ІІ Варіант
Обчислити, якій кількості речовини відповідатиме 4,48 л вуглекислого газу.
Достатній рівень
І Варіант
П’ятачок на день народження друга вирішив надути повітряні кульки. Допоможіть йому обчисліть об’єм Гелію, кількістю речовини 3,5 моль.
ІІ Варіант
Для оборотного зілля Гаррі Потерру потрібно взяти 7 моль сірководню H2S. Допоможіть обчислити, які необхідні об’єм та маса газу?
Високий рівень
І Варіант
Обчислити кількість молекул та атомів, що міститься в 89,6 л кисню при нормальних умовах.
ІІ Варіант
Допоможіть Мауглі порахувати, яку кількість речовини та масу кисню виробляють дерева в джунглях, якщо відомо, що загальний об’єм O2 складає 5600 літрів.
Додаток 5
Картка самооцінювання
|
Вивчений матеріал |
Бали |
|
Я знаю, що таке |
|
|
|
|
|
|
|
|
Я вмію |
|
|
|
|
|
|
|
|
|
|
|
|
0 – не знаю, 1 – потребує вдосконалення, 2 – задовільно, 3 – добре, 4 - чудово |
|
-
-
Дякую


про публікацію авторської розробки
Додати розробку
