Узагальнення й систематизація знань





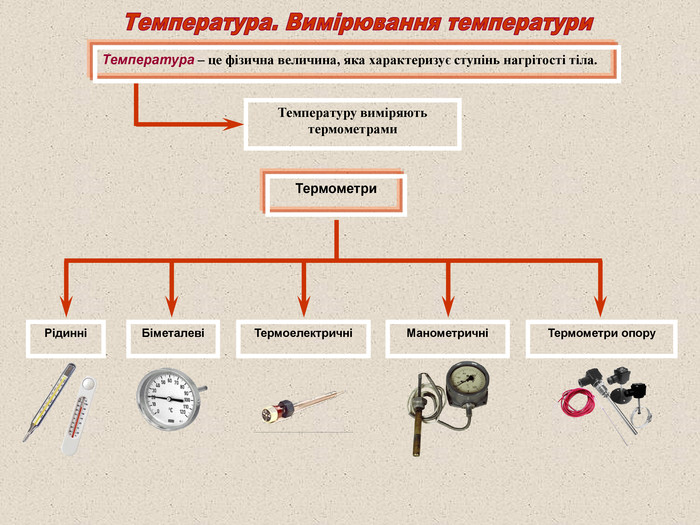




Тема1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ОСНОВНИЙ ОБСЯГ ЗНАНЬ І ВМІНЬ. Початковий рівень: мати поняття про тепловий рух частинок, дифузію, броунівський рух; мати уявлення про деякі фізичні характеристики молекул (маса, розміри, швидкість руху); знати буквені позначення й одиниці вимірювання маси (відносної атомної, маси молекули, молярної маси), кількості речовини, тиску, температури, об'єму, числа Авогадро, сталої Больцмана, універсальної газової сталої; вміти вимірювати температуру; знати основні положення МКТ. Середній рівень: знати зміст понять; ідеальний газ, температура, кількість речовини, ізопроцес; знати закони і формули: основне рівняння MET газів; рівняння Менделєєва-Клапейрона; зв'язок між параметрами стану газу в ізопроцесах; співвідношення між масою речовини і кількістю молекул; вміти розпізнавати за графіком вид ізопроцесу; вміти визначати експериментально параметри стану газу. Достатній рівень: вміти використовувати положення МКТ для пояснення молекулярних явищ, температури і тиску газу; знати залежність тиску газу від концентрації молекул і температури; знати фізичний зміст: сталої Больцмана, універсальної газової сталої, сталої Авогадро; вміти читати графіки ізопроцесів у різних системах координат; знати зміст поняття абсолютна шкала температур; знати методи визначення швидкості руху молекул, температури; - вміти виводити рівняння ізопроцесів з рівняння стану газу. Високий рівень: вміти виводити основне рівняння МКТ газів, рівняння стану газу; вміти будувати графіки ізопроцесів у різних системах координат; вміти доводити, що температура є енергетичною характеристикою стану речовини, мірою середньої кінетичної енергії молекул газу.
М.В. Ломоносов (1711 - 1765) Перші здогадки про внутрішню будову речовини висловили старогрецькі вчені Левкіп, Демокріт, Епікур, Лукрецій Кар. У XVIII столітті палким прибічником молеклярно-кінетичної теорії був М.В. Ломоносов, який не лише визнавав справедливість атомної будови оточуючих тіл, але й використовував вчення про атоми для пояснення різних властивостей і перетворень речовини. Левкіп Демокріт Епікур Лукрецій Кар
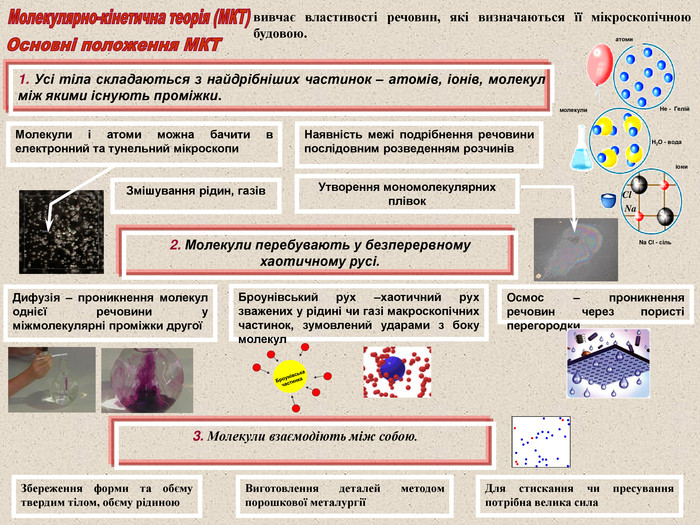
Молекули і атоми можна бачити в електронний та тунельний мікроскопи Наявність межі подрібнення речовини послідовним розведенням розчинів Утворення мономолекулярних плівок Змішування рідин, газів 2. Молекули перебувають у безперервному хаотичному русі. Осмос – проникнення речовин через пористі перегородки Броунівський рух –хаотичний рух зважених у рідині чи газі макроскопічних частинок, зумовлений ударами з боку молекул Дифузія – проникнення молекул однієї речовини у міжмолекулярні проміжки другої вивчає властивості речовин, які визначаються її мікроскопічною будовою. 3. Молекули взаємодіють між собою. Збереження форми та обєму твердим тілом, обєму рідиною Виготовлення деталей методом порошкової металургії Для стискання чи пресування потрібна велика сила Броунівська частинка 1. Усі тіла складаються з найдрібніших частинок – атомів, іонів, молекул між якими існують проміжки. атоми молекули H2O - вода Na Cl - сіль іони Не - Гелій Cl Na
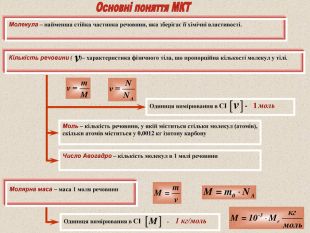
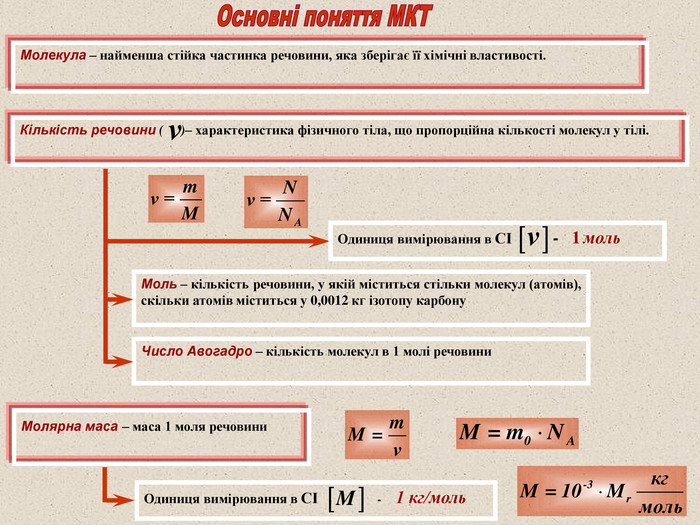
Моль – кількість речовини, у якій міститься стільки молекул (атомів), скільки атомів міститься у 0,0012 кг ізотопу карбону Число Авогадро – кількість молекул в 1 молі речовини Молекула – найменша стійка частинка речовини, яка зберігає її хімічні властивості. Кількість речовини ( )– характеристика фізичного тіла, що пропорційна кількості молекул у тілі. Молярна маса – маса 1 моля речовини Одиниця вимірювання в СІ - 1 моль Одиниця вимірювання в СІ - 1 кг/моль
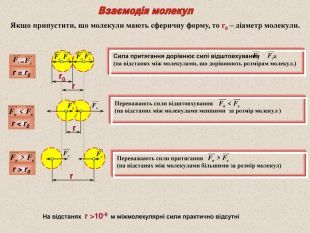
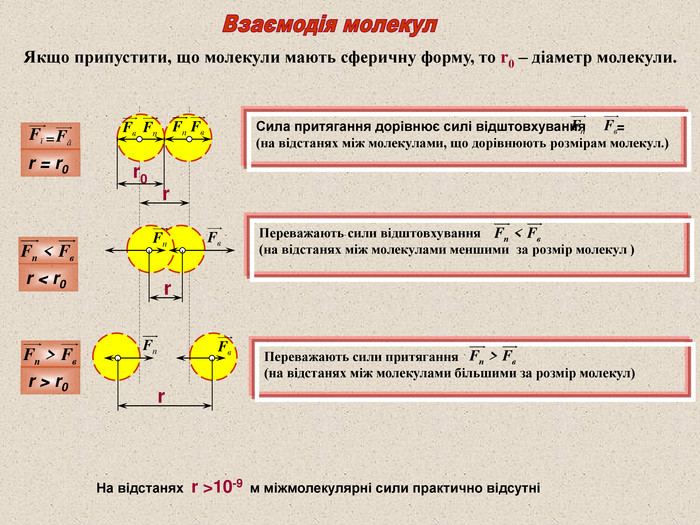
Якщо припустити, що молекули мають сферичну форму, то r0 – діаметр молекули. Сила притягання дорівнює силі відштовхування = (на відстанях між молекулами, що дорівнюють розмірам молекул.) Переважають сили відштовхування (на відстанях між молекулами меншими за розмір молекул ) Переважають сили притягання (на відстанях між молекулами більшими за розмір молекул) = На відстанях r >10-9 м міжмолекулярні сили практично відсутні r r r = r0 r < r0 r > r0 r0 r
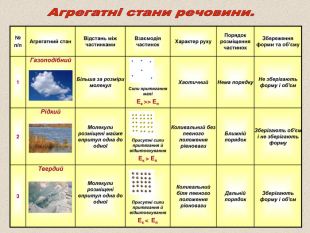
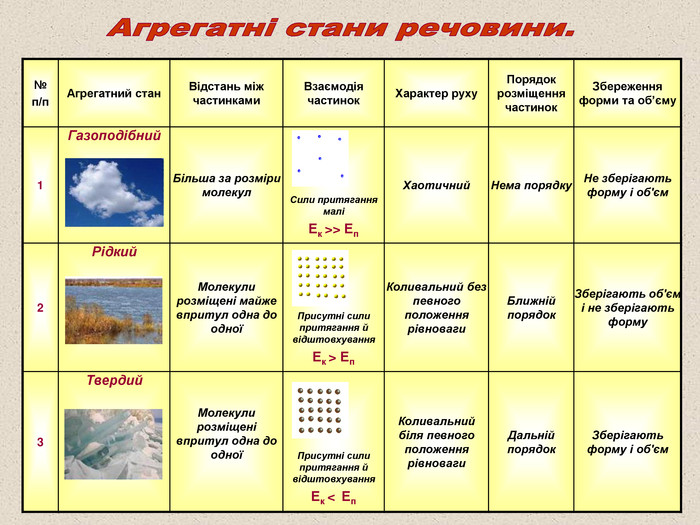
№ п/п Агрегатний стан Відстань між частинками Взаємодія частинок Характер руху Порядок розміщення частинок Збереження форми та об’єму 1 Газоподібний Більша за розміри молекул Сили притягання малі Ек >> Еп Хаотичний Нема порядку Не зберігають форму і об'єм 2 Рідкий Молекули розміщені майже впритул одна до одної Присутні сили притягання й відштовхування Ек > Еп Коливальний без певного положення рівноваги Ближній порядок Зберігають об'єм і не зберігають форму 3 Твердий Молекули розміщені впритул одна до одної Присутні сили притягання й відштовхування Ек < Еп Коливальний біля певного положення рівноваги Дальній порядок Зберігають форму і об'єм
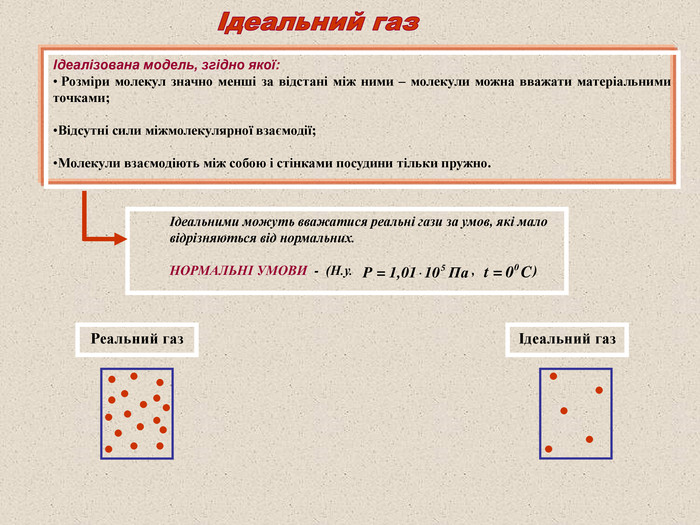
Ідеалізована модель, згідно якої: Розміри молекул значно менші за відстані між ними – молекули можна вважати матеріальними точками; Відсутні сили міжмолекулярної взаємодії; Молекули взаємодіють між собою і стінками посудини тільки пружно. Ідеальними можуть вважатися реальні гази за умов, які мало відрізняються від нормальних. НОРМАЛЬНІ УМОВИ - (Н.у. , ) Реальний газ Ідеальний газ
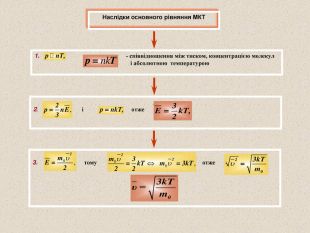
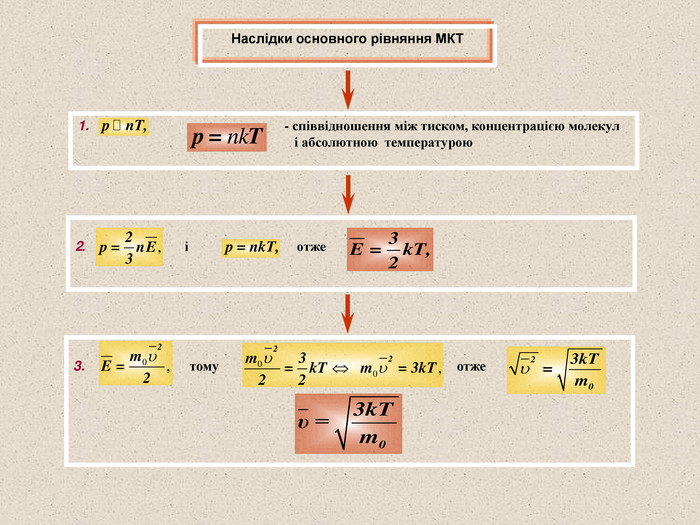
Виводиться за допомогою законів механіки (молекули розглядаються, як матеріальні точки, що діють на стінки посудини). – середнє значення кінетичної енергії поступального руху однієї молекули ідеального газу; - густина газу. Дозволяє знайти тиск газу ( Р ), якщо відома маса молекули газу ( m0 ), середнє значення квадрату швидкості молекул ( ) і концентрація молекул ( n ). Концентрація молекул – кількість молекул в одиниці об’єму Маса молекули – Густина газу – М – молярна маса; V – об’єм газу; m – маса газу; N – кількість молекул; NA – стала Авогадро
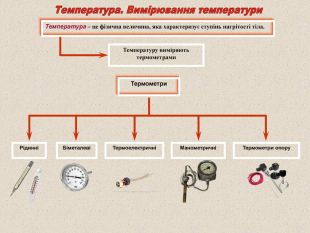
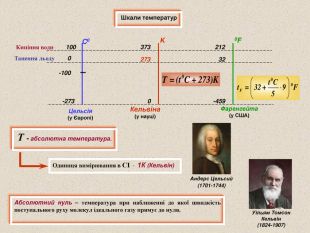
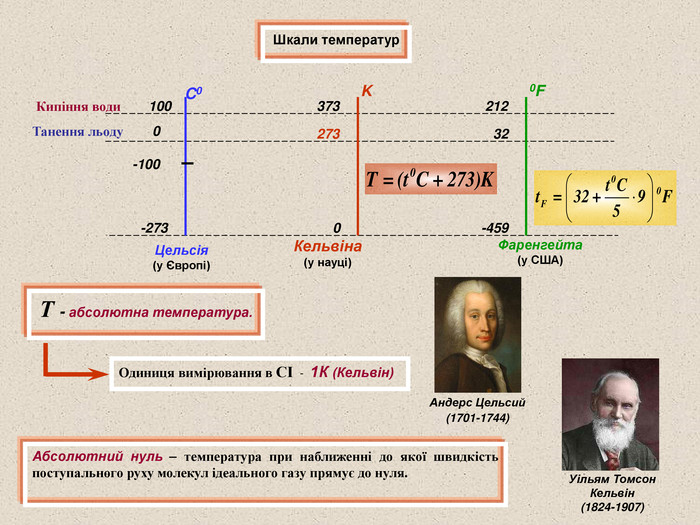
Шкали температур Абсолютний нуль – температура при наближенні до якої швидкість поступального руху молекул ідеального газу прямує до нуля. Т - абсолютна температура. Одиниця вимірювання в СІ - 1К (Кельвін) C0 K 0F Кипіння води Танення льоду 100 -100 373 273 212 32 -273 0 -459 Цельсія (у Європі) Кельвіна (у науці) Фаренгейта (у США) 0 Уільям Томсон Кельвін (1824-1907) Андерс Цельсий (1701-1744)
Для будь-яких газів, що знаходяться у стані теплової рівноваги:(експериментальний факт) Середня кінетична енергія молекул будь-яких газів, що знаходяться у стані теплової рівноваги, однакова Стала Больцмана чисельно дорівнює зміні середньої кінетичної енергії молекули ідеального газу при зміні температури газу на 1 К Температура – величина, пропорційна середній кінетичній енергії хаотичного руху молекул. Середня кінетична енергія хаотичного руху молекул пропорційна температурі тіла: - стала Больцмана Людвиг Больцман (1844 - 1906)
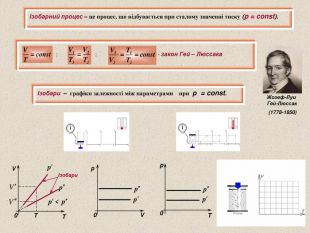
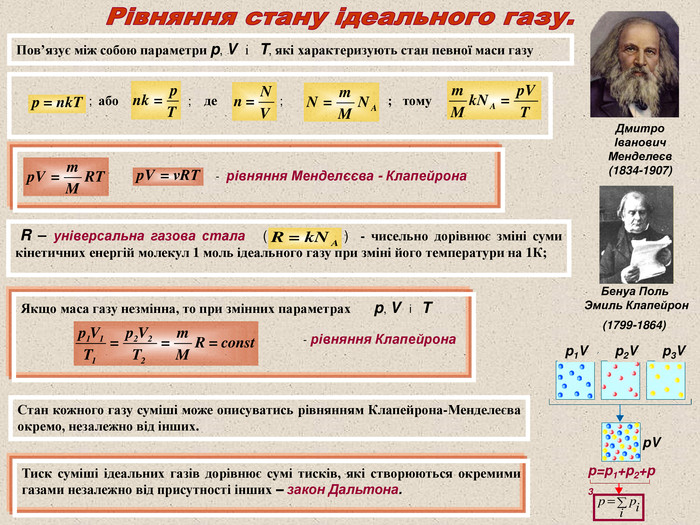
Пов’язує між собою параметри p, V і T, які характеризують стан певної маси газу Дмитро Іванович Менделеєв (1834-1907) Бенуа Поль Эмиль Клапейрон (1799-1864) ; або ; де ; ; тому - рівняння Менделєєва - Клапейрона R – універсальна газова стала ( ) - чисельно дорівнює зміні суми кінетичних енергій молекул 1 моль ідеального газу при зміні його температури на 1К; Якщо маса газу незмінна, то при змінних параметрах p, V і T - рівняння Клапейрона Стан кожного газу суміші може описуватись рівнянням Клапейрона-Менделеєва окремо, незалежно від інших. Тиск суміші ідеальних газів дорівнює сумі тисків, які створюються окремими газами незалежно від присутності інших – закон Дальтона. p1V p2V p3V pV p=p1+p2+p3
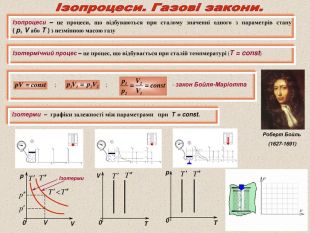
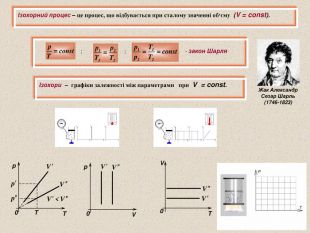
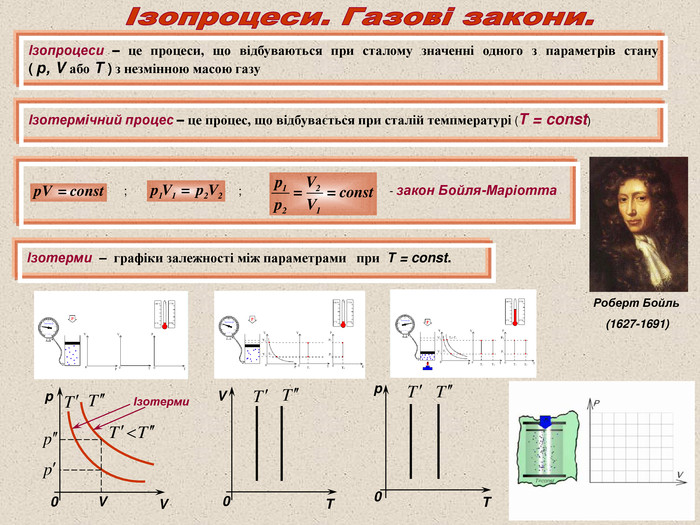
Ізопроцеси – це процеси, що відбуваються при сталому значенні одного з параметрів стану ( р, V або Т ) з незмінною масою газу Ізотермічний процес – це процес, що відбувається при сталій темпмературі (Т = const) ; ; - закон Бойля-Маріотта Ізотерми – графіки залежності між параметрами при Т = const. V T 0 0 T p Роберт Бойль (1627-1691) V p V 0 Ізотерми
Тема №1 Теоретичні питання Початковий рівень Як називають розділ фізики, який розглядає будову і властивості речовин у різних агрегатних станах на основі вчення про молекули та їх рух? Сформулюйте основні положення молекулярно-кінетичної теорії. Які досліди і спостереження підтверджують молекулярно-кінетичну теорію? Опишіть дифузію газів, рідин і твердих тіл. Чому для вимірювання маси атомів та молекул в хімії та фізиці прийнято умовну атомну одиницю маси (а. о. м.)? Що вам відомо про розміри та швидкість руху молекул? Середній рівень Якими властивостями наділено ідеальний газ? Для чого введено поняття ідеального газу? Що таке кількість речовини і молярна маса? Як температура тіла пов'язана з енергією руху молекул? Дайте визначення температури. Сформулюйте основне рівняння молекулярно-кінетичної теорії газів і запишіть його формулу. Що таке ізопроцес? Який зв'язок між параметрами газу в різних ізопроцесах? Як експериментально визначають параметри стану газу?
Достатній рівень Що таке броунівський рух і в чому його особливості та значення? Поясніть на основі молекулярно-кінетичної теорії кілька молекулярних явищ, що трапляються в природі і використовуються в техніці. Як на основі молекулярних уявлень пояснити температуру і тиск газу? У чому полягає фізичний зміст сталої Авогадро? сталої Больцмана? універсальної газової сталої? Як побудована шкала Цельсія? абсолютна шкала (шкала Кельвіна)? Як із рівняння стану ідеального газу отримати рівняння ізопроцесів? Високий рівень Виведіть основне рівняння молекулярно-кінетичної теорії газів. Накресліть в координатних осяхр, V; V,T ip.T ізотерми, ізохори та ізобари. Поясніть виникнення сил пружності в твердих тілах під час деформацій розтягу і стискання. На чому ґрунтується метод вимірювання температури? Дайте аналіз і порівняйте температурні шкали Цельсія і Кельвіна. Доведіть, що температура є енергетичною характеристикою стану речовини, мірою середньої кінетичної енергії молекул. Чи можна газові закони, встановлені для ідеального газу, застосувати для реальних газів? Що описує рівняння Ван-дер-Ваальса?
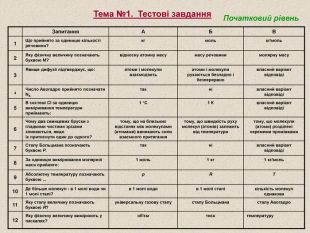
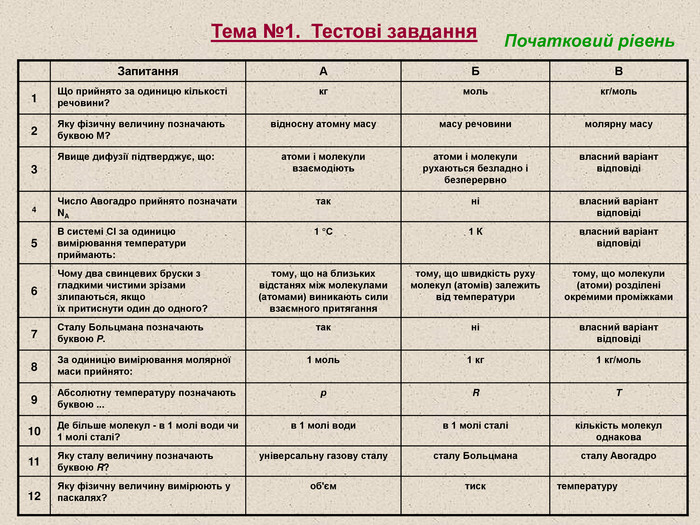
Запитання А Б В 1 Що прийнято за одиницю кількості речовини? кг моль кг/моль 2 Яку фізичну величину позначають буквою М? відносну атомну масу масу речовини молярну масу 3 Явище дифузії підтверджує, що: атоми і молекули взаємодіють атоми і молекули рухаються безладно і безперервно власний варіант відповіді 4 Число Авогадро прийнято позначати NA так ні власний варіант відповіді 5 В системі СІ за одиницю вимірювання температури приймають: 1 °С 1 К власний варіант відповіді 6 Чому два свинцевих бруски з гладкими чистими зрізами злипаються, якщо їх притиснути один до одного? тому, що на близьких відстанях між молекулами (атомами) виникають сили взаємного притягання тому, що швидкість руху молекул (атомів) залежить від температури тому, що молекули (атоми) розділені окремими проміжками 7 Сталу Больцмана позначають буквою Р. так ні власний варіант відповіді 8 За одиницю вимірювання молярної маси прийнято: 1 моль 1 кг 1 кг/моль 9 Абсолютну температуру позначають буквою ... р R Т 10 Де більше молекул - в 1 молі води чи 1 молі сталі? в 1 молі води в 1 молі сталі кількість молекул однакова 11 Яку сталу величину позначають буквою R? універсальну газову сталу сталу Больцмана сталу Авогадро 12 Яку фізичну величину вимірюють у паскалях? об'єм тиск температуру Тема №1. Тестові завдання Початковий рівень
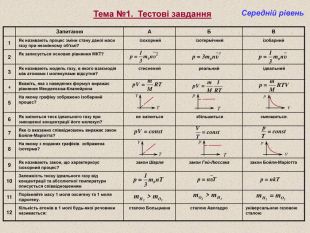
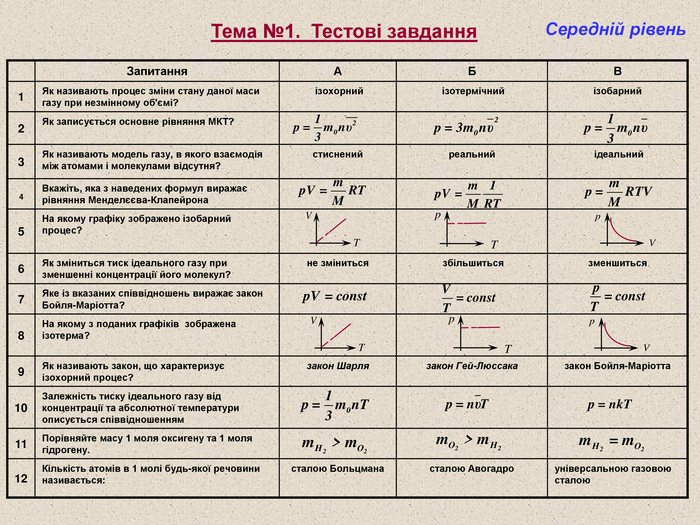
Тема №1. Тестові завдання Середній рівень Запитання А Б В 1 Як називають процес зміни стану даної маси газу при незмінному об'ємі? ізохорний ізотермічний ізобарний 2 Як записується основне рівняння МКТ? 3 Як називають модель газу, в якого взаємодія між атомами і молекулами відсутня? стиснений реальний ідеальний 4 Вкажіть, яка з наведених формул виражає рівняння Менделєєва-Клапейрона 5 На якому графіку зображено ізобарний процес? 6 Як зміниться тиск ідеального газу при зменшенні концентрації його молекул? не зміниться збільшиться зменшиться 7 Яке із вказаних співвідношень виражає закон Бойля-Маріотта? 8 На якому з поданих графіків зображена ізотерма? 9 Як називають закон, що характеризує ізохорний процес? закон Шарля закон Гей-Люссака закон Бойля-Маріотта 10 Залежність тиску ідеального газу від концентрації та абсолютної температури описується співвідношенням 11 Порівняйте масу 1 моля оксигену та 1 моля гідрогену. 12 Кількість атомів в 1 молі будь-якої речовини називається: сталою Больцмана сталою Авогадро універсальною газовою сталою


про публікацію авторської розробки
Додати розробку