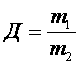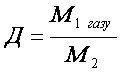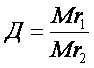Відносна густина газів. Розрахункові задачі «Обчислення відносної густини газів»
Тема. Відносна густина газів. Розрахункові задачі «Обчислення відносної густини газів»
Мета уроку: розкрити суть поняття «відносна густина газів»; вивести формулу для визначення відносної густини газів; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків.
Розвивати вміння висловлювати свою думку, логічне мислення, повагу до вчителя, уміння виділяти головне.
Виховувати толерантність у спілкуванні.
Форми роботи: розповідь учителя, керована практика, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
Базові поняття та терміни: маса, об’єм, густина, нормальні умови, молярна
маса, молярний об’єм.
Тип уроку: засвоєння нових знань.
Хімія - це область чудес,
в ній приховано щастя людства,
найбільші завоювання розуму
будуть зроблені саме в цій області.
ХІД УРОКУ
І. Організаційний етап
ІІ. Мотивація
Для визначення, яка речовина важча за іншу зазвичай використовують густину. Порівнюючи властивості газів, можна також порівнювати їх густину. Але для цього слід мати довідкові дані про густину. У випадку з газами можна зробити висновки, тільки знаючи формули речовин.
Як це можна зробити?
ІІІ. Актуалізація опорних знань
Хімічний диктант
1. Одиниця вимірювання кількості речовини – г/моль
2. Для обчислення кількості молекул необхідно - кількість речовини помножити на число Авогадро
3. Молярна маса чисельно дорівнює відносній молекулярній масі
4. Молярна маса речовини залежить від умов вимірювання
5. Одиниця вимірювання молярного об’єму – л/моль
6. Для обчислення кількості речовини необхідно масу речовини поділити на її молярну масу
Розгадування ребусу

![]() 2 =Д (ВОДЕНЬ)
2 =Д (ВОДЕНЬ)


![]() Р
Р
![]()
![]()
![]()

 (інертний газ)
(інертний газ)

![]()
![]()
![]()
![]()
 (кисень)
(кисень)

![]() (фтор)
(фтор)

![]() 4=Т (АЗОТ)
4=Т (АЗОТ)
IV. Засвоєння нових знань
Відносна густина газів позначається Д і вимовляється «де».
За законом Авогадро відомо, що гази однакових об’ємів містять однакове число молекул. Однак маси цих об’ємів будуть різні. Один газ буде важчий від іншого у стільки разів, у скільки молярна маса першого важча за молярну масу другого газу.
|
|
Відносна густина газів – це відношення молярних мас двох газів, що займають однакові об’єми.
1. 2. 3.
|
|
|
|
|
Якщо
|
Фізичний зміст відносної густини газів показує у скільки разів один газ важчий або легший за інший. З формул 2 і 3 можна визначити молярну і відносну молекулярну маси.
![]() або
або ![]()
Відносну густину газів обчислюють за будь-яким газом. Найчастіше визначають за воднем, киснем, повітрям.
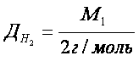
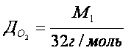
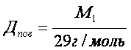
Нерідко молярну масу газу обчислюють, виходячи з маси 1 л цього газу та його молярного об’єму:
![]() тоді
тоді ![]() , де
, де
![]() – густина газу, г/л
– густина газу, г/л
- – молярний об’єм, 22,4 л/моль
Обчислення відносної густини газів і молярної маси газу.
Задача №1. Обчисліть відносну густину сульфур (IV) оксиду за киснем.
|
Дано:
|
Розв’язання: 1. Знаходимо молярні маси сульфур (IV) оксиду і кисню
2. Знаходимо відносну густину газів
Відповідь:
|
|
|
Задача №2. Обчисліть молярну масу гідроген сульфуру, якщо відносна густина його за амоніаком дорівнює 2.
|
Дано:
|
Розв’язання: 1 Виходячи з формули
. Знаходимо молярну масу амоніаку.
3. Підставимо в формулу значення
Відповідь:
|
V. Засвоєння знань, умінь і навичок
Перевірте себе
1. Виберіть формулу, за якою обчислюють відносну густину газів
А) ![]() Б)
Б) ![]() В)
В) ![]() Г)
Г) ![]()
А
Б
В
Г
2. Укажіть число, що відповідає молярній масі повітря:
А) 6,02 • 1023 Б) 22,4 л/моль В) 29 г/моль Г) 44,8 л.
А
Б
В
Г
3. Укажіть формулу газу, важчого за кисень:
А) С3Н8 Б) N2 В) Hе Г) H2
А
Б
В
Г
4. Позначте формули газів, важчих за повітря.
1. CO2 2. NO 3. SO2
4. CH4 5. NO2 6. NH3
А 1,2,6
Б 1,3,5
В 2,4,5
Г 3,5,6
ВИСНОВКИ
Відносна густина газу показує, у скільки разів один газ важчий або легший від іншого.
Відносну густину газу можна обчислити за будь-яким іншим газом. Найчастіше порівнюють гази з воднем або повітрям. Знаючи густину, можна визначити молярну масу невідомого газу.
VІ. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання.
Творче завдання (домашня практика). Самостійно розв’язати задачі.
- Обчисліть відносну густину сульфур(ІV) оксиду: а) за киснем; б) за повітрям.
- Якщо густина пари деякої речовини за воднем дорівнює 4, то її густина за гелієм становить(а) 8; (б) 2; (в) 4; (г) 1.


про публікацію авторської розробки
Додати розробку