Відносна молекулярна маса . Конспект уроку для 7 класу.
Відносна молекулярна маса . Конспект уроку для 7 класу.
Тема : Відносна молекулярна маса , її обчислення за хімічною формулою .
Мета : - поглибити поняття про хімічну формулу , її використання для розрахунків ; дати поняття про відносну молекулярну масу , навчитися визначати відносну молекулярну масу простих і складних речовин .
- розвивати логічне мислення , вміння й навички роботи з періодичною системою хімічних елементів Д.І. Менделєєва , виконувати завдання за алгоритмом .
- виховувати пізнавальний інтерес , творчий підхід до навчання , колективізм .
Методи і методичні прийоми : словесний ( бесіда , розповідь , робота з
підручником , періодичною системою хімічних елементів , виконання тренувальних вправ ) , інтерактивний метод « Шпаргалка », гра « Хімічна естафета », робота в групах .
Тип уроку : засвоєння нових знань та формування практичних умінь і навичок .
Обладнання : періодична система хімічних елементів Д.І. Менделєєва , мультимедійний проектор , дидактичні картки із завданнями, презентація.
Тема : Відносна молекулярна маса , її обчислення за хімічною формулою .
Мета : - поглибити поняття про хімічну формулу , її використання для розрахунків ; дати поняття про відносну молекулярну масу , навчитися визначати відносну молекулярну масу простих і складних речовин .
- розвивати логічне мислення , вміння й навички роботи з періодичною системою хімічних елементів Д.І. Менделєєва , виконувати завдання за алгоритмом .
- виховувати пізнавальний інтерес , творчий підхід до навчання , колективізм .
Методи і методичні прийоми : словесний ( бесіда , розповідь , робота з
підручником , періодичною системою хімічних елементів , виконання тренувальних вправ ) , інтерактивний метод « Шпаргалка », гра « Хімічна естафета », робота в групах .
Тип уроку : засвоєння нових знань та формування практичних умінь і навичок .
Обладнання : періодична система хімічних елементів Д.І. Менделєєва , мультимедійний проектор , дидактичні картки із завданнями, презентація.
… Хімічні формули розповідають хімікові цілу
історію речовини .
Д.І. Менделєєв .
Хід уроку
І.Організаційний етап .
Добрий день діти та гості !
-Діти ! Сьогодні ви не просто учні , а справжні дослідники .Для того , щоб було комфортно працювати , проведемо аутотренінг .
Повторюємо :
-Я- творча особистість .
-Я думаю , отже , я існую…
- Я аналізую, висловлюю свої судження .
-Я хочу знати !
ІІ .Актуалізація опорних знань .
Домашнє завдання
1. Індивідуальні завдання
І ВАРІАНТ
1.( 1 Б.) Напишіть назви хімічних елементів, позначених такими символами:
Н, К, Ва.
2. (1 Б.) Підкреслити хімічні елементи -метали: С, Сu, Р, О, Н, Аg , Ca
3.( 2 Б.) Гра «Хрестики-нулики». Закресліть лінію, що містить тільки: а) прості; б) неметали;
|
а ) |
б) |
||||
|
СІ 2 |
Na |
А1 |
N2 |
С |
О2 |
|
Р |
Mg |
HCl |
СО |
Н2 |
K |
|
HBr |
NH 3 |
P2O5 |
S |
N2O5 |
Na |
4.( 2 Б.) Із запропонованих речовин випишіть окремо прості та складні речовини :
Вода, кисень, іод, залізо, сіль, вуглекислий газ, алюміній, золото, крейда, азот.
5. ( 2 Б.) Записати з допомогою хімічних символів, індексів та коефіцієнтів такі вирази:
п'ять-о-два; аш-два;
о-три; десять-алюміній;
кальцій-це-о-три; калій-манган-о-чотири;
два-сульфур; чотири-пе ;
аш-два-о; три-ферум.
6.( 2 Б.) Визначити валентність хімічних елементів у сполуках:
ІІІ І ІІ І
СuО, Са3N2 , ВаС12, Р205, К2S, РЬ02, Сг203, А1Вг3
II ВАРІАНТ
1.(1 Б.) Напишіть назви хімічних елементів, позначених такими символами:
О, Са, СІ.
2.( 1 Б.) Підкреслити хімічні елементи-неметали: Аu, Н, О, А1, S, С, Р .
3.( 2 Б.) Гра «Хрестики-нулики» Закреслить лінію, що містить тільки: а) метали; б) складні речовини.
|
а) |
б) |
||||
|
Na |
А1 |
K |
C |
O |
Вг |
|
Мn |
O |
N2 |
ВаCI2 |
AI 2O 3 |
СаO |
|
SO2 |
СuO |
H2O |
N 2 |
Аu |
СІ 2 |
4.(2 Б.)Із запропонованих речовин випишіть окремо прості й складні речовини.
Вугілля, фосфор, срібло, хлороводень, сірка, перекис водню, мідь, залізо,кисень , водень .
5. (2 Б.) Записати з допомогою хімічних символів, індексів та коефіцієнтів такі вирази:
чотири-аш-два; вісім-хлор-два;
десять-аш-два-о; барій –хлор –два ;
три-ферум-три-о-чотири; флуор-два;
аш-два-ес-о-чотири; калій-два-хром-два-о-сім
кальцій-о; барій-ес –о-чотири
6.( 2 Б.) Визначити валентність у сполуках:
І ІІ
СС14, СаО, N2 O , ZпС12, Р 2O 5, Fе203, Сг03, А1 2S 3.
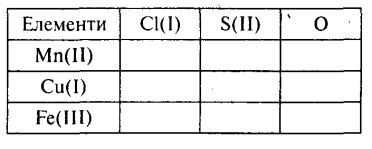
2.Складання формул бінарних сполук ( біля дошки )
Заповніть клітини таблиці формулами бінарних сполук, утворених зазначеними в таблиці елементами.

Виконує учень в зошиті
3. Інтерактивна вправа « Шпаргалка »
Вчитель роздає два різновиди карток : на одних записує термін , а на інших – його визначення .Один учень називає термін , а інший – правильне його визначення
|
«Шпаргалка» |
|
|
Термін |
Визначення |
|
Хімічна формула |
Умовний запис складу речовини за допомогою хімічних символів та індексів . |
|
Молекула |
Частинка речовини, що складається з декількох атомів і характерактеризує хімічні властивості речовини |
|
Хімічний елемент |
Види атомів з певним зарядом ядра |
|
Якісний склад речовини |
Вид атомів різних хімічних елементів у певній речовині |
|
Кількісний склад речовини |
Кількість атомів різних хімічних елементів у певній речовині |
|
Валентність |
Це властивість атомів хімічних елементів утворювати певну кількість зв'язків з іншими атомами . |
|
Відносна атомна маса |
Фізична величина , яка дорівнює відношенню маси атома до 1|12маси атома Карбону . |
|
Прості речовини |
Речовини, що містять атоми тільки одного хімічного елемента |
|
Складні речовини |
Речовини, що містять атоми або йони різних хімічних елементів |
ІІІ .Мотивація навчальної діяльності .
Тему нашого уроку записано на дошці . Для того , щоб її прочитати з'ясуємо відносні атомні маси хімічних елементів у таблиці . Відкриємо слова так , щоб значення відносних атомних мас були розміщенні у порядку зростання .Ми отримали тему нашого уроку .
|
Хімічний елемент |
Відносна атомна маса |
Тема уроку |
|
Оксиген |
16 |
маса |
|
Карбон |
12 |
Відносна |
|
Ca |
40 |
її обчислення |
|
Ферум |
56 |
за хімічною |
|
N |
14 |
молекулярна |
|
Цинк |
65 |
формулою . |
|
Mg |
24 |
речовини , |
Тема уроку ( Слайд 1 ) : Відносна молекулярна маса речовини , її обчислення за хімічною формулою . ( Слад 2 )
Завдання
|
|
|
|
Знати теоретичний матеріал
М r (речовини ) =n 1 * A r (E 1 )+n 2 * A r ( E 2 ) + … |
Навчитися розв'язувати розрахункові задачі • Уміти обчислювати відносну молекулярну масу речовини (Мг).
|
Хімічна формула ( Слайд 3 )
Zn SO 4
Якісний склад Кількісний склад
1) проста чи складна речовина; 1) скільки атомів Е входить до
2) які Е входять до складу молекули. складу молекули;
– Ми розширимо наші знання про кількісний склад молекул, додавши до схеми:
2) відносна молекулярна маса Відносна молекулярна маса
Відносна молекулярна маса застосовується не тільки для атомів, але й для молекул. Відносна молекулярна маса Мг показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону.
(Слайд 4 )
Відносна молекулярна маса речовини – це фізична величина , яка дорівнює відношенню маси молекули до 1/12 маси атома Карбону .

1. Відносна молекулярна маса – це фізична величина, що показує відносну масу молекули.
2. Відносна молекулярна маса позначається Мr.
Наприклад: Мr (Cl 2); Мr (H 2S O 4); Мr (Ba(OH) 2).
3. Для обчислення відносної молекулярної маси Мr використовують відносні атомні маси Аr елементів.
ПРИГАДАЙТЕ! Відносну атомну масу елемента Аr знаходять в періодичній системі хімічних елементів і округлюють до цілого значення.
Відносна молекулярна маса дорівнює сумі відносних атомних мас усіх хімічних елементів, що входять до складу молекули, з урахуванням числа атомів кожного елемента.
Наприклад, молекула води Н20 складається з двох атомів Гідрогену й одного атома Оксигену. Отже, відносна молекулярна маса води дорівнює сумі двох відносних атомних мас Гідрогену й однієї відносної атомної маси Оксигену:
МГ(Н20) = 2-АГ(Н) + АГ(0) = 2-1 + 16 = 18.
Розглянемо алгоритм обчислення відносної молекулярної маси
Слайд 5 . Алгоритм обчислення відносних молекулярних мас Mr
|
Послідовність дій |
Приклади виконаних дій |
|
1) Прочитайте текст задачі |
Обчисліть відносну молекулярну масу нітроген(V) оксиду |
|
2) Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень |
Дано: N2O5 |
|
3) Запишіть хімічну формулу речовини
|
N2O5 |
|
4) Користуючись довідковою таблицею, випишіть відносні атомні маси елементів, що входять до складу речовини |
Аr(N) = 14 |
|
5) Складіть формулу розрахунку відносної молекулярної маси, розглядаючи Mr як суму добутків Ar (E) на число атомів кожного з них |
Mr (N2O5) = 2Ar(N) + 5Ar(O) |
|
6) Розрахуйте Mr речовини за складеною формулою |
Mr(N2O5)=14х2 + 16х5 = 108 |
|
7) Запишіть відповідь
|
Відповідь: Mr (N2O5) = 108 |
V .Формування умінь і навичок
Підручник с.68 №2
- Молекула сахарози складається з 12 атомів Карбону, 22 атомів Гідрогену ,
11 атомів Оксигену .Напишіть формулу сахарози та обчисліть її відносну молекулярну масу .
М r (С 12 Н 22 О 11 ) =12*12 +22*1+11*16 =342
Слайд 6
Слайд 7
2 .Гра. Хімічна естафета.
Клас ділиться на 3 рівні команди. Кожна команда одержує завдання (по кількості учасників гри). В завданні окремі дії виконує один член команди. Листки з завданнями передаються, як естафета. Фіксується час виконання завдань. Естафетні листки команд взаємно перевіряються. Перемагає команда, яка показала кращий час, допустила менше помилок .
Завдання 1 . Визначити відносну молекулярну масу натрій сульфату Na 2SO
1) Визначити Аr(Na) =
2) Визначити Аr(О) =
3) Визначити Аr(S) =
4) Записати формулу для визначення Мr (Na 2SO 4 ) =
5) Підставити цифрові значення Мr (Na 2SO 4 ) =
6) Обчислити Мr (Na 2SO 4 ) =
Завдання 2 Визначити відносну молекулярну масу калій карбонату К 2CO 3 .
1) Визначити Аr(К) =
2) Визначити Аr(О) =
3) Визначити Аr(С) =
4) Записати формулу для визначення Мr (К 2CO 3 ) =
5) Підставити цифрові значення Мr (К 2CO 3 ) =
6) Обчислити Мr (К 2CO 3 ) =
Завдання 3 Визначити відносну молекулярну масу літій ортофосфату
L I 3 PO 4
1) Визначити Аr(L I ) =
2) Визначити Аr(P) =
3 ) Визначити Ar ( O ) =
4) Записати формулу для визначення Мr (L I 3 PO 4) =
5) Підставити цифрові значення Мr (L I 3 PO 4) =
6) Обчислити Мr (L I 3 PO 4) =
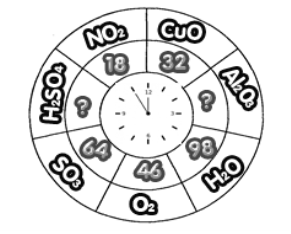
4 .Головоломка .На скільки секторів необхідно повернути за годинниковою стрілкою зовнішнє коло у схемі , щоб одержати правильну відповідність .
![]()
![]()
VI. Підведення підсумків
1. Яку фізичну величину ми вивчили на уроку?
2. Яка величина називається відносною молекулярною масою?
Оцінювання
1. Найцікавішим на цьому уроці для мене було...
2. Ми набули навичок...
VII. Домашнє завдання
I-IIІ рівень. Вивчити §9 на Ст.64-65, розв’язати задачі Ст.68 №1, 2 IV рівень. §9, розв’язати задачі Ст.23 збірник №98.
-
-
Дякую


про публікацію авторської розробки
Додати розробку
