Відносна молекулярна маса речовини
7 клас Урок № 12
Відносна молекулярна маса речовини
Мета уроку: сформувати уявлення про відносну молекулярну масу та відносну формульну масу; поглибити знання учнів про прості й складні речовини; навчити обчислювати відносну молекулярну масу простих і складних речовин за їхніми формулами;розвивати вміння проводити математичні обрахунки;виховувати згуртованість та відповідальність за спільну справу.
Очікувані результати: учні мають навчитися обчислювати відносну молекулярну й відносну формульну масу речовин за хімічними формулами; уміти пояснювати відмінність між термінами «відносна молекулярна маса» і «відносна формульна маса».
Базові поняття й терміни: речовина, проста речовина, складна речовина, відносна атомна маса, відносна молекулярна маса, відносна формульна маса.
Обладнання та матеріали: папки-«підказки», дидактичні картки
Тип уроку: комбінований
1. Організаційний етап
2. Перевірка домашнього завдання
Індивідуальні завдання на картках
3. Актуалізація опорних знань
. Бесіда.
1. Що таке хімічна формула?
2. Що позначає індекс?
3. Як називається число, яке позначає кількість молекул або окремих атомів?
4. Що називають відносною атомною масою?
6. Як позначають відносну атомну масу?
7. Як можна визначити відносну атомну масу?
8. З яких частинок складаються речовини?
4. Мотивація навчальної діяльності
Проблемне запитання:
— Яку інформацію ми можемо отримати з хімічної формули?
Показ практичного значення вивчення нового матеріалу.
Слово вчителя
Вам уже відомо, що атомам хімічних елементів властиве певне значення відносної атомної маси Аr. Так само кожна хімічна сполука має своє значення відносної молекулярної маси.
Повідомлення теми уроку.
Формулювання разом з учнями мети й завдань уроку.
5. Етап засвоєння нових знань
План пояснення нового матеріалу
- Відносна молекулярна маса. Правила визначення відносної молекулярної маси. (Коментар учителя.)
Кожна хімічна сполука має своє значення відносної молекулярної маси, яке виражають за допомогою символу Mr.
Відносна молекулярна маса — це фізична величина, що дорівнює відношенню маси речовини певного формульного складу до 1/12 маси атома Карбону.
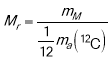 .
.
Робота з підручником. Учні записують визначення відносної молекулярної маси(підручник ст..64.)
2. Відносна формульна маса. (Коментар учителя.)
Звернути увагу учнів
Визначаючи відносні молекулярні (формульні) маси, слід ураховувати кількість атомів кожного елемента в молекулі!
Наприклад:
Мr(N2) = 2Ar(N) = 2 · 14 = 28;
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 · 16 = 44;
Mr(K2SO4) = 2 · 39 + 32 + 4 · 16 = 174.
Mr(АІ2 (SO4) 3) = 2 · 27 + 3 32 + 4 · 16 3= 260.
(а+в)с=ав+вс
Учні користуються папками-«підказками»(картка №6)
6. Узагальнення й систематизація знань
Завдання на закріплення матеріалу.
1. Обчисліть відносну молекулярну масу для таких сполук: PH3, H2SO4, HCl. (Відповідь: 36; 98; 36,5.)
2. Обчисліть відносну формульну масу для таких сполук: NaOH, Cu(NO3)2, FeBr3. (Відповідь: 40; 188; 296.)
3. Обчисліть відносні молекулярні маси сполук: а) аргентум нітрату, що складається з одного атома Аргентуму й трьох атомів Оксигену; б) купрум сульфату, що складається з одного атома Купруму, одного атома Сульфуру й чотирьох атомів Оксигену. (Відповідь: 170; 160.)
4. Залізо утворює три оксиди, у яких: а) на один атом Феруму припадає один атом Оксигену; б) на два атоми Феруму припадає три атоми Оксигену; в) на три атоми Феруму припадає чотири атоми Оксигену. Складіть формули оксидів Феруму
й розрахуйте їхні відносні молекулярні маси. (Відповідь:
FeO — 72; Fe2O3 — 160; Fe3O4 — 232.)
6. Відносна молекулярна маса невідомого чотиривалентного елемента з Гідрогеном дорівнює 16. Укажіть назву невідомого елемента й запишіть формулу сполуки. (Відповідь: C; CH4.).
Дидактична гра «Хімічний лабіринт»
Робота в групах
|
Старт |
Р2О5 |
|
СН4 |
Ва(ОН)2 |
|
Н2СО3 |
фініш |
Вдповідь на фініші – це сума Mr, яка =291
. Домашнє завдання, інструктаж щодо його виконання
Підручник :опрацювати 9 (ст..64,65)
Виконати завдання 1на ст..68.(всі учні),2,3 (9 б),10 (11б)
Індивідуальне завдання(кожен учень має обрахувати Mr своєї сполуки)
7. Підбиття підсумків уроку
Повернення до проблемного запитання.
Проблемне запитання:
— Яку інформацію ми можемо отримати з хімічної формули?
Прийом «Смайлик»
Хімічний лабіринт
|
Старт |
Р2О5 |
|
СН4 |
Ва(ОН)2 |
|
Н2СО3 |
фініш |
Хімічний лабіринт
|
Старт |
Р2О5 |
|
СН4 |
Ва(ОН)2 |
|
Н2СО3 |
фініш |
Хімічний лабіринт
|
Старт |
Р2О5 |
|
СН4 |
Ва(ОН)2 |
|
Н2СО3 |
фініш |


про публікацію авторської розробки
Додати розробку
