Відносна молекулярна маса речовини. її об¬числення за хімічною формулою. Масова частка елементів у речовині
Урок 3
Відносна молекулярна маса речовини. її обчислення за хімічною формулою. Масова частка елементів у речовині
Мета: поглибити поняття про хімічну формулу, її використання для розрахунків; дати поняття про відносну молекулярну масу; формувати вміння й навички обчислювання за хімічними формулами; навчити визначати відносну молекулярну масу простих і складних речовин за їх формулами; навчити обчислювати масову частку - елемента в складі складних речовин, використовувати поняття «масова частка» для розв'язання задач на визначення хімічних формул; виховувати логічне мислення.
Тип уроку: поглиблення знань, формування вмінь і навичок.
Форми роботи: розповідь, самостійна робота
Обладнання: періодична система хімічних елементів, мультимедійна презентація
Хід уроку
І. Організація класу
ІІ. Фронтальне опитування, перевірка домашнього завдання
На дошці — п'ять формул:
Са, СО2, Н2, Na20, Н2504.
Фронтальне опитування (усно)
1. Що таке валентність?
2. Чим ви скористаєтеся, якщо вам потрібно знайти значення валентності деякого хімічного елемента? (Періодичною системою).
3. Як визначити валентність атома хімічного елемента за його положенням в періодичній системі?
4. Яка частинка називається атомом?
5. Чи має масу атом? (Так)
6. З яких частинок складається речовина?
7. Яка частинка називається молекулою?
8. Що ми дізнаємося про речовину з її хімічної формули?
9. Чи має масу молекула?
10. Які речовини називаються простими?
11. Які речовини називаються складними?
12. Що таке хімічна формула?
13. Що виражає хімічна формула?
14.Що таке відносна атомна маса?
• Розділіть запропоновані речовини на прості та складні. (Працює один учень біля дошки.)
Са, СO2, Н2, Nа20, Н2SO4.
• Прочитайте формули записаних речовин і розшифруйте якісний і кількісний склад цієї речовини. (Працюють по черзі п'ятеро учнів.)
III. Актуалізація і поглиблення знань
• Чи можна стверджувати, що маси кожного атома в молекулі речовини однакові?
(Ні, тому що в усіх елементів різні атомні маси)
• 3 допомогою періодичної системи хімічних елементів визначте відносну атомну масу кожного елемента. Са, СO2, Н2, Nа20, Н2SO4.
На дошці висить намальована хімічна колба, в якій знаходяться кольорові фігури-атоми елементів. Маса колби дорівнює сумі мас всіх атомів, які входять до її складу. Так само й маса молекули дорівнює масам всіх атомів з яких вона складається.
• А як обчислити масу всієї молекули? (Як суму атомних мас усіх атомів, що входять до складу молекули)
Молекулярна маса — це маса однієї молекули певної речовини.
• А якщо для визначення молекулярної маси використовувати наведені в таблиці відносні атомні маси?
Відносна молекулярна маса— це фізична величина, що показує, у скільки разів маса певної молекули більша за 1/12 маси атома Карбону — 12.
Одиниця вимірювання: [Мr.] = а.о.м. Відносна молекулярна маса — величина безрозмірна.
- Що можна сказати про формулу CaCO3?
- Як визначити масу молекули кальцій карбонату CaCO3?
Маса молекули кальцій карбонату CaCO3 складається з маси атома Кальцію, маси атома Карбону і маси атома Оксисену, взятій тричі. (Учитель записує на дошці, учні — в зошитах).
Mr(CaCO3) = Ar (Сa) + Ar (С) + 3Ar (O).
Отже, хімічна формула речовини дозволяє обчислити відносну молекулярну масу речовини.
• Як можна виразити склад речовини у відсотках?
(Якщо прийняти відносну молекулярну масу речовини за 100 %, то маса кожного елемента може бути виражена як масова частка цього елемента в складі молекули)
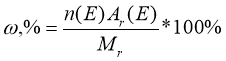
де п — число атомів елемента в молекулі; Ar — відносна атомна маса елемента; Мr -— відносна молекулярна маса. Наприклад: Nа2O.
IV. Формування практичних знань і навичок
Завдання 1. Складіть за валентністю формули й обчисліть відносну молекулярну масу речовин, обчисліть масові частки елементів у:
АІО, СаО, КS.
Завдання 2. Обчисліть відносні молекулярні маси та масові частки елементів у молекулах Fe2O3, С02.
Завдання 3. Самостійна робота в парах
Кожна пара одержує картку-завдання і повинна обчислити суму відносних молекулярних мас та масових часток елемента Оксигена.
- H3PO4 98
- Na2SiO3 122
- Mg(NO3)2 148
Додаткове завдання. Розташуйте речовини в порядку зростання відносних молекулярних мас.
V. Підбиття підсумків уроку
Ми познайомилися з іще однією можливістю використання хімічних формул. На уроці ми виконували багато завдань, виставляли оцінки, що враховують усі завдання.
VI. Домашнє завдання
Прочитати параграф


про публікацію авторської розробки
Додати розробку
