Водень. Гримучий газ. Водень – екологічно чисте паливо. Практична робота №2 « Добування водню та його горіння»
Конспект уроку з факультативного курсу "Цікава хімія" (7 клас)
Дата ________ Клас_____7____
Тема: Водень. Гримучий газ. Водень – екологічно чисте паливо. Практична робота №2 « Добування водню та його горіння» .Інструктаж з БЖД
Мета: формування компетентсностей : поглибити знання учнів про неметалічні елементи та їхні прості речовини на прикладі Гідрогену, розглянути його поширеність, колообіг та біологічну роль; сформувати вміння добувати водень в лабораторних умовах та способами його збирання; розвивати логічне мислення, вміння працювати з текстом, виступати перед аудиторією; виховувати культуру поведінки та спілкування, акуратного ставлення до лаборатоного обладнання.
Очікувані результати: учні розуміють різницю між поняттями «Гідроген» і «водень»; називають поширеність і значення Гідрогену; називають вченого, який відкрив водень; знають основні методи добування водню в лабораторії та вказують основні фізичні властивості, які є ключовими при виборі способу його збирання; розуміють економічну і екологічну цінність водню як природнього палива.
Реалізація НЛ: громадянська відповідальність, екологічна безпека і сталий розвиток, підприємливість і фінансова грамотність, здоров'я і безпека.
Тип уроку: вивчення нового матеріалу
Хід уроку
І. Організаційний етап
Привітання, налаштування на робочий лад
ІІ. Актуалізація опорних знань
Бесіда (спрямована на повторення будови періодичної системи, класифікацію хімічних елементів)
Орієнтовні питання:
1. Скільки груп і періодів містить короткоперіодичний варіант ПСХЕ? Довгоперіодичний?
2. Що зазначається в кожній комірці ПСХЕ?
3. Як класифікують всі хімічні елементи?
4. До яких елементів (металічних чи неметалічних) належить перший елемент ПСХЕ?
ІІІ. Мотивація навчальної діяльності
Діти розгадують ребус(Гідроген)
ІV.Вивчення нового матеріалу
1. Положення Гідрогену в ПСХЕ( Періодична система хімічних елементів)
*Робота учнів з ПСХЕ
2. Поширеність і колообіг Гідрогену в природі. Біологічна роль Гідрогену
* Робота учнів з текстом
Поширеність у природі
а) Гідроген – основний елемент Космосу (92% усіх атомів)
Сонце складається на 75 % з Гідрогену,
Юпітер — на 80 %,
Сатурн — на 60 %.
б) На Землі Гідроген зустрічається переважно в зв'язаному стані. Входить до складу молекул води, органічних речовин. Вміст Гідрогену у земній корі і гідросфері дорівнює 1 %
У вільному стані, як водень, входить до складу природних газів.
Колообіг Гідрогену
Джерелами надходження Гідрогену в повітряну оболонку Землі є Світовий океан, кратери вулканів, деякі фотохімічні реакції в атмосфері. Через свою легкість водень з атмосфери Землі потрапляє в космічний простір. Але його кількість на Землі не зменшується, тому що ядра Гідрогену
«сонячного вітру» (Під час термоядерних процесів на Сонці з Гідрогену утворюються інші хімічні елементи та протони Н+, які викидаються в навколосонячний простір у вигляді так званого сонячного вітру.) досягнувши Землі, реагують з киснем атмосфери і випадають звичайним дощем.
Біологічна роль Гідрогену
Гідроген входить до складу всих живих організмів. Атоми Гідрогену беруть участь в утворенні водневого зв'язку. Саме водневий зв'язок в живих організмах сприяє:
-утворенню вторинної структури білка;
-забезпечує точне копіювання молекули ДНК;
-розчинення різних речовин у воді.
- Гідроген у складі води бере участь у переміщенні речовин у живому організмі (рух крові, лімфи), у забезпеченні організму киснем.
Робота з презентацією+розповідь вчителя:
3. Проста речовина Гідрогену. Відкриття водню(+доповідь учня)
Виділення горючого газу при взаємодії кислот та металів спостерігали у XVI та XVII століттях на початку становлення хімії як науки, такі вчені як наприклад Парацельс чи Роберт Бойль. У своїй дисертації «О металлическом блеске» Михайло Ломоносов описав отримання водню в результаті дії кислот на залізо та інші метали, і першим (1745)) висунув гіпотезу про те, що водень являє собою флогістон. 1766року і відомий англійський фізик та хімік Генрі Кавендіш, який докладним чином вивчив властивості водню, висунув подібну ж гіпотезу. Досліджуючи як при спаленні водень давав воду, він називав його «горючим повітрям», отриманим з «металів», і вважав, як і всі флогістики, що при розчиненні в кислотах метал втрачає свій флогістон. І тому дотримання Кавендішом теорії флогістону і завадило йому зробити правильні висновки. Французький хімік Антуан Лавуазьє разом із інженером Жаном Меньє, використовуючи спеціальні газометри, у 1783 році здійснили синтез води, а згодом її аналіз, розклавши водяну пару розжареним залізом. Таким чином вони встановили, що водень входить до складу води (H2O) та може бути отриманий із неї. Ізотопи водню було відкрито в 30-x роках XX століття й вони швидко набули великого значення в науці й техніці. Наприкінці 1931 Юрі Брекуедд і Мерфі досліджували залишок після тривалого випарювання рідкого водню і виявили в ньому важкий водень 2Н з атомною масою 2. Цей ізотоп назвали дейтерієм (Deuterium, D) від грец. — другий. Через чотири роки у воді, підданій тривалому електролізу, було виявлено ще важчий ізотоп водню 3Н, який назвали тритієм (Tritium, Т), від грец. — Третій.
4. Фізичні властивості водню(Доповідь учня)
Водень — найлегший газ, він легший за повітря в 14,5 разів. Тому, наприклад, мильні бульбашки, наповнені воднем, у повітрі здіймаються вгору. Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим самим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря.
Молекула водню складається з двох атомів Гідрогену — Н2. За нормальних умов, водень — це газ без кольору, запаху й смаку з густиною0,08987 г/л (н.у.), температурою кипіння −252,76 °C, теплота згорянна 120,9 Дж/кг. Водень малорозчинний у воді — 18,8 мл/л. Але він добре розчиняється у багатьох металах (Ni, Pt, Pd тощо), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний у сріблі.
Рідкий водень існує в дуже вузькому інтервалі температур від −252,76 до −259,2 °C. Це безбарвна рідина, дуже легка (густина при −253 °C — 0,0708 г/см³) й текуча (в'язкість при −253 °C — 13,8 пуаз). Критичні параметри водню дуже низькі: температура −240,2 °C і тиск 12,8 атм. Цим пояснюються труднощі при зрідженні водню.
Твердий водень має температуру плавлення −259,2 °C, густину 0,0807 г/см³ (при −262 °C) — білосніжна маса. У 1935 році Уінгер і Хунтінгтон висловили припущення про те, що при тиску понад 250 тисяч атм водень може перейти в металевий стан. Отримання цієї речовини в стійкому стані відкривало дуже привабливі перспективи його застосування — адже це був би надлегкий метал, компонент легкого і енергомісткого ракетного палива. 2014 року було встановлено, що за тиску порядку 1,5-2,0 млн атм водень починає поглинати інфрачервоне випромінювання, а це означає, що електронні оболонки молекул водню поляризуються. Можливо, за вищого тиску водень перетвориться в метал.
5. Добування і збирання водню
Розповідь вчителя: Рідкий і твердий водень одержати в земних умовах дуже важко, але для інших планет це цілком звичайний його стан. Так, під атмосферою гіганта Сонячної системи — планети Юпітер є океан рідкого водню завглибшки тисячі кілометрів, а під ним — оболонка з твердого водню
Учні конспектують :
Добування водню
І. В лабораторії.
Для добування водню в лабораторії використовують апарат Кіппа. (Демонстрація)
1.Взаємодія металів (переважно Zn чи Fe) з кислотами (НСl чи Н2SO4)
Zn+ 2НСl → ZnCl2 + H2↑
2.Взаємодія лужних чи лужноземельних металів з водою.
2Na +2H2O →2NaOH + H2↑
3.Електроліз води.
2Н2О → 2H2↑ + О2
ІІ. В промисловості. (Для ознайомлення)
У промисловості водень добувають кількома способами.
1.Конверсія (перетворення) метану з водяною парою:
t, Ni
СН4 + 2Н2О = СО2 + 4Н2
2.Конверсія вуглецю.
С + Н2О = СО + Н2
3.Розклад метану
СН4 → С + 2Н2
4.Глибоке охолодження коксового газу.
Способи збирання водню:
1.
2.Витіснення води, оскільки водень малорозчинний у воді (перегляд відеофільму)
Виконання практичної роботи №2 « Добування водню та його горіння». Інструктаж з БЖД. (Виходячи з матеріальної бази – використовується віртуальна лабораторія)
6. Водень – гримучий газ. Водень – екологічно чисте паливо (Доповідь учнів).
Кисень при змішуванні з воднем утворюють так званий гримучий газ - вибухонебезпечну суміш. Коли ті ж самі атоми кисню і водню об'єднуються в одну молекулу, вони утворюють воду - найважливішу, необхідну для життя речовину.
Вже сьогодні більшість автомобільних компаній представили прототипи автомобілів на паливних елементах з ТПЕ і ведуть інтенсивні розробки в даній області. А нині запущена програма з дослідної експлуатації 40 автомобілів на водневих паливних елементах в різних містах США.
У США починаючи з 2003 року виділяються кошти в розмірі 1,2 млрд. доларів за президентською програмою переходу до водневої енергетики .
Крім транспорту областю застосування паливних елементів може стати децентралізоване енергопостачання . За оцінками, у Німеччині до 2010 р. частка паливних елементів в опаленні та електропостачанні складе 10-30%. Енергоустановки на їх основі електричною потужністю 1,5 кВт і тепловою потужністю 2,9 кВт будуть використовуватися в котеджах і багатоквартирних будинках.
Паливні елементи з ТПЕ знаходять своє застосування і в більш спеціалізованих областях. Наприклад, їх використання в якості енергоустановок може зробити підводні човни безшумними і звести до мінімуму теплові викиди. У космосі паливні елементи використовують з 1960 -х р.р. Для забезпечення споживачів воднем в найближчі роки необхідно створити водневу інфра- структуру (мережа водневих заправних станцій для автомобілів на паливних елементах і т.п.). При реалізації цього завдання незамінні електролізери води з ТПЕ .
Основна перешкода для комерціалізації паливних елементів і електролізерів з ТПЕ полягає у використанні електрокаталізатори на основі платини. Використання даного металу призводить до ряду значних проблем, що обмежують застосування паливних елементів
V. Узагальнення і систематизація знань
*Вправа «Сторінка зі щоденника»
Учням пропонується відновити сторінку зі щоденника швейцарського алхіміка Парацельса, котрий жив і працював в Італії. Відкрив свого часу водень.
VІ. Підсумки уроку
VII.Домашнє завдання
Підібрати загадки про водень
Знайти цікаві факти про сірку
Підготувати доповідь «Знаходження сірки в природі»
Дата ________ Клас_____7____
Тема: Водень. Гримучий газ. Водень – екологічно чисте паливо. Практична робота №2 « Добування водню та його горіння» .Інструктаж з БЖД
Мета: формування компетентсностей : поглибити знання учнів про неметалічні елементи та їхні прості речовини на прикладі Гідрогену, розглянути його поширеність, колообіг та біологічну роль; сформувати вміння добувати водень в лабораторних умовах та способами його збирання; розвивати логічне мислення, вміння працювати з текстом, виступати перед аудиторією; виховувати культуру поведінки та спілкування, акуратного ставлення до лаборатоного обладнання.
Очікувані результати: учні розуміють різницю між поняттями «Гідроген» і «водень»; називають поширеність і значення Гідрогену; називають вченого, який відкрив водень; знають основні методи добування водню в лабораторії та вказують основні фізичні властивості, які є ключовими при виборі способу його збирання; розуміють економічну і екологічну цінність водню як природнього палива.
Реалізація НЛ: громадянська відповідальність, екологічна безпека і сталий розвиток, підприємливість і фінансова грамотність, здоров'я і безпека.
Тип уроку: вивчення нового матеріалу
Хід уроку
І. Організаційний етап
Привітання, налаштування на робочий лад
ІІ. Актуалізація опорних знань
Бесіда (спрямована на повторення будови періодичної системи, класифікацію хімічних елементів)
Орієнтовні питання:
1. Скільки груп і періодів містить короткоперіодичний варіант ПСХЕ? Довгоперіодичний?
2. Що зазначається в кожній комірці ПСХЕ?
3. Як класифікують всі хімічні елементи?
4. До яких елементів (металічних чи неметалічних) належить перший елемент ПСХЕ?
ІІІ. Мотивація навчальної діяльності
Діти розгадують ребус(Гідроген)



![]()

![]()
![]() 1=І
1=І
ІV.Вивчення нового матеріалу
1. Положення Гідрогену в ПСХЕ( Періодична система хімічних елементів)
*Робота учнів з ПСХЕ
2. Поширеність і колообіг Гідрогену в природі. Біологічна роль Гідрогену
* Робота учнів з текстом
Поширеність у природі
а) Гідроген – основний елемент Космосу (92% усіх атомів)
Сонце складається на 75 % з Гідрогену,
Юпітер — на 80 %,
Сатурн — на 60 %.
б) На Землі Гідроген зустрічається переважно в зв’язаному стані. Входить до складу молекул води, органічних речовин. Вміст Гідрогену у земній корі і гідросфері дорівнює 1 %
У вільному стані, як водень, входить до складу природних газів.
Колообіг Гідрогену
Джерелами надходження Гідрогену в повітряну оболонку Землі є Світовий океан, кратери вулканів, деякі фотохімічні реакції в атмосфері. Через свою легкість водень з атмосфери Землі потрапляє в космічний простір. Але його кількість на Землі не зменшується, тому що ядра Гідрогену
«сонячного вітру» (Під час термоядерних процесів на Сонці з Гідрогену утворюються інші хімічні елементи та протони Н+, які викидаються в навколосонячний простір у вигляді так званого сонячного вітру.) досягнувши Землі, реагують з киснем атмосфери і випадають звичайним дощем.
Біологічна роль Гідрогену
Гідроген входить до складу всих живих організмів. Атоми Гідрогену беруть участь в утворенні водневого зв’язку. Саме водневий зв’язок в живих організмах сприяє:
- утворенню вторинної структури білка;
- забезпечує точне копіювання молекули ДНК;
- розчинення різних речовин у воді.
- Гідроген у складі води бере участь у переміщенні речовин у живому організмі (рух крові, лімфи), у забезпеченні організму киснем.
Робота з презентацією+розповідь вчителя:
3. Проста речовина Гідрогену. Відкриття водню(+доповідь учня)
 Н2
Н2
Виділення горючого газу при взаємодії кислот та металів спостерігали у XVI та XVII століттях на початку становлення хімії як науки, такі вчені як наприклад Парацельс чи Роберт Бойль. У своїй дисертації «О металлическом блеске» Михайло Ломоносов описав отримання водню в результаті дії кислот на залізо та інші метали, і першим (1745) висунув гіпотезу про те, що водень являє собою флогістон. 1766 року і відомий англійський фізик та хімік Генрі Кавендіш, який докладним чином вивчив властивості водню, висунув подібну ж гіпотезу. Досліджуючи як при спаленні водень давав воду він називав його «горючим повітрям», отриманим з «металів», і вважав, як і всі флогістики, що при розчиненні в кислотах метал втрачає свій флогістон. І тому дотримання Кавендішом теорії флогістону і завадило йому зробити правильні висновки. Французький хімік Антуан Лавуазьє разом із інженером Жаном Меньє, використовуючи спеціальні газометри, у 1783 році здійснили синтез води, а згодом її аналіз, розклавши водяну пару розжареним залізом. Таким чином вони встановили, що водень входить до складу води (H2O) та може бути отриманий із неї. Ізотопи водню було відкрито в 30-x роках XX століття й вони швидко набули великого значення в науці й техніці. Наприкінці 1931 Юрі Брекуедд і Мерфі досліджували залишок після тривалого випарювання рідкого водню і виявили в ньому важкий водень 2Н з атомною масою 2. Цей ізотоп назвали дейтерієм (Deuterium, D) від грец. — другий. Через чотири роки у воді, підданій тривалому електролізу, було виявлено ще важчий ізотоп водню 3Н, який назвали тритієм (Tritium, Т), від грец. — Третій.
4. Фізичні властивості водню(Доповідь учня)
Водень — найлегший газ, він легший за повітря в 14,5 разів. Тому, наприклад, мильні бульбашки, наповнені воднем, у повітрі здіймаються вгору. Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим самим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря.
Молекула водню складається з двох атомів Гідрогену — Н2. За нормальних умов, водень — це газ без кольору, запаху й смаку з густиною0,08987 г/л (н.у.), температурою кипіння −252,76 °C, теплота згорянна 120,9 Дж/кг. Водень малорозчинний у воді — 18,8 мл/л. Але він добре розчиняється у багатьох металах (Ni, Pt, Pd тощо), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний у сріблі.
Рідкий водень існує в дуже вузькому інтервалі температур від −252,76 до −259,2 °C. Це безбарвна рідина, дуже легка (густина при −253 °C — 0,0708 г/см³) й текуча (в'язкість при −253 °C — 13,8 пуаз). Критичні параметри водню дуже низькі: температура −240,2 °C і тиск 12,8 атм. Цим пояснюються труднощі при зрідженні водню.
Твердий водень має температуру плавлення −259,2 °C, густину 0,0807 г/см³ (при −262 °C) — білосніжна маса. У 1935 році Уінгер і Хунтінгтон висловили припущення про те, що при тиску понад 250 тисяч атм водень може перейти в металевий стан. Отримання цієї речовини в стійкому стані відкривало дуже привабливі перспективи його застосування — адже це був би надлегкий метал, компонент легкого і енергомісткого ракетного палива. 2014 року було встановлено, що за тиску порядку 1,5-2,0 млн атм водень починає поглинати інфрачервоне випромінювання, а це означає, що електронні оболонки молекул водню поляризуються. Можливо, за вищого тиску водень перетвориться в мет
5. Добування і збирання водню
Розповідь вчителя: Рідкий і твердий водень одержати в земних умовах дуже важко, але для інших планет це цілком звичайний його стан. Так, під атмосферою гіганта Сонячної системи — планети Юпітер є океан рідкого водню завглибшки тисячі кілометрів, а під ним — оболонка з твердого водню
Учні конспектують :
Добування водню
І. В лабораторії.
Для добування водню в лабораторії використовують апарат Кіппа. (Демонстрація)

- Взаємодія металів (переважно Zn чи Fe) з кислотами (НСl чи Н2SO4)
Zn + 2НСl → ZnCl2 + H2↑
- Взаємодія лужних чи лужноземельних металів з водою.
2Na +2H2O →2NaOH + H2↑
- Електроліз води.
2Н2О → 2H2↑ + О2
ІІ. В промисловості. (Для ознайомлення)
У промисловості водень добувають кількома способами.
- Конверсія (перетворення) метану з водяною парою:
t, Ni
СН4 + 2Н2О = СО2 + 4Н2
- Конверсія вуглецю.
С + Н2О = СО + Н2
- Розклад метану
СН4 → С + 2Н2
- Глибоке охолодження коксового газу.
Способи збирання водню:
-
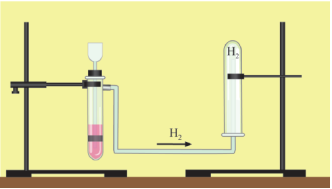 Витіснення повітря, оскільки легший за повітря (перегляд відеофільму)
Витіснення повітря, оскільки легший за повітря (перегляд відеофільму)
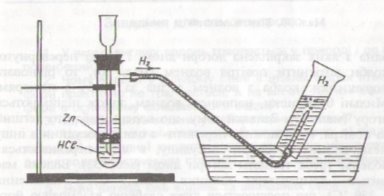
2.Витіснення води, оскільки водень малорозчинний у воді (перегляд відеофільму)
Виконання практичної роботи №2 « Добування водню та його горіння». Інструктаж з БЖД. (Виходячи з матеріальної бази – використовується віртуальна лабораторія)
6. Водень – гримучий газ. Водень – екологічно чисте паливо (Доповідь учнів).
Кисень при змішуванні з воднем утворюють так званий гримучий газ - вибухонебезпечну суміш. Коли ті ж самі атоми кисню і водню об'єднуються в одну молекулу, вони утворюють воду - найважливішу, необхідну для життя речовину.
Вже сьогодні більшість автомобільних компаній представили прототипи автомобілів на паливних елементах з ТПЕ і ведуть інтенсивні розробки в даній області. А нині запущена програма з дослідної експлуатації 40 автомобілів на водневих паливних елементах в різних містах США.
У США починаючи з 2003 року виділяються кошти в розмірі 1,2 млрд. доларів за президентською програмою переходу до водневої енергетики .
Крім транспорту областю застосування паливних елементів може стати децентралізоване енергопостачання . За оцінками, у Німеччині до 2010 р. частка паливних елементів в опаленні та електропостачанні складе 10-30%. Енергоустановки на їх основі електричною потужністю 1,5 кВт і тепловою потужністю 2,9 кВт будуть використовуватися в котеджах і багатоквартирних будинках.
Паливні елементи з ТПЕ знаходять своє застосування і в більш спеціалізованих областях. Наприклад, їх використання в якості енергоустановок може зробити підводні човни безшумними і звести до мінімуму теплові викиди. У космосі паливні елементи використовують з 1960 -х р.р. Для забезпечення споживачів воднем в найближчі роки необхідно створити водневу інфра- структуру (мережа водневих заправних станцій для автомобілів на паливних елементах і т.п.). При реалізації цього завдання незамінні електролізери води з ТПЕ .
Основна перешкода для комерціалізації паливних елементів і електролізерів з ТПЕ полягає у використанні електрокаталізатори на основі платини. Використання даного металу призводить до ряду значних проблем, що обмежують застосування паливних елементів
V. Узагальнення і систематизація знань
*Вправа «Сторінка зі щоденника»
Учням пропонується відновити сторінку зі щоденника швейцарського алхіміка Парацельса, котрий жив і працював в Італії. Відкрив свого часу водень.
VІ. Підсумки уроку
VII.Домашнє завдання
Підібрати загадки про водень
Знайти цікаві факти про сірку
Підготувати доповідь «Знаходження сірки в природі»


про публікацію авторської розробки
Додати розробку
