Якісні та кількісні дослідження води
Хімічні дослідження води
Для дослідження використовувались три зразки води:
І. Кремнієва вода
ІІ. Магнітна вода
ІІІ. Відстояна вода.
В даних хімічних дослідженнях використовувались наступні методики:
- Дослідження запаху води
- Дослідження смаку води
- Загальна жорсткість води
- Дослідження pH розчину
- Дослідження на окислюваність
- Визначення наявності хлоридів
- Визначення наявності сульфатів
- Визначення залізу у воді
Дослід №1
«Запах води»
Запахи води за характером поділяються на запахи природного та штучного походження.
Причиною появи запахів природного походження є хімічний склад домішок води, мікроорганізмами, що живуть у водоймі тощо. Ці запахи характеризують описово.
Запахи штучного походження зумовлені деякими домішками стічних вод, які трапляються у водоймі. Ці запахи називають відповідно до назви речовини зі схожим запахом : фенольний, хлорфенольний, нафтовий, смолистий тощо.
Запах води визначається органолептично, інтенсивність його оцінюється показником розведення (ПР) проби води до повного зникнення запаху. За діючими нормами вода вважається придатною до пиття, якщо при розведенні проби дистильованою водою у два рази (ПР – 2) запах повність зникає.
Методика визначення запаху
Широкогорлу колбу, місткістю 300см3 на 2/3 заповнюють досліджуваною водою, накривають годинниковим склом, струшують обертовими рухами, знімають годинникове скло та втягують носом повітря колби. Дослід проводять при температурі 20-60 0С. Визначають якісну характеристику запаху.
Результати досліджень
Таблиця1-
|
Номер зразка |
Запах |
|
І. Кремнієва |
Приємний |
|
ІІ. Магнітна |
Тванистий |
|
ІІІ. Відстояна |
Мулистий |
Дослід №2
«Смак води»
Смак води зумовлений присутністю в ній речовин природного походження чи домішок, що попадають у воду внаслідок забруднення її стічними водами.
Розрізняють чотири види смаку води:солоний, гіркий, кислий та солодкий. Інші смакові відчуття називають присмаками, наприклад, лужний, металевий, рибний тощо.
Солоний смак звичайно спричиняються наявністю хлориду натрію, гіркий – сульфат магнію. Кислий смак підземних вод зумовлений присутністю вуглекислого газу. Оксиди заліза ІІ та марганцю надають залізистого або чорнильного запаху, встановлюють за показником розведення. У відповідності ДержСанПіН України для смаку питної води встановлено показник розведення 2.
Методика визначення смаку
Смак води визначають органолептично: 10…15 см3 води, підігрітої до 30 0С, кілька секунд утримують у роті, визначаючи якісну характеристику смаку і оцінюючи його інтенсивність.
При оцінці смаку рекомендована така шкала:
- Надзвичайно неприємний.
- Дуже неприємний.
- Неприємний.
- Злегка неприємний.
- Не приємний.
- Злегка приємний.
- Приємний.
- Дуже приємний.
- Надзвичайно приємний.
Результати досліджень
Таблиця 2 -
|
Номер зразка |
Смак |
|
І. Кремнієва |
Дуже слабкий, злегка приємний |
|
ІІ. Магнітна |
Злегка неприємний |
|
ІІІ. Відстояна |
Злегка приємний |
Дослід №3
«Жорсткість води»
Жорсткість природної води зумовлена наявністю в ній йонів кальцію та магнію. В природних умовах солі надходять у воду внаслідок взаємодії розчиненого у ній діоксиду вуглецю СО2 з карбонатними мінералами (доломітами, вапняками) і хімічного вивітрювання та розчинення гірських порід. Джерелом кальцію та магнію є також стічні води силікатної, металургійної та хімічної промисловості, поверхневий стік із сільськогосподарських угідь , які оброблялись мінеральними добривами.
Жорсткість води може бути тимчасовою і постійною. Тимчасову жорсткість викликають солі Ca(HCO3)2 та Mg(HCO3)2. Постійну жорсткість: CaSO4, MgSO4, CaCl2, MgCl2.
Солі тимчасової і постійної жорсткості складають загальну жорсткість води, яка визначається за формулою, мекв/л:
Жзаг =![]() ,
,
Де [Ca2+] – концентрація Са2+мг; [Mg2+] – концентрація Mg2+мг;20,04 та 12,16 – відповідно еквіваленти кальцію та магнію.
Визначення загальної жорсткості тригонометричним методом базується на здатності органічної сполуки трилону Б, яка уявляє содою кислу натрієву сіль етилендіамін оцтової кислоти ( умовне позначення Na2H2T), утворювати стійкі сполуки з кальцієм та магнієм за рівнянням:
Na2H2T + Са2+ = Na2CaT + 2Н+
Na2H2T + Mg2+ = Na2MgT + 2Н+
Визначення жорсткості води проводиться титруванням проби води розчином трилону Б у присутності індикатора хром-темно-синього, який забарвлює пробу у винно- червоний колір.
За відсутності йонів кальцію та магнію при одному й тому ж значенню рН розчину індикатор забарвлює воду у синій колір. При титруванні відбувається зміна кольору розчину у еквівалентній точці, що відповідає сполученню трилону Б з йонами кальцію і магнію. Значення рН при титруванні не повинно змінюватись, через це до води, що аналізують, додають буферний розчин, що не змінює рН при розбавленні водою або при додаванні невеликої кількості кислоти чи основ. Трилоном Б модна визначити загальну жорсткість води в природних водах.
Методика визначення жорсткості
У конічну колбу відміряти за допомогою циліндра 50мл води, яку будуть досліджувати, додати з бюретки 5мл буферного розчину і 4-5 капель індикатора хром-темно-синього, що забарвлює пробу у винно-червоний колір.
Вміст колби повільно титрувати розчином трилону Б, постійно перемішуючи , до забарвлення розчину у синій колір. Загальна жорсткість визначається за формулою, мекв/л:
Жзаг = ![]()
Де 0,05 – нормальність розчину трилону Б; а – об’єм розчину трилону Б, що пішов на титрування води, мл; V – об’єм води, що взяли для визначення жорсткості, мл.
Результати досліджень
І. Кремнієва вода
V1 = 2,6 мл;
V2 = 2,4 мл; Ж заг = ![]() = 2,5 мекв/л;
= 2,5 мекв/л;
V3 = 2,5 мл;
Vсер = 2,5 мл.
ІІ. Магнітна вода
V1 = 1,7 мл;
V2 = 1,9 мл; Ж заг = ![]() = 1,8 мекв/л;
= 1,8 мекв/л;
V3 = 1,8 мл;
Vсер = 1,8 мл.
ІІІ. Відстояна вода
V1 = 2,4 мл;
V2 = 2,1 мл; Ж заг = ![]() = 2,26 мекв/л;
= 2,26 мекв/л;
V3 = 2,3 мл;
Vсер = 2,26 мл.
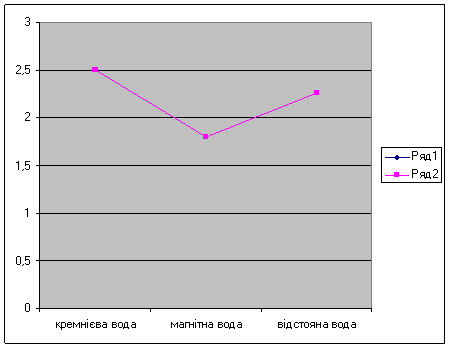
Рис 1. Жорсткість води
Дослід №4
«Водневий показник рН»
В пробірку наливають 5 мл досліджуваної води 0,1мл універсального індикатора, перемішують та за кольором оцінюють величину рН.
Рожево-помаранчева - рН~5
Світло-жовта - рН~6
Світло – зелена - рН~7
Зеленувато – блакитний рН~8
Результати досліджень
Таблиця 3-
|
Номер зразка |
Показник рН |
|
І. Кремнієва |
6 |
|
ІІ. Магнітна |
7 |
|
ІІІ. Відстояна |
4 |
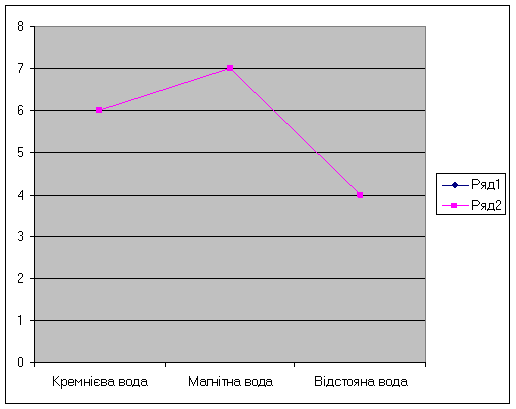
Рис 2. Водневий показник рН
Дослід №5
«Визначення окислюваності води (якісне з приближеною кількісною оцінкою)
До 5 мл досліджуваної води прилити в пробірку, додати 0,3 мл розчину H2SO4 (1:3) та 0,5 мл 0,01 н розчину перманганату калію. Суміш перемішати та залишити на 20 хвилин. За кольором визначити величину окислюваності за таблицею 3.
Таблиця 4 -
Окислюваність води (якісне з приближеною кількісною оцінкою)
|
Колір проби води |
Окислюваність, мг/л |
|
Яскраво лілово-рожева |
1 |
|
Лілово-рожева |
2 |
|
Слабо лілово-рожева |
4 |
|
Блідо лілово-рожева |
6 |
|
Блідо рожева |
8 |
|
Рожево-жовта |
12 |
|
Жовта |
16 |
Результати досліджень
Таблиця 5 -
|
Номер зразка |
Колір проби води |
Окислюваність, мг/л |
|
І. Кремнієва |
Блідо рожева |
8 |
|
ІІ. Магнітна |
Слабо лілово-рожева |
4 |
|
ІІІ. Відстояна |
Яскраво лілово-рожева |
1 |
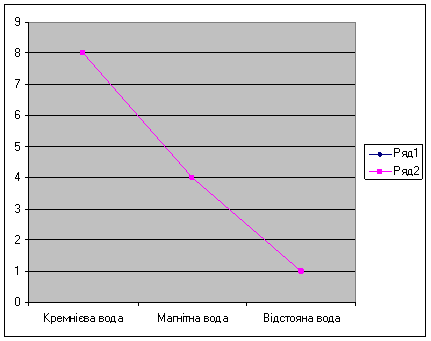
Рис 3. Окислюваність води
Дослід №6
«Визначення хлоридів»
Спочатку проводимо якісну оцінку складу зразків провести якісну оцінку їх складу. Для цього в 5 см3 аналізуємої води додають 3 краплі 10% розчину AgNO3 и перемішують.
Про наявність хлоридів свідчить інтенсивність помутніння проби (таблиця 1).
В залежності від вмісту хлоридів обирають методику аналізу і об’єму аналізуємої проби.( таблиця 1).
Таблиця 6 -
Якісна оцінка складу хлоридів в воді та рекомендуємий для тестування об’єм проби води.
|
Характер помутніння проби |
Орієнтовний вміст хлоридів у воді (мг/дм3) |
Об’єм аналізуємої проби (см3) |
|
Слабке помутніння |
1-10 |
100 |
|
Сильне помутніння |
10-50 |
100 |
|
Плаваючі часточки |
50-100 |
100 |
|
Часточки, які випали в осад |
100-250 |
100 |
|
Білий обємний осад |
250-800 |
50 |
|
|
більше 800 |
25 |
Методика визначення
Визначення засновано на утворенні важко розчинного осаду хлорида срібла. Після повного осадження хлоридів анадлинок йонів срібла реагують з індикатором - хроматом калію з утворенням червоно-помаранчевого осаду. хромату срібла.Тестування проводять в нейтральній або слабо – лужному середовищі (рН 7-10),так як в кислому середовищі не утворюється хромат срібла, а в сильно лужному можливе утворення оскису срібла Ag2О.
Результати досліджень
Таблиця7 -
|
Номер зразка |
Характер помітніння проби |
Орієнтовний вміст хлоридів у воді (мг/дм3) |
|
І. Кремнієва |
Слабке помутніння |
1-10 |
|
ІІ. Магнітна |
Сильне помутніння |
10-50 |
|
ІІІ. Відстояна |
Сильне помутніння |
10-50 |
Дослід №7
«Визначення сульфатів»
Методика комплексометричного аналізу
Метод заснований на осадженні йонів SO42- хлоридом барію.
BaCl2 + H2SO4 = BaSO4↓ + 2 HCl
Осад сульфату барію розчиняють в титрованому розчині трилону Б, залишок якого визначають титруванням розчином хлориду магнію.
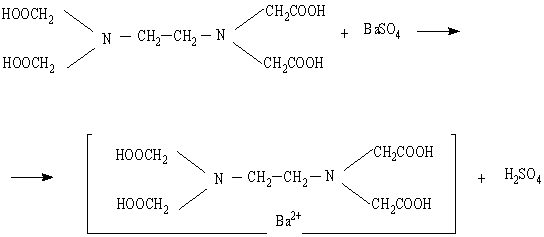
Кількість трилону Б , витраченого на розчинення сульфату барію еквівалентного кількості сульфат– іонів у взятому об’ємі води. Точність методу ± 2,0 мг/дм3 SO42-.
Оптимальні інтервали концентрацій для комплексно-метричного визначення сульфат – іонів находяться у межах 5–25мг.
Засоби вимірної техніки, дослідницьке і допоміжне обладнання, матеріали і реактиви:
1. Баня водяна.
2. Електроплитка.
3. Посуд мірна лабораторна скляна по ГОСТ 1770 – 74 і ГОСТ 20292 – 74, місткістю 50, 100, 250, 500, 1000 см3.
4. Бюретки місткістю 25 см3 з краном.
5. Воронки скляні по ГОСТ 25336 – 82.
6. Фільтри беззольні паперові „синя стрічка".
7. Хлорид барію по ГОСТ 4108 – 72.
8. Хлорид магнію по ГОСТ 4209 – 77.
9. Трилон Б по ГОСТ 10652 – 73.
10. Сульфат магнію фіксонал по ГОСТ 4523 – 77.
11. Хлорид амонію по ГОСТ 3773 – 72.
12. Аміак по ГОСТ 3760 – 79.
13. Хлорид натрію по ГОСТ 4233 – 77.
14. Цинк металічний.
15. Кислота соляна по ГОСТ 3188 – 77.
16. Хромоген чорний ЕТ – 00.
17. Спирт етиловий ректифікований по ГОСТ 5962 – 67.
Підготовка до аналізу
Всі реактиви готують на двічі перегінній дистильованій воді в скляному приладі ( вода не повинна мати у своєму складі міді ).
Хід визначення
100см3 досліджуємої води (при необхідності концентрують або розбавляють) поміщають в конічну колбу ємністю 250 см3. В цій же колбі, якщо необхідно, випаровуванням ( не досягає кипіння ) підкисленого розчину концентрують SO42-, підливаючи по мірі випаровування нову порцію досліджуваної води.Розчин підкислюють трьома краплинами концентрованої соляної кислоти ( до кислої реакції ), додають 25,00 см 3 з молярною концентрацією еквівалентів 0,05 моль/л розчину хлориду барію, нагрівають до кипіння, кип’ятять 10 хвилин від початку кипіння і залишають на водяній бані біля 1 години.
Через 1 годину розчин фільтрують звичайним способом крізь невеликий беззольний фільтр „синя стрічка", попередньо промитий гарячою дистильованою водою. Фільтрування проводять, по можливості, не переміщаючи осад сульфату барію на фільтр. Колбу с осадом промивають 5 – 6 разів помірно гарячою водою ( 40 – 50 0 С ), не зчищаючи приставшого до стінок колби осаду, пропускають промивні води через той же фільтр. Фільтр с частиною потрапившого на нього осаду BaSO4 промивають 2 – 3 рази водою до негативної реакції на Cl-. Коли вода стече, осад поміщають у ту ж колбу, в якій проводилось осадження. Приливають 5 см3 розчину аміаку з молярною концентрацією еквівалентів 9 моль/л, фільтр обережно розгортають скляною паличкою і розправляють по дну колби. Потім приливають 6см3 розчину трилону Б з молярною концентрацією еквівалентів 0,05 моль/л на кожні 5 мг припустимого вмісту сульфат – іонів у взятому для визначення об’ємі дослідж. води.
Склад сульфат – іонів може бути приблизно визначено по попередньо проведеній якісній реакції.
Вміст колби обережно нагрівають на пісчаній бані до кипіння і кип’ятять до розчинення осаду ( 3 – 5 хвилин ), тримаючи колбу під нахилом, періодично перемішують рідину.
Розчин охолоджують, приливають 50 см 3 дистильованої води, 5 см 3 аміачного буферного розчину і додають суху суміш індикатора ~ 0,1 г ( або додають 5 крапель спиртового розчину індикатора ). Залишок трилону Б титрують розчином хлориду магнію до переходу забарвлення з синього у лілове.
1 см 3, з молярною концентрацією еквівалентів 0,05 моль/л, розчину трилону Б містить 2,4 мг SO42-.
Вміст сульфатів ( Х ), мг/л, розраховують за формулою:
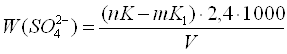 ,
,
де n – кількість доданого розчину трилону Б, см3;
K – поправочний коефіцієнт до нормальності розчину трилону Б;
m – кількість хлориду магнію, витраченого на титрування,см3;
К1 – поправочний коефіцієнт до нормальності розчину хлориду магнію;
V – об’єм досліджуємої води, взятий для визначення, см3;
При вмісті у воді сульфатів SO42- більше 250 мг/дм3 пробу води необхідно розвести водою.
При вмісті сульфатів менше 50 мг/дм 3 необхідно брати для визначення великий об’єм досліджуємої води і концентрувати його.
Припустиме відхилення між повторними визначеннями сульфатів: 3 – 5 мг/дм3, якщо їх вміст не перевищує 25 мг/дм3, 5 – 10 мг/дм3, якщо їх вміст не перевищує 25 – 300 мг/дм 3 при більш високих концентраціях – 3 % відношення.
Результати досліджень
Таблиця 8 -
|
№ |
Vx (досл.зр.), см3 |
VTp Б, см3 |
VMgCl2 (досл.зр.), см3 |
V MgCl2 (хол.), см3 |
W(SO42-) мг/дм3 |
|
І. Кремнієва вода |
100,00 |
6,00 |
0,3200 |
0,2 |
136,32 |
|
ІІ. Магнітна вода |
100,00 |
6,00 |
0,2900 |
137,04 |
|
|
ІІІ. Відстояна вода |
100,00 |
6,00 |
0,2700 |
137,52 |
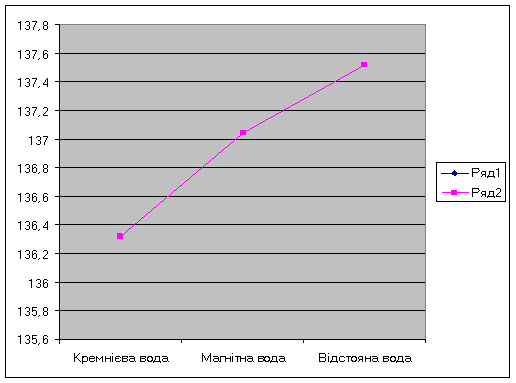
Рис 4. Вміст сульфатів у воді
Дослід №8
«Приблизне визначення йонів Fe3+»
Зафарбовування, видиме при розгляданні пробірки згори до низу на білому фонію
Таблиця 9 -
Приблизний вміст заліза (ІІІ)
|
Колір розчину |
Кількість, мг/л |
|
Відсутність |
Менше 0,05 |
|
Ледве помітний жовто-рожевий колір |
Від 0,05 – 0,1 |
|
Слабий жовто-рожевий колір |
Від 0,1 – 0,5 |
|
Жовто-рожевий |
Від 0,5 - 1,0 |
|
Жовто-червоний |
Від 1,0 – 2,5 |
|
Яскраво червоний |
Більше 2,5 |
Методика проведення
До 10 мл досліджуваної води додають 1 – 2 краплі HCl та 0,2 мл (4 краплі) 50% - го розчину KSCN. Перемішують та спостерігають за розвитком кольору. Приблизний вміст заліза знаходять за таблицею. Метод чуттєвий, можна визначити до 0,02 мг/л.
Fe3+ + 3NSC- = Fe(NSC)3
Результати досліджень
Таблиця 10 -
|
Номер зразка |
Колір розчину |
Кількість, мг/л |
|
І. Кремнієва |
Ледве помітний жовто-рожевий колір |
Від 0,05 – 0,1 |
|
ІІ. Магнітна |
Ледве помітний жовто-рожевий колір |
Від 0,05 – 0,1 |
|
ІІІ. Відстояна |
Ледве помітний жовто-рожевий колір |
Від 0,05 – 0,1 |


про публікацію авторської розробки
Додати розробку
