Презентація "Магній як один із основних елементів світу"
Про матеріал
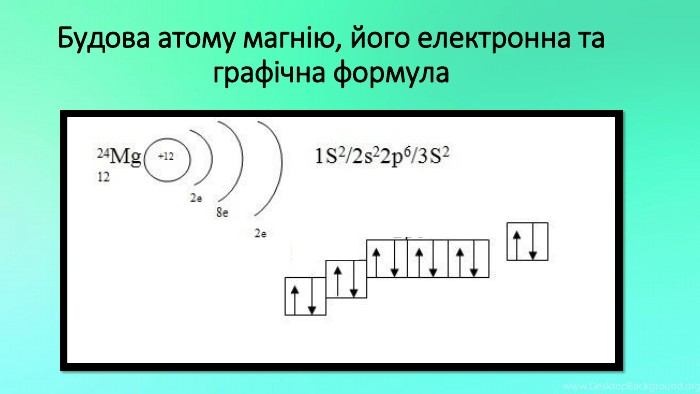
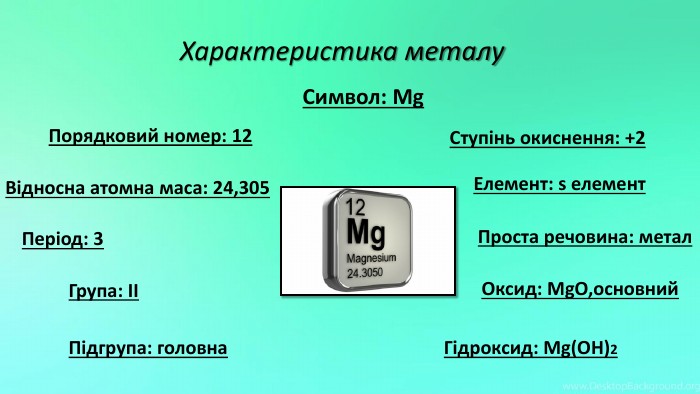
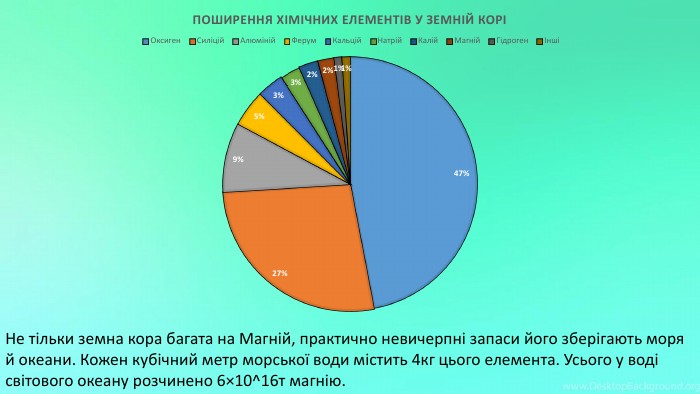
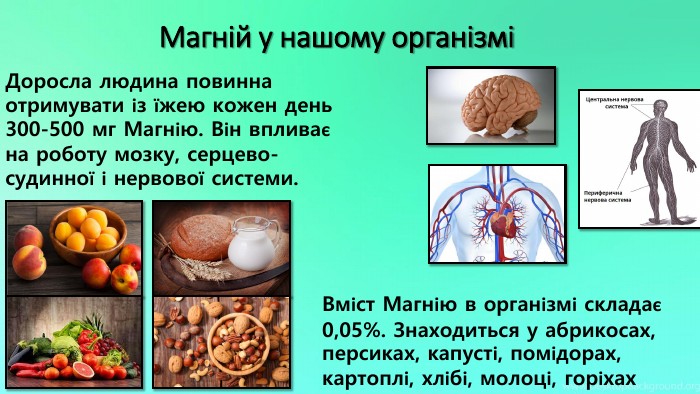
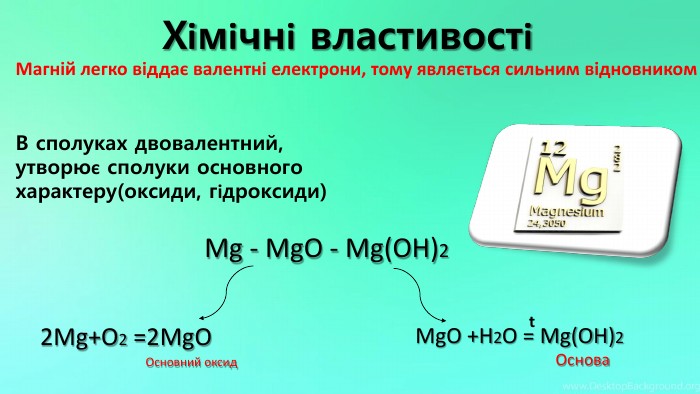
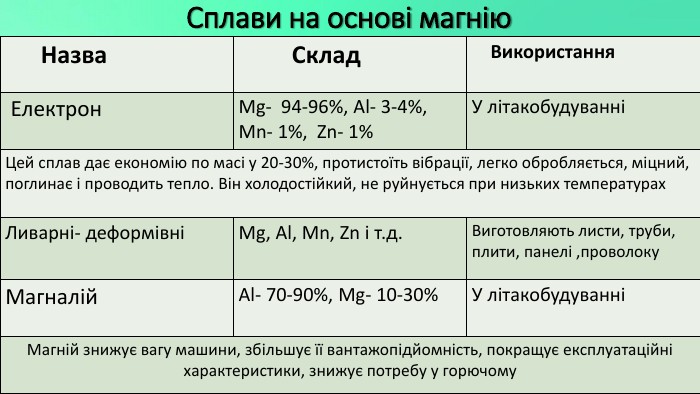
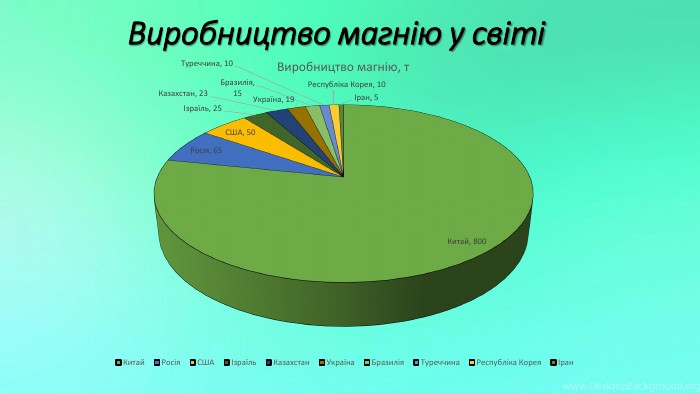
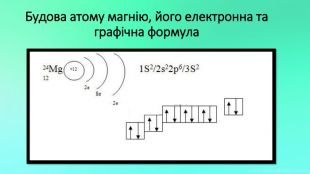
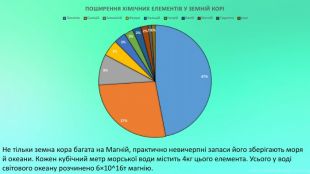
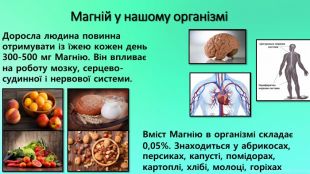
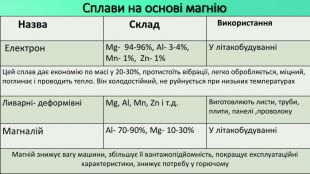
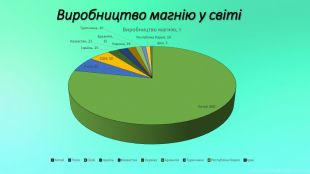
Mg - прекрасно відомий усім нам метал, проте деякі його фізичні та хімічні властивості ми залишаємо поза увагою. Тож є всі підстави для більш повного відобьраження їх у проєкті "Магній як один із основних елементів світу". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку