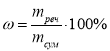Закон збереження маси речовини. Сталість складу речовини. Закон об’ємних відношень. Закон Авогадро та наслідки з нього. Розрахунки за цими законами
- закріпити поняття «закон» на прикладі закону збереження маси речовини, закону сталості складу, закону Авогадро, закону об'ємних відношень;
- показати роль учених-хіміків Ж. Пруста, М. Ломоносова, А. Авогадро, Ж. Гей-Люссака в розкритті цих законів як форми наукових знань про природу;
- пояснити їх значення в хімії;виховувати свідоме відношення до процесу навчання, організованості, дисциплінованостіі;
- виховати любов до природи, предмету, повагу до вчених та історії.
11 клас (профільний рівень)
Тема: Закон збереження маси речовини. Сталість складу речовини. Закон об’ємних відношень. Закон Авогадро та наслідки з нього. Розрахунки за цими законами
Мета:
- закріпити поняття «закон» на прикладі закону збереження маси речовини, закону сталості складу, закону Авогадро, закону об’ємних відношень,;
- показати роль учених-хіміків Ж. Пруста, М. Ломоносова, А. Авогадро, Ж. Гей-Люссака в розкритті цих законів як форми наукових знань про природу;
- пояснити їх значення в хімії;
- виховувати свідоме відношення до процесу навчання, організованості, дисциплінованостіі;
- виховати любов до природи, предмету, повагу до вчених та історії.
Тип уроку: узагальнення та повторення вивченого матеріалу.
Обладнання: портрети вчених-хіміків, комп'ютер, проектор, мультимедійна дошка, презентація, картки з завданнями.
Епіграф: «У мене немає ніякого таланту - є лише впертість мула і страшенна допитливість». Альберт Ейнштейн.
Хід уроку
І. Організаційний етап
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій
ІІ. Актуалізація опорних знань
Бесіда
1. Що вам відомо про життя та діяльність М. В. Ломоносова?
2. Який хімічний закон сформулював Ломоносов?
3. Чому змінилося формулювання закону Пруста?
4. Який закон був сформульований А. Авогадро?
ІІІ. Мотивація навчальної діяльності
За допомогою кількісних методів у кінці XVII – на початку XVIII ст. були встановлені основні закони хімії, що зумовило подальший розвиток хімії як точної природничої науки.
IV. Повторення вивченого матеріалу
Закон збереження маси
У 1756 р. М. В. Ломоносов експериментально довів положення про збереження маси речовин, висловлене у вигляді філософської концепції у 1748 р., здійснюючи досліди з прожарювання металів у запаяній реторті.
Незалежно від Ломоносова, закон збереження маси було відкрито і введено в хімію французьким ученим Антуаном Лавуазьє у 1789 р., котрий зробив ще один важливий висновок: під час хімічних реакцій зберігається не тільки загальна маса речовин, а й маса кожного елемента, що входить до складу реагуючих речовин.
Сучасне формулювання закону збереження маси речовин:


Це можна пояснити тим, що у процесі хімічної реакції відбувається тільки перегрупування атомів, але кількість атомів і маса кожного з них залишаються сталими. Якщо ж кількість атомів кожного елемента, а, отже, їх сумарна маса не змінюється, то й маса реагентів повинна дорівнювати масі продуктів.
На підставі закону збереження маси складаються рівняння хімічних реакцій і здійснюються практично важливі розрахунки.
Так, як маса водню і кисню, які вступають у взаємодію, дорівнює масі води, яка утворилась внаслідок реакції.
![]()
36 г = 36 г
Відкриття закону збереження маси дало змогу закріпити кількісні методи досліджень, вивчити кількісний склад багатьох речовин.
Закон сталості складу
Наступним кроком у розвитку хімії було встановлення положення про сталість складу речовин, виведеного французьким ученим Ж. Прустом (1801 р.):


Наприклад, воду можна добути будь-яким з наведених способів:
а) спалюванням водню:
2Н2 + О2 = 2Н2О
б) термічним розкладом деяких основ:
2Fе(ОН)3 = Fе2O3 + 3Н2О
в) за реакцією нейтралізації:
Н2SО4 + 2NaОН = Na2SO4 + 2Н2O
г) термічним розкладом деяких кислот:
Н2SіО3 = SіО2 + Н2О
Співвідношення атомів Гідрогену та Оксигену в молекулі води завжди 2 : 1, а масове співвідношення 2:16 або 1:8 (зважаючи на те, що Ar(H) = 1, а Аr(О) = 16). Масові частки Гідрогену й Оксигену в хімічно чистому зразку води відповідно дорівнюють 11,12 і 88,88 %.
Отже, якщо речовина є індивідуальною хімічною сполукою (без домішок), то її склад сталий і не залежить від способу добування. Відхилення від зазначеного складу свідчить про наявність домішок.
Речовини із сталим складом називаються дальтонідами, із змінним – бертолідами.
Проте зворотне твердження – кожному певному складу відповідає тільки одна хімічна сполука – неправильне.
Наприклад, диметиловий етер СН3–О–СН3 і етанол С2Н5ОН мають однаковий хімічний склад С2Н6О, але є різними хімічними сполуками, що відрізняються одна від одної структурою молекул, тобто порядком сполучення в них атомів. Речовини з однаковим хімічним складом і різною будовою називаються ізомерами.
Склад речовини можна виразити хімічною формулою.
Хімічна формула – це умовний запис складу речовини за допомогою хімічних знаків і індексів.
Виходячи із формул речовин, можна дати їх кількісну характеристику, зокрема, визначити масову частку кожного хімічного елемента у сполуці.
Масова частка (ω) показує, яку частину становить маса даного елемента від всієї маси речовини:
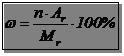
n – кількість атомів елемента у сполуці;
Ar – атомна маса елемента;
Mr – молекулярна маса.
Приклад 1. Розрахувати масові частки кожного із елементів у натрій сульфаті.
|
Д а н о: Na2SO4 |
Р о з в’ я з о к: Масова частка елементів розраховується за формулою:
|
|
В и з н а ч и т и: ω(Na) – ? ω(S) – ? ω(O) – ? |
|
|
Молекулярна маса натрій сульфату становить: Мr(Na2SO4) = 142. Тоді
|
|
|
В і д п о в і д ь: ω(Na) = 32,4%; ω(S) = 22,5%; ω(O) = 45,1%. |
|
Приклад 2. Обчисліть масу хрому в 515 г суміші, яка містить 80% Сr(OН)3.
|
Д а н о: mсуміші = 515 г ω(Сr(OН)3) = 80% |
Р о з в’ я з о к: Масова частка речовини в суміші розраховується за формулою:
Обчислюємо масу Сr(OН)3 в 515 г суміші: |
|
В и з н а ч и т и: m(Cr) – ? |
|
|
m(Сr(OН)3)= mсуміші·ω/100% = 515 г· 80%/100% = 412 г. Мольна маса хром (ІІІ) гідроксиду становить: М(Сr(OН)3) = 103 г/моль Тоді в 103 г Сr(OН)3 міститься 52 г хрому в 412 г Сr(OН)3 міститься х г хрому
|
|
|
В і д п о в і д ь: маса хрому в даній суміші дорівнює 208 г. |
|
Закон об’ємних відношень
Відомо, що маса речовин під час хімічних реакцій зберігається незмінною. На відміну від маси, об’єм реагентів може суттєво змінюватись. Це відбувається тоді, коли в реакції беруть участь газоподібні речовини або утворюються газоподібні продукти реакції.
Вимірюючи об’єми газів, що вступають у реакцію та утворюються внаслідок неї, французький учений Ж. Гей–Люссак у 1808 р. сформулював закон об’ємних відношень, відомий як „хімічний“ закон Гей-Люссака:


При цьому вважається, що всі об’єми газів приведені до однакових температури і тиску. Наприклад, під час синтезу хлороводню з водню і хлору
Н2(г) + Сl2(г) = 2НСl(г)
співвідношення об’ємів газів наступне:
V(Н2) : V(Сl2) : V(НСl) = 1:1:2,
тобто 1 л водню сполучається з 1 л хлору, утворюючи
2 л хлороводню.
Наслідок. Стехіометричні коефіцієнти в рівняннях хімічних реакцій для молекул газоподібних речовин показують, у яких об’ємних співвідношеннях реагують або утворюються газоподібні речовини.
Закон Авогадро
Виявлену Ж. Гей-Люссаком закономірність пояснює закон, відкритий у 1811 р. італійським ученим
Амедео Авогадро.


Заслуга Авогадро полягає в тому, що, поряд з поняттям „атом“ ним було відновлено поняття „молекула“. За Авогадро молекули більшості газів є двоатомними (Н2, N2, O2) але Ne, He – молекули благородних газів є одноатомними.
Із закону Авогадро випливають два важливі наслідки.
Перший наслідок: Один моль будь-якого газу за нормальних умов займає однаковий об’єм.
За нормальних умов (н.у.):
- тиск 1 атм = 760 мм рт.ст. = 101325 Па,
- температура 0°С = 273 К.
об’єм 1 моль будь–якого газу дорівнює 22,4 дм3.
Стала Vm = 22,4 дм3/моль називається молярним об’ємом газу за нормальних умов.
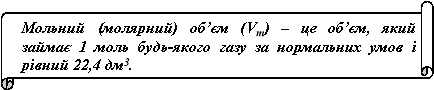

За будь-яких умов молярний об’єм газу – це величина, що дорівнює відношенню об’єму газу за даних умов до кількості речовини цього газу:

де Vm – молярний об’єм газу за даних (будь-яких) умов, м3/моль (л/моль);
V – об’єм газу за даних (будь-яких) умов, м3 (л);
ν – кількість речовини газу, моль.
За стандартних умов (тиск 1 атм. (101325 Па) і температури 298,15 К або 25 °С) молярний об’єм газу дорівнює не 22,4, а 24,4 л/моль.
Молярний об’єм газу Vm можна обчислити також, знаючи молярну масу газу М та його густину.
Молярний об’єм газу – це величина, що дорівнює відношенню молярної маси газу до його густини:
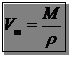
де Vm – молярний об’єм газу, м3/моль (л/моль);
М – молярна маса газу, кг/моль (г/моль);
ρ – густина газу, кг/м3 (г/л).
Приклад 3. Скільки моль міститься в 0,56 м3 хлору за н.у.?
|
Д а н о: V(Cl2) = 0,56 м3 н.у. |
Р о з в’ я з о к:
Кількість речовини визначаємо за формулою Так як мольний об’єм газу звичайно |
|
В и з н а ч и т и: ν(Cl2) – ? |
|
|
виражають в дм3/моль, то об’єм переводять в дм3. 0,56 м3 = 560 дм3
Тоді |
|
|
В і д п о в і д ь: ν(Cl2) = 25 моль. |
|
Приклад 4. Скільки молекул міститься в 56 м3 кисню за н.у.?
|
Д а н о: V(О2) = 56 м3 н.у. |
Р о з в’ я з о к: Для визначення кількості молекул скористаємося формулами:
|
|
В и з н а ч и т и: N(О2) – ? |
|
|
Звідси: Так як мольний об’єм газу звичайно виражають в дм3/моль, то об’єм переводять в дм3. 56 м3 = 56 000 дм3
Тоді |
|
|
В і д п о в і д ь: N(О2) = 1,5·1028 молекул. |
|
Приклад 5. Який об’єм займають за н.у. 4,8·1026 молекул азоту?
|
Д а н о: N(N2) = 4,8·1026 н.у. |
Р о з в’ я з о к: Для визначення об’єму скористаємося формулами:
|
|
В и з н а ч и т и: V(N2) – ? |
|
|
Звідси
Тоді |
|
|
В і д п о в і д ь: V(N2) = 17,92 м3. |
|
Приклад 6. Який об’єм займає 7 г етену С2Н4 за н.у.?
|
Д а н о: m(С2Н4) = 7 г н.у. |
Р о з в’ я з о к: Для визначення об’єму скористаємося формулами:
|
|
В и з н а ч и т и: V(С2Н4) – ? |
|
|
Звідси
Тоді |
|
|
В і д п о в і д ь: V(С2Н4) = 5,6 дм3. |
|
Приклад 7. Визначити масу 280 мл азоту за н.у.
|
Д а н о: V(N2) = 280 мл н.у. |
Р о з в’ я з о к:
Для визначення маси скористаємося формулами:
Звідси |
|
В и з н а ч и т и: m(N2) – ? |
|
|
Так як мольний об’єм газу звичайно виражають в дм3/моль, то об’єм переводять в дм3. 280 мл = 0,28 л = 0,28 дм3
Тоді |
|
|
В і д п о в і д ь: m(N2) = 0,35 г. |
|
Другий наслідок: маса одного і того самого об’єму газу тим більша, чим більша маса його молекул. Якщо в однакових об’ємах газів за однакових умов міститься однакова кількість молекул, то, відношення мас однакових об’ємів газів за однакових умов дорівнює відношенню їхніх молярних мас
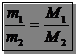
де m1 – маса певного об’єму першого газу;
m2 – маса такого самого об’єму другого газу;
М1 і М2 – молярні маси відповідно першого і другого газів.
Відношення маси певного об’єму одного газу до маси такого самого об’єму іншого газу (взятого за тих самих умов) називається відносною густиною першого газу за другим![]() .
.
Якщо об’єми газів, що порівнюють між собою, одинакові, то відносна густина визначається за формулою:
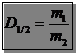
де m1 і m2 – маси однакових об’ємів газів 1 і 2 за однакових температури і тиску.
Відповідно можна записати, що:
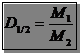
де M1 і M2 – мольні маси газів 1 і 2.
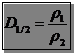
де ρ1 і ρ2 – густини газу 1 та газу 2.
Отже, можна твердити, що густини різних газів, узятих за однакових умов, пропорційні їх молярним масам:
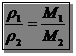
Приклад 8. 800 мл деякого газу мають масу 1200 г, а один літр повітря за таких умов має масу 1,36 г. Визначити мольну масу газу.
|
Д а н о: V1 = 800 мл = 0,8 л m1 = 1200 мг = 1,2 г Vпов = 1 л mпов = 1,36 г |
Р о з в’ я з о к: При розв’язуванні задачі скористаємося формулами:
де ρ2 = ρпов; M2 = Мпов = 29 г/моль Отже, M1 = D1/2·Мпов |
|
В и з н а ч и т и: M1 – ? |
|
|
Тоді |
|
|
В і д п о в і д ь: M1 = 39 г/моль. |
|
Густини різних газів часто визначають відносно водню, як найлегшого з газів, за формулою:

Можна також обчислювати густину досліджуваного газу за киснем (Mr = 32) або за повітрям (середня молекулярна маса повітря дорівнює 29):
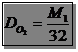 ;
;
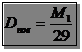
Приклад 9. Густина пари сірки за повітрям дорівнює 8,83. Із скількох атомів складається молекула сірки?
|
Д а н о: Dпов = 8,83 |
Р о з в’ я з о к: При розв’язуванні задачі скористаємося формулою:
|
|
В и з н а ч и т и: Sх – ? |
|
|
Тоді M(S) = Dпов·29 = 8,83·29 = 256 г/моль Якщо молекула сірки має масу 256, а атом сірки – 32, то
Отже, молекула сірки складається з 8 атомів. |
|
|
В і д п о в і д ь: S8. |
|
V. Застосування знань, умінь, навиків
1. Сформулюйте закон збереження маси речовини. Поясніть його суть на прикладі реакції нейтралізації.
2. Сформулюйте закон об’ємних відношень. Поясніть його суть на прикладі синтезу аміаку.
3. Сформулюйте закон сталості складу речовин. Поясніть його суть на прикладі SO2.
4. Що таке відносна густина одного газу за іншим?
5. Як визначається масова частка елементів у сполуках? Поясніть на прикладі K2Cr2O7.
VІ. Підготовка до ЗНО (проходження онлайн тестування)
VІІ. Підбиття підсумків уроку
VІІІ. Домашнє завдання
Опрацювати §51, №2, 8, 13 (Л.П. Величко, Н.М. Буринська).


про публікацію авторської розробки
Додати розробку