Застосування ферментів в медицині та методи визначення їх активності

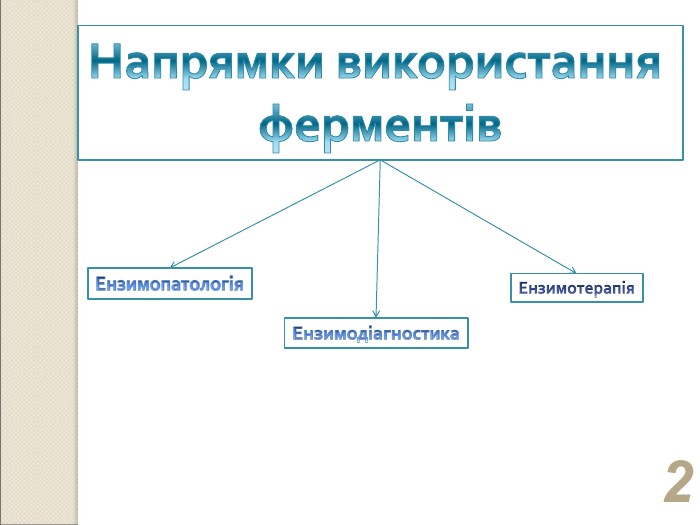













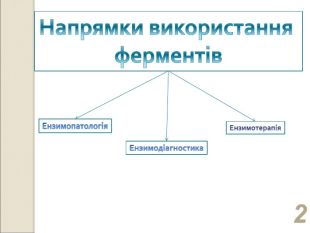
* Ензимопатологія вивчає молекулярні хвороби, причина виникнення яких пов’язана з дефіцитом або повною відсутністю ферментів (ензимопатії). На сьогодні відомо більш ніж 1000 ензимопатій різних видів обміну (фенілкетонурія, альбінізм, гомоцистинурія, глікогенози тощо). Детальне вичення молекулярних причин і наслідків цих захворювань наближає до розроблення ефективних методів діагностики та терапії.
* Біохімічний аналіз крові - лабораторний метод діагностики, який застосовується в клінічній практиці для визначення функціонального стану систем і тканин організму людини. Біохімічний аналіз допомагає виявити порушення функції печінки, нирок, розлад білкового, ліпідного і вуглеводного обміну, діагностувати наявність активного запальної процесу, в тому числі ревматичного, а також різні розлади водно-електролітного обміну і ступінь дисбалансу мікроелементів. Таким чином, проведення біохімічного аналізу крові дозволяє не тільки виявити патологію, але й визначити ступінь гостроти запального процесу, призначити або скорегувати лікування.
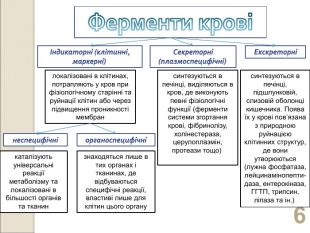
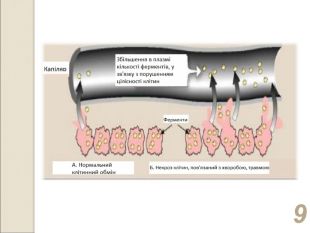
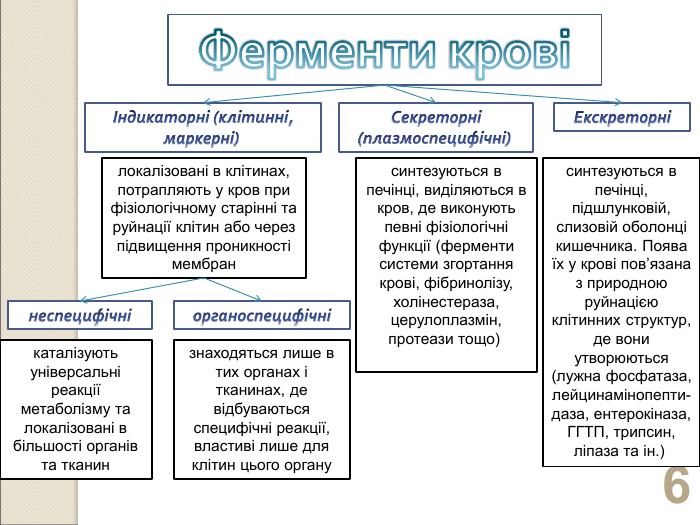
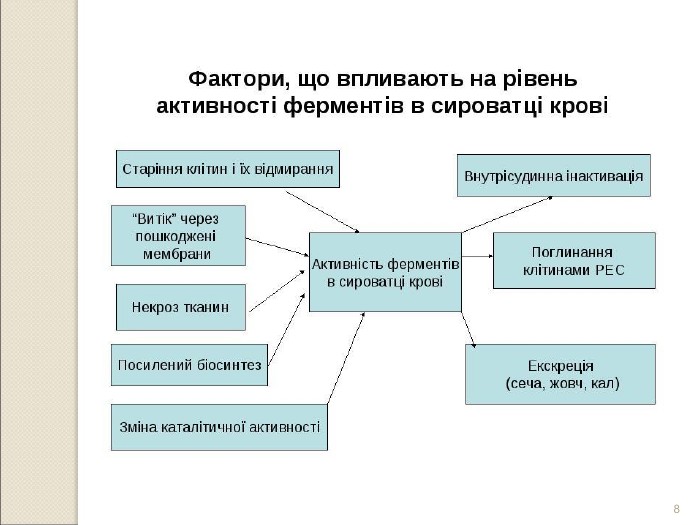
* локалізовані в клітинах, потрапляють у кров при фізіологічному старінні та руйнації клітин або через підвищення проникності мембран синтезуються в печінці, виділяються в кров, де виконують певні фізіологічні функції (ферменти системи згортання крові, фібринолізу, холінестераза, церулоплазмін, протеази тощо) синтезуються в печінці, підшлунковій, слизовій оболонці кишечника. Поява їх у крові пов’язана з природною руйнацією клітинних структур, де вони утворюються (лужна фосфатаза, лейцинамінопепти-даза, ентерокіназа, ГГТП, трипсин, ліпаза та ін.) каталізують універсальні реакції метаболізму та локалізовані в більшості органів та тканин знаходяться лише в тих органах і тканинах, де відбуваються специфічні реакції, властиві лише для клітин цього органу
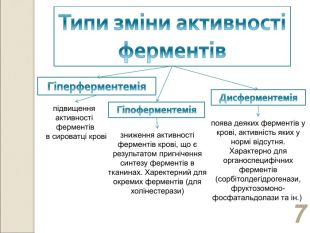
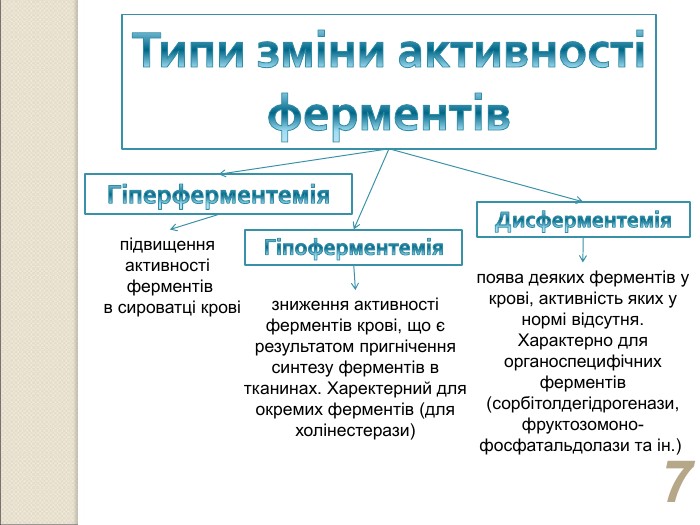
* зниження активності ферментів крові, що є результатом пригнічення синтезу ферментів в тканинах. Харектерний для окремих ферментів (для холінестерази) поява деяких ферментів у крові, активність яких у нормі відсутня. Характерно для органоспецифічних ферментів (сорбітолдегідрогенази, фруктозомоно-фосфатальдолази та ін.) підвищення активності ферментів в сироватці крові
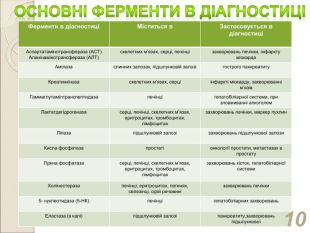
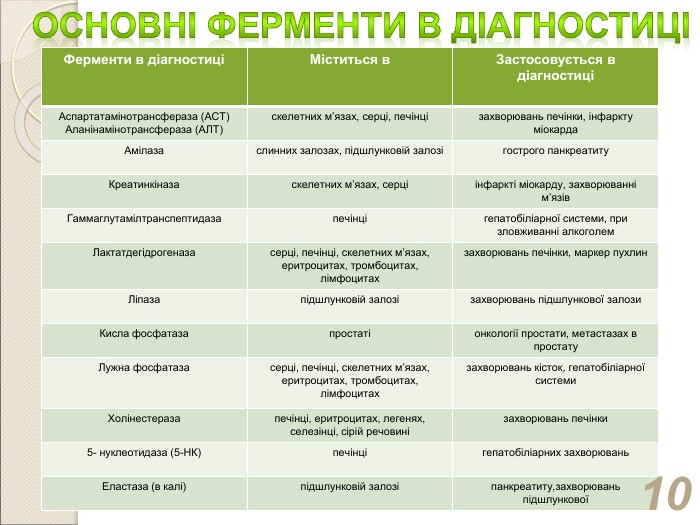
Ферменти в діагностиці Міститься в Застосовується в діагностиці Аспартатамінотрансфераза (АСТ) Аланінамінотрансфераза (АЛТ) скелетних м’язах, серці, печінці захворювань печінки, інфаркту міокарда Амілаза слинних залозах, підшлунковій залозі гострого панкреатиту Креатинкіназа скелетних м’язах, серці інфаркті міокарду, захворюванні м’язів Гаммаглутамілтранспептидаза печінці гепатобіліарної системи, при зловживанні алкоголем Лактатдегідрогеназа серці, печінці, скелетних м’язах, еритроцитах, тромбоцитах, лімфоцитах захворювань печінки, маркер пухлин Ліпаза підшлунковій залозі захворювань підшлункової залози Кисла фосфатаза простаті онкології простати, метастазах в простату Лужна фосфатаза серці, печінці, скелетних м’язах, еритроцитах, тромбоцитах, лімфоцитах захворювань кісток, гепатобіліарної системи Холінестераза печінці, еритроцитах, легенях, селезінці, сірій речовині захворювань печінки 5- нуклеотидаза (5-НК) печінці гепатобіліарних захворювань Еластаза (в калі) підшлунковій залозі панкреатиту,захворювань підшлункової *
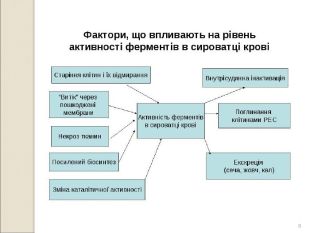
* Основним недоліком визначення активності ферментів плазми в діагностиці є відсутність специфічності до конкретної тканини чи типу клітин. Зміна активності одних і тих же ферментів може спостерігатися при різних захворюваннях. Є кілька варіантів вирішення цієї проблеми: визначення активності кількох ферментів, та їх комплексне порівняння; визначення ізоферментів, які відрізняються деякими властивостями, що характерні для певної тканини (КК м’язева, серцева, мозкова); визначення активності ферментів в динаміці ( баланс між швидкістю появи ферменту в плазмі та видалення з неї). Постійне підвищення активності ферменту свідчить про хронічне захворювання.
* Розвиток технологій, автоматизація технологічної процедури аналізу дозволили значно підвищити точність досліджень і розширити спектр визначених речовин в біологічному матеріалі. Однією з особливостей сучасної лабораторної медицини є велика різноманітність лабораторних тестів і методик їх застосування. Стандартизація, що досягається автоматизацією всієї процедури аналізу, підвищує надійність виконання аналізу, скорочує час на проведення тестування, витрати реагентів і обсяг біологічного матеріалу.
* Існує велика кількість методів вимірювання активності ферментів, що розрізняються по техніці виконання, специфічності, чутливості. Найчастіше для визначення застосовуються фотоелектроколориметричні методи, в основі яких лежать кольорові реакції з одним з продуктів дії ферментів. При цьому інтенсивність забарвлення одержуваних розчинів пропорційна кількості продукту, що утворився. Наприклад, в процесі реакцій, що каталізуються амінотрансферами, накопичуються α-кетокислоти, які дають з 2,4- динітрофенілгідразином комплекс червоно-бурого кольору.
* Спектрофотометричні методи засновані на зміні ультрафіолетового спектра хімічних речовин, які беруть участь у реакції. Більшість сполук поглинає ультрафіолетові промені, причому поглинаються довжини хвиль характерні для присутніх в молекулах цих речовин певних груп атомів. Ферментативні реакції викликають внутрішньомолекулярні перегрупування, в результаті яких змінюється ультрафіолетовий спектр. Ці зміни можна зареєструвати на спектрофотометрі.
* В основі флюориметричних методів лежить явище флюоресценції, яке полягає в тому, що досліджуваний об'єкт під впливом опромінення випромінює світло з коротшою довжиною хвилі. Флюориметричні методи визначення активності ферментів більш чутливі, ніж спектрофотометричні. Порівняно новими і ще більш чутливими є хемілюмінісцентні методи з застосуванням люциферин - люциферазної системи. Такі методи дозволяють визначати швидкість реакцій, що протікають з утворенням АТФ. При взаємодії люциферина (карбонової кислоти складної будови) з АТФ утворюється люцифериладенілат. Це з'єднання окислюється за участю ферменту люциферази, що супроводжується світловим спалахом. Вимірюючи інтенсивність світлових спалахів, вдається визначати кількості АТФ порядку декількох пікомоль.
* Ряд ферментативних реакцій супроводжується зміною рН інкубаційної суміші. Прикладом такого ферменту є ліпаза підшлункової залози. Жирні кислоти, що утворилися внаслідок реакції, яку каталізує ліпаза можуть бути відтитровані (титраметричний метод), причому кількість лугу, витраченого на титрування, буде пропорційною кількості жирних кислот, що виділилися і, отже, активності ліпази.
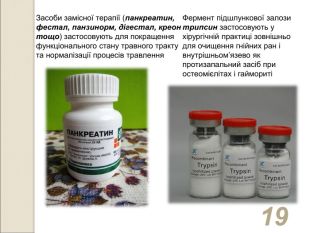
* Засоби замісної терапії (панкреатин, фестал, панзинорм, дігестал, креон тощо) застосовують для покращення функціонального стану травного тракту та нормалізації процесів травлення Фермент підшлункової залози трипсин застосовують у хірургічній практиці зовнішньо для очищення гнійних ран і внутрішньом’язево як протизапальний засіб при остеомієлітах і гаймориті
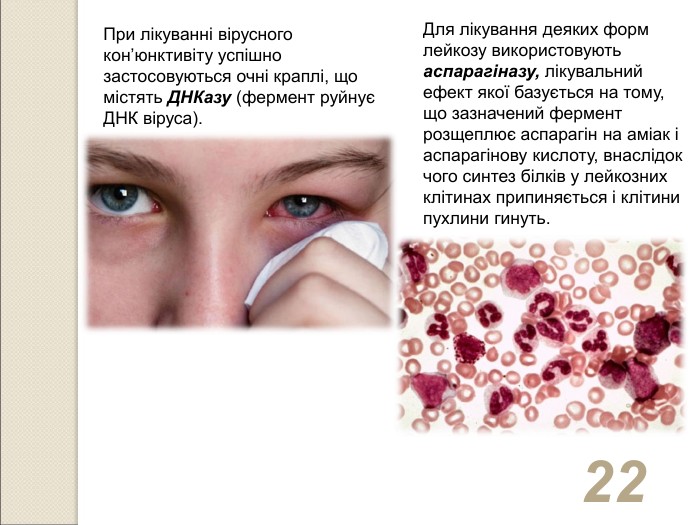
* При лікуванні вірусного кон’юнктивіту успішно застосовуються очні краплі, що містять ДНКазу (фермент руйнує ДНК віруса). Для лікування деяких форм лейкозу використовують аспарагіназу, лікувальний ефект якої базується на тому, що зазначений фермент розщеплює аспарагін на аміак і аспарагінову кислоту, внаслідок чого синтез білків у лейкозних клітинах припиняється і клітини пухлини гинуть.


про публікацію авторської розробки
Додати розробку