Збірка поточного тестового контролю з хімії І курс з теми «Неметалічні елементи»
Гайворонський професійний аграрний ліцей
Збірка поточного тестового контролю з хімії
І курс з теми
«Неметалічні елементи»
м. Гайворон
2017 рік
Збірка поточного тестового контролю І курсу з теми «Неметалічні елементи» + практичні роботи
Автор : Стародуб Інна Анатоліївна
Посада : викладач хімії
Кваліфікаційна категорія : викладач вищої категорії, викладач-методист
Місце роботи : Гайворонський професійний аграрний ліцей
Назва матеріалу : «тестовий контроль»
Обсяг матеріалу :
Рецензент : методист Гайворонського ПАЛ
Анотація
Матеріал посібника відповідає навчальній програмі; його узгоджено з підручником «Хімія. 10 клас» (автори — П. П. Попель, Л. С. Крикля). Матеріали охоплюють тему з неорганічної хімії «Неметалічні елементи» і представлені у двох варіантах, диференційовані за рівнями складності. Є різні види завдань для самостійних та контрольних робіт із використанням основних понять і категорій, схем, формул, запитань, тестів, задач та вправ. Матеріал посібника сприяють кращому закріпленню теоретичних відомостей з курсу хімії учнів І курсу ПТНЗ, а також учнів 10 класів . Також представлені практичні роботи, передбачені чинною програмою.
Матеріали розглянуто схвалені на засіданні методчної комісії природничо – математичного циклу.
Протокол № 3 від - 20.10.2017р
Вступ
Завдання сучасної школи – це виховання компетентної особистості, яка володіє не лише знаннями, високими моральними якостями, високим професіоналізмом, але і уміє застосовувати знання на практиці, бере на себе відповідальність за свою діяльність. Важливу роль в цьому процесі відіграє одна із природничих наук - хімія. Вона вивчає склад, властивоті, будову речовин ,а також процеси перетворення одних речовин в інші. Протягом усього свого розвитку, з давніх-давен і донині, хімія завжди слугувала і продовжує слугувати людині та її практичній діяльності. З кожним роком зростає роль хімії в житті суспільства, та в усіх галузях народного господарства. Хімічна індустрія постачає промисловості й сільському господарству різні матеріали та сировину. Це паливо, мастила, хімічні волокна, пластмаси, синтетичні каучуки, мінеральні добрива, мийні засоби, парфуми, фармацевтичні препарати, луги, кислоти, розчинники, вибухові речовини тощо. Ми переконуємося, що «широко простягає хімія руки свої у справи людські. Куди не подивимось, куди не оглянемось, скрізь обертаються перед очима нашими успіхи ЇЇ старанності». Ці слова великого російського вченого- природодослідника М. В. Ломоносова (1711—1765), висловлені майже 250 років тому, і сьогодні не втратили свого значення. Навпаки, вони звучать з особливою силою, оскільки у наш час роль хімії в житті суспільства постійно зростає.
Проникнення хімічних методів, нових речовин і нових матеріалів у основні галузі промислового виробництва, сферу побуту, охорону здоров'я дедалі більшою мірою забезпечує необхідність в здобуті хімічних знань. І значну роль в реалізації цих завдань по вдосконаленню навчально-виховного процесу, відводиться системі унаочнення. Воно спрямовується на розвиток в учнів уявлення про внутрішню будову речовини, а через неї – про її фізичні та хімічні властивості, та на розвиток абстрактного мислення учнів.
Самостійна робота №1
Неметали та їхні сполуки
Варіант І
1. Формула вищого оксиду елементів підгрупи Оксигену:
А) Е2О3; Б) ЕО2;
В) ЕО3; Г) Е2О5.
2. Амоніак за фізичними властивостями:
А) газ жовтого кольору без запаху, розчинний у воді;
Б) безбарвний газ із різким запахом, розчинний у воді;
В) безбарвний газ без запаху, розчинний у воді.
3. Алотропні видозмінами Сульфуру є сірки:
А) червона й чорна; Б) жовта й коричнева;
В) кристалічна й пластична.
4. Кількість зв’язків між атомами Нітрогену в молекулі азоту:
А) один; Б) два; В) три.
5. Найбільша кількість азоту в природі міститься:
А) у повітрі; Б) у ґрунті; В) у воді.
6. Формула вищого гідроксиду елементів підгрупи Карбону:
А) НЕО3; Б) Н2ЕО3; В) НЕО4; Г) Н2ЕО4.
7. Напишіть формули частинок за їх назвами:
Йон амонію, молекула азоту,атом Нітрогену, йон Гідрогену.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________
8. Які прості речовини утворюють хімічні елементи: Гідроген, Оксиген, Нітроген, Карбон.
____________________________________________________________________________________________________________________________________________________________________________
9. Здійсніть схему перетворень:
SO2 S SO2 SO3 Na2SO4 BaSO4
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
10. Обчисліть об’єм амоніаку (н.у.), який можна одержати в результаті взаємодії амоній хлориду масою 30г з надлишком кальцій гідроксиду, прийнявши, що об’ємна частка виходу амоніаку становить 92%.
________________________________________
________________________________________
________________________________________
________________________________________
________________________________________
________________________________________
________________________________________
Самостійна робота №1
Неметали та їхні сполуки
Варіант ІІ
- Розподіл електронів на зовнішньому рівні атомів елементів підгрупи Оксигену:
А) s2p3d1; Б) s2p4d0; В) s1p3d2.
- Виберіть фізичні властивості азоту:
А) газ; Б) газ без запаху;
В) безбарвний газ без запаху;
Г) безбарвний газ без запаху, не розчинний у воді.
- До фізичних властивостей сульфатної кислоти належать такі:
А) газ; Б) масляниста рідина;
В) відсутність кольору; Г) жовтий колір;
Д) відсутність запаху; Е) слабкий запах.
- Установіть відповідність:
Формула Назва
А) NH3 1) амоній хлорид
Б) NH4OH 2)амоніак
В) NH4Cl 3) амоній гідроксид
- Сірка в природі поширена:
А) лише у вільному стані;
Б) лише у зв’язаному стані;
В) і у вільному, і у зв’язаному стані.
- Характерними ступенями окиснення елементів підгрупи Карбону є:
А) +4, +2, -4; Б) +3, +5, -1, -2, -3;
В) +4, +5, -3.
- Напишіть формули частинок за їх назвами:
Йон Оксигену, молекула амоніаку,атом Гідрогену, йон амонію.
________________________________________________________________________________________________________________________________________________________________________________________________________
- Які хімічні елементи утворили прості речовини: графіт, озон, азот, водень.
________________________________________________________________________________________________________________________________________________________________
- Здійсніть схему перетворень:
K2 S H2 S S SO2 SO3 H2 SO4
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- В результаті взаємодії кальцій гідроксиду масою 37 г з амоній сульфатом одержали 15 г амоніаку. Обчисліть масову частку виходу амоніаку.
______________________________________
______________________________________
____________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Самостійна робота №1
Неметали та їхні сполуки
Варіант ІІІ
- Характерними ступенями окиснення елементів підгрупи Нітрогену є:
А) +1, +2, +3, +5, -1, -2, -3;
Б) +3, +5, -1, -2, -3; В) +3, +5, -3.
- Сульфур(ІV) оксид за хімічними властивостями належить до групи:
А) основних; Б) кислотних;
В) амфотерних.
- Фосфор у природі поширений у стані:
А) вільному; Б) зв’язаному;
В) і у вільному, і у зв’язаному.
- Червоний фосфор застосовується:
А) як добриво;
Б) для виготовлення іграшок;
В) для виготовлення сірників.
- Природною сполукою Силіцію є:
А) кварц; Б) халцедон;
В) пірит; Г) крейда.
- До фізичних властивостей сульфур(VІ) оксиду належать такі:
А) рідина; Б) газ;
В) відсутність газу; Г) запах;
Д) розчинність у воді;
Е) нерозчинний у воді.
- Напишіть формули частинок за їх назвами:
Йон Сульфуру, молекула амоніаку,атом Оксигену, йон амонію
_______________________________________________________________________________________________________________________________________________________________________________
- Які хімічні елементи утворили прості речовини: алмаз, кисень, азот, сірка.
____________________________________________________________________________________________________________________________________________
- Здійсніть схему перетворень:
Na2 S H2 S S SO2 SO3 H2 SO4
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Обчисліть масу нітратної кислоти, яку можна одержати з натрій нітрату масою 17г у результаті його взаємодії з концентрованою сульфатною кислотою, якщо масова частка виходу нітратної кислоти становить 96%.
_________________________________
__________________________________________
__________________________________________
__________________________________________
__________________________________________
__________________________________________
__________________________________________
Сполуки неметалічних елементів
Контрольна робота №1
Варіант І
- Яка речовина є алотропною модифікацією Оксигену:
А) кисень; Б) азот;
В) фосфор; Г) сірка.
- Укажіть речовину, яку можна використовувати для виявлення сульфат- іонів у розчині:
А) барій хлорид; Б) арґентум хлорид;
В) купрум(ІІ) гідроксид;
Г) магній гідроксид.
- Позначте оксид Нітрогену, який є несолетворним:
А) N2O; Б)NO2; В)N2O3; Г) N2O5.
- Опишіть фізичні властивості хлороводню.
____________________________________________________________________________________________________________________________________________________________________________
- Складіть назви речовин за їхніми хімічними формулами: NO2; HNO3; NH4Cl.
_________________________________________________________________________________________________________________________________________________________________________________________
- Для виявлення хлорид-іонів у розчин додають______________________________
- Допишіть рівняння реакцій та розставте потрібні коефіцієнти:
NO2+ H2O ->______ CaO+_____-> CaSiO3
KOH+ SO2->______ Fe+ H2SO4(розб)->___
- Складіть рівняння реакцій у молекулярній, повній та скороченій йонній формах, за допомогою яких можна довести наявність у розчині іонів Cl-.
_________________________________________________________________________________________________________________________________________________________________________________________
- Складіть електронний баланс для реакції та підберіть коефіцієнти:
NH3+ O2-> N2+ H2O
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Розшифруйте ланцюг перетворень та напишіть рівняння реакцій для його здійснення:
N2->A->Б-> NO2->KNO3->B
- N2+H2->_____________________(A)
- ______(A)+ O2->________(Б)+__________
- ______(Б)+ O2-> NO2
- NO2+_______-> KNO3+_______________
- KNO3->__________(B)+______________
- При взаємодії сірки масою 144г з воднем було одержано гідроген сульфід об’ємом 75,6л. Обчисліть масову частку виходу продукту реакції від теоретично можливого.
___________________________________________
___________________________________________
___________________________________________
___________________________________________
____________________________________________________________________________________________________________________________________________________________________________
Сполуки неметалічних елементів
Контрольна робота №1
Варіант ІI
- Яка речовина є алотропною модифікацією Карбону:
А) кисень; Б) азот; В) алмаз; Г) сірка.
- Укажіть речовину, яку можна використовувати для виявлення хлорид- іонів у розчині:
А) барій хлорид; Б) арґентум нітрат;
В) купрум(ІІ) гідроксид;
Г) магній гідроксид.
- Позначте оксид Нітрогену, який є несолетворним:
А) NO; Б)NO2; В)N2O3; Г) N2O5.
- Опишіть фізичні властивості амоніаку.
____________________________________________________________________________________________________________________________________________________
- Складіть назви речовин за їхніми хімічними формулами: SO3; H3PO4; Ca(НCO3)2.
_________________________________________________________________________________________________________________________________
- Для виявлення сульфат-іонів у розчин додають________________
- Допишіть рівняння реакцій та розставте потрібні коефіцієнти:
SO3+H2O -> _______ MgO+_____->MgSiO3
NaOH+SO2->________ Zn+H2SO4(розб)->_____
- Складіть рівняння реакцій у молекулярній, повній та скороченій йонній формах, за допомогою яких можна довести наявність у розчині іонів SO42-.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Складіть електронний баланс для реакції та підберіть коефіцієнти:
H2S+O2->SO2+H2O
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Розшифруйте ланцюг перетворень та напишіть рівняння реакцій для його здійснення:
ZnS->A->Б-> CaSO3->B->Г
1) ZnS +HCl->_____+_____(A)
2) _____(A)+O2->_____(Б)+_____
3) _____(Б)+ CaO-> CaSO3
4) ____->CaCl2+_____(В)+_____
5) ______(B)+O2->_______(Г)
- Обчисліть масу амоніаку, яку можна добути, використовуючи 1680л азоту, якщо вихід продукту реакції від теоретично можливого складає 12%.
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_________________________________________________________________________________________________________________________________________________________________________________________
Контрольна робота №2
Металічні елементи та їхні сполуки
Варіант І
- Рідкий метал:
А) мідь; Б) ртуть; В) натрій; Г) срібло.
- Найбільшу електро- й теплопровідність має метал:
А) Са; Б) Аg; В) Мg; Г) Fe.
- Найбільш пластичний метал:
А) натрій; Б) золото; В) калій; Г) залізо.
- Електронна будова атома Натрію:
А) 1s22s22p6; Б) 1s22s22p63s1; В) 1s22s22p63s2
- Як називаються елементи головної підгрупи ІІ групи:
А) лужні; Б) кольорові; В) лужноземельні.
- Установіть відповідність між формулою та назвою сполуки:
А) MgCO3 CaCO3; 1) фосфорит 1_____
Б) CaCO3; 2) доломит 2_____
В) Ca3(РO4)2; 3) вапняк 3_____
- Укажіть рівняння можливої хімічної реакції:
А) Mg+Pb(NO3)2 -> ;Б) Zn+Mg(NO3)2 -> ;
B) Ag+Cu(NO3)2 -> .
____________________________________________________________________________________________________________________________________________________________________________
- Допишіть рівняння можливих реакцій:
- K+H2O ->_____ 3) Al+C ->___________
- Cu+FeSO4 ->____ 4) Fe+H2SO4 ->______
- Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
Na -> Na2O -> NaOH -> Na2CO3 -> Na
______________________________________
______________________________________
______________________________________
____________________________________________________________________________
- Обчисліть об’єм водню (н.у.), що виділиться в результаті взаємодії з водою калію масою 78г, що містить 10% домішок.
______________________________________
______________________________________
______________________________________
______________________________________
______________________________________
____________________________________________________________________________
_____________________________________
________________________________________________________________________________________________________________________________________________________
Контрольна робота
Металічні елементи та їхні сполуки
Варіант ІІ
- Найбільш крихким металом є
А) Cr; Б) Cu; В) Zn; Г) Cu.
- Найбільш тугоплавкий метал
- мідь; Б) вольфрам; В) алюміній.
- Сплави складаються:
А) тільки з металів; Б) з металів і неметалів; В) тільки з неметалів.
- Електронна будова атома Кальцію:
А) 1s22s22p63s23р3; Б) 1s22s22p63s2;
В) 1s22s22p63s23р64 s2.
- Як називаються елементи головної підгрупи І групи:
А) лужноземельні; Б) лужні; В) амфотерні.
- Установіть відповідність між формулою та назвою сполуки:
А) Al2O3 2SiO2 2H2O; 1) сидерит 1_____
Б) CaCO3; 2) каолін 2_____
В) FeCO3; 3) вапняк 3_____
- Укажіть неможливу реакцію:
А) Zn+CuCl2 ->; Б) Zn+АgNO3 ->;
B) Ag+CuSO4 ->.
- Допишіть рівняння можливих реакцій:
- Ca+H2O ->_____ 3) Al(OH)3+HCl ->___
- Ni+AlCl3 ->_____ 4) Fe+HNO3(конц) ->___
- Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
Fe -> FeCl3 -> Fe(OH)3 -> Fe2O3 -> Fe
______________________________________
______________________________________
______________________________________
__________________________________________________________________________________________________________________
- Цинкова обманка (ZnS) містить 20% домішок. Обчисліть масу цинку, яку можна одержати з 280 кг цієї руди.
______________________________________
______________________________________
______________________________________
______________________________________
______________________________________
____________________________________________________________________________
______________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольна робота
Металічні елементи та їхні сполуки
Варіант ІІІ
- Найпластичніший метал
А) Аu; Б) Ag; B) Al; Г) At
- Найлегший метал
- Кальцій; Б) Літій; В) Калій; Г) Натрій.
- Найпоширеніший метал у природі
А) залізо; Б) алюміній; В) мідь; Г) золото.
- Електронна будова атома Алюмінію:
А) 1s22s22p63s23р3; Б) 1s22s22p63s2;
В) 1s22s22p63s23р1.
- Оксид алюмінію виявляє властивості
А) основні; Б) амфотерні; В) кислотні.
- Установіть відповідність між формулою та назвою сполуки:
А) СaSO4 H2O; 1) сидерит 1_____
Б) CaCO3; 2) гіпс 2_____
В) FeCO3; 3) вапняк 3_____
- Укажіть неможливу реакцію:
А) CuSO4+Zn ->; Б) PbCl2+Zn->;
B) Zn(NO3)2+Ni ->.
- Допишіть рівняння можливих реакцій:
- ZnCl2+Cu ->________ 3) Na+H2O ->____
- Al+S ->________ 4) Fe+Mg(NO3)2 ->__
- Запишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
CaCO3 -> CaO -> Ca(OH)2 -> CaCO3 -> CaSO4
______________________________________
______________________________________
________________________________________________________________________________________________________________________________________________________
- В результаті взаємодії кальцій гідроксиду масою 37г з амоній сульфатом одержали 15г амоніаку. Обчисліть масову частку виходу амоніаку.
______________________________________
______________________________________
______________________________________
______________________________________
______________________________________
______________________________________
______________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практична робота № 1
ДОБУВАННЯ ВУГЛЕКИСЛОГО ГАЗУ. ВЗАЄМОПЕРЕТВОРЕННЯ КАРБОНАТІВ І ГІДРОГЕНКАРБОНАТІВ
Мета: навчитися добувати та розпізнавати карбон(ІV) оксид у лабораторних умовах; дослідити взаємоперетворення карбонатів і гідрогенкарбонатів.
Обладнання: штатив із пробірками, шпатель або ложечка, нагрівальний прилад, пробіркотримач, лабораторний штатив із лапкою, пробка з газовідвідною трубкою.
Реактиви: шматочки мармуру (крейди або вапняку), кристалічний натрій гідрогенкарбонат, розчини кальцій гідроксиду (вапняної води), хлоридиої кислоти (1 : 2).
3 правилами техніки безпеки ознайомлений(а), зобов'язуюсь виконувати
________________________(підпис)
Хід роботи
І. Добування карбон(ІV) оксиду
1. Зберіть прилад, як показано на рисунку.
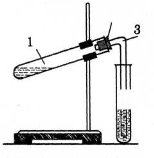
2. Виконайте дослід
Покладіть у пробірку(1) декілька шматочків мармуру, вапняку, крейди або один-два шпателі кристалічного натрій гідрогенкарбонату. Долийте розчин хлоридної кислоти (1 : 2).
3. Швидко закрийте пробірку з реагуючими речовинами пробкою (2) з газовідвідною трубкою (3), кінець якої опустіть у пробірку з вапняною водою (4).
Спостереження ____________________________________________________________________________________________________________________________________________________________________________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновки. Карбон(ІУ) оксид добувають шляхом _____________________________________________
____________________________________________________________________________________
![]() II. Утворення карбонату
II. Утворення карбонату
Пропускайте газ, що утворюється, через вапняну воду до настання видимих змін.
Спостереження ____________________________________________________________________________________________________________________________________________________________________________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
____________________________________________________________________________________________________________________________________
____________________________________________
Висновки. Вуглекислий газ розпізнають за допомогою ________________________________________________________________________________________________________________________________________________________________________
III. Утворення гідроген карбонату і карбонату
Продовжуйте пропускати газ, що утворюється, через розчин до настання видимих змін.
Спостереження ________________________________________________________________________________________________________________________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновки. Карбонати перетворюються на гідрогенкарбонати за таких умов: __________________________________________________________________________________________________________________________________________________________________________________________________________________
IV. Утворення карбонату з гідрогенкарбонату
Вийміть газовідвідну трубку з рідини. Нагрівайте пробірку (4) з прозорим розчином, що утворився, використовуючи пробіркотримач.
Спостереження _______________________________________________________________________________________________________________________________________________________________________________________________________________________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
_________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________
Висновки. Гідрогенкарбонати перетворюються на карбонати за таких умовов: ______________________________________________________________________________________
_________________________________________________________________________________________________________________________________
Зробіть загальний висновок.
У процесі виконання практичної роботи я навчився(лася)________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практична робота № 2
Тема. РОЗВ'ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ
Мета: використати одержані знання про властивості металів та їхніх сполук для проведення та пояснення результатів дослідів.
Обладнання: штатив із пробірками, піпетки, скляна трубка.
Реактиви: 1. У пронумерованих пробірках містяться розчини:
калій карбонату, алюміній хлориду, натрій сульфату;
2. Розчини: хлоридної кислоти, натрій гідроксиду, барій хлориду, купрум(ІІ) хлориду, нітратної кислоти;
Завдання
- У трьох пронумерованих пробірках містяться розчини калій карбонату, алюміній хлориду, натрій сульфату. Визначте, в якій пробірці міститься кожний із них.
- Добудьте розчин купрум(ІІ) нітрату з купрум(ІІ) хлориду.
З правилами техніки безпеки ознайомлений(а), зобов'язуюсь виконувати ___________________________ (підпис)
Хід роботи
І. Визначення речовин
Необхідні реактиви __________________________
а) Щоб визначити (І речовину), необхідно в проби розчинів із трьох пробірок додати ________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Щоб визначити (ІІ речовину), необхідно в проби двох розчинів, що залишилися, додати ____
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) Щоб підтвердити, що в останній пробірці міститься _________, необхідно додати _________
Записати рівняння реакції в молекулярній, повній та скороченій іонних формах.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновки.
У пробірці № 1 міститься____________
У пробірці № 2 міститься_______________
У пробірці № 3 міститься_______________
ІІ. Добування речовин.
Щоб добути ________________________________________________________________________________
Необхідно ________________________________________________________________________________________________________________________________________________________________
(записати рівняння реакцій)
Висновки. Для розв'язання експериментальних задач на визначення та добування речовин необхідно використовувати такі теоретичні знання __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1


про публікацію авторської розробки
Додати розробку
