Збірник завдань з хімії для учнів 7 класу
 Відділ освіти, молоді та спорту Ратнівської райдержадміністрації
Відділ освіти, молоді та спорту Ратнівської райдержадміністрації
Районний методичний кабінет
НВК «ЗОШ І-ІІІ ступеня - дитячий садок» с. Жиричі
Марина Літвинович

2019
Відділ освіти, молоді та спорту Ратнівської райдержадміністрації
Районний методичний кабінет
НВК «ЗОШ І-ІІІ ступеня - дитячий садок» с. Жиричі
Марина Літвинович
Збірник завдань з хімії
7 клас
2019
Збірник завдань з хімії 7 клас, – М.В. Літвинович, Посібник. – Жиричі, 2019. 74 с. : іл.
Посібник містить завдання, які призначені для перевірки рівня навчальних досягнень учнів, активізації навчальної діяльності учнів 7 класів й розроблений відповідно до програми з хімії для загальноосвітніх навчальних закладів, яка ґрунтується на Державному стандарті базової і повної загальної середньої освіти.
Завдання розроблені для кожної теми, які можна використати для групової, фронтальної та індивідуальної роботи учнів. Збірник містить фотозавдання, які допоможуть актуалізувати пізнавальну діяльність учнів та закріпити вивчений матеріал.
Посібник може бути використаний у роботі вчителів хімії та учнів 7 класів.
Автор-упорядник: М.В. Літвинович, вчитель хімії НВК «ЗОШ І – ІІІ ступеня – дитячий садок»
Рецензент: Л.І. Охрімук, заступник директора з навчально-виховної роботи
Схвалено методичною радою НВК «ЗОШ І – ІІІ ступеня – дитячий садок» с. Жиричі, протоколом № 3 від «03» січня 2019 р.
Зміст
|
Вступ |
|
|
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії… |
6 |
|
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з лабораторним посудом та обладнанням кабінету хімії, маркуванням небезпечних речовин. Правила безпеки під час роботи з лабораторним посудом та обладнанням кабінету хімії …………………………...… |
7 |
|
Тема 1. Початкові хімічні поняття |
|
|
1.1 Фізичні тіла. Матеріали. Речовини. Молекули. Атоми. Як вивчають речовини. Спостереження й експеримент у хімії …………….………..……………………………….... |
13 |
|
1.2 Фiзичні властивості речовин. Чисті речовини і суміші (однорідні, неоднорідні). Способи розділення сумішей.. |
15 |
|
1.3 Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з періодичною системою хімічних елементів…………..... |
21 |
|
1.4 Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин... |
29 |
|
1.5 Метали й неметали. Металічні та неметалічні елементи…………………………………………………... |
34 |
|
1.6 Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук… |
38 |
|
1.7 Відносна молекулярна маса, її обчислення за хімічною формулою............................................................ |
41 |
|
1.8 Масова частка елемента в складній речовині….……… |
43 |
|
1.9 Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин...... |
45 |
|
1.10 Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння…....... |
49 |
|
Тема 2. Кисень |
|
|
2.1 Повітря, його склад…………………….…………..…… |
52 |
|
2.2 Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню…………...…………………………..... |
52 |
|
2.3 Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню…............... |
54 |
|
2.4 Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення……….……………………….. |
56 |
|
2.5 Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання). Умови виникнення та припинення горіння ……………..…………………………....………… |
56 |
|
2.6 Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду)………………..…. |
58 |
|
2.7 Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню.................................................................................. |
59 |
|
Тема 3. Вода |
|
|
3.1 Вода, склад молекули, поширеність у природі, фізичні властивості. Вода – розчинник ……………………….….. |
61 |
|
3.2 Розчин і його компоненти: розчинник, розчинена речовина.…………………….…………………………….. |
62 |
|
3.3 Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину………………………... |
63 |
|
3.4 Взаємодія води з оксидами. Поняття про кислоти й основи. Поняття про індикатори………………..........…... |
67 |
|
3.5 Значення води і водних розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення. Очищення води на водоочисних станціях та в домашніх умовах…................ |
71 |
|
Список використаних джерел………………...……………. |
74 |
Вступ
Хімія — природнича наука.
Речовини та їх перетворення у навколишньому світі.
Короткі відомості з історії хімії.
Завдання
- Накресліть схему, за допомогою якої можна пояснити зв'язок хімії з іншими науками.
- Назвіть українських вчених-хіміків.
- Випишіть окремо назви речовин, які існують у природі й ті, які виготовила людина: кухонна сіль, золото, вода, майонез, анальгін, кисень, метан, мідь, скло, папір, мінеральна вода, нафта.
- «Конкурс віршів».
Учням пропонується написати вірші про хімію, чи виписати із літератури.
- «Конкурс знавців» провести на домашнє завдання. Хто наведе більше прикладів із літератури, газет, журналів, кінофільмів, в яких йдеться мова про хімію. Із вирізок газет, журналів, малюнків, фотографій, зробити колаж «Хімія і ми».
- Гра «Фантазуємо разом».
Проводиться на етапі уроку: - закріплення знань. Учням ставиться проблемне запитання. «Якби не було хімії». Відповіді обговорюються і оцінюються.
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з лабораторним посудом та обладнанням кабінету хімії, маркуванням небезпечних речовин. Правила безпеки під час роботи з лабораторним посудом та обладнанням кабінету хімії.
Завдання
- Намалюйте та поясніть схему полум’я.
- Поясніть будову лабораторного штатива. Назвіть призначення його частин.
- Вправа «ланцюжок»: учні по черзі називають правила техніки безпеки.
Тестові завдання
- Під час роботи в хімічному кабінеті можна:
а) вживати їжу;
б) бігати та ходити по класу;
в) йти до умивальника у випадку потрапляння будь-якої речовини на шкіру;
г) змішувати невідомі речовини.
- До виконання дослідів можна приступати:
а) відразу після видачі учителем реактивів;
б) після інструктажу по техніці безпеки;
в) після вивчення досліду та дозволу вчителя;
г) коли сам забажаєш.
- Як перевірити запах речовини:
а) помахом руки тримаючи пробірку з речовиною на відстані;
б) струснувши пробірку піднести близько до носа;
в) нахилитися над пробіркою;
г) не можна нюхати жодних речовин.
- Чому не можна вживати їжу в хімічному кабінеті:
а) це неестетично;
б) заважаєш оточуючим;
в) можна забруднити робоче місце;
г) можливе отруєння хімічними препаратами, які потрапили в їжу.
- Як правильно загасити спиртівку:
а) залити водою;
б) подути на полум’я;
в) засипати піском;
г) накрити ковпачком.
- Після закінчення практичної роботи необхідно:
а) самому прибрати робоче місце;
б) залишити всі речовини та обладнання на столі;
в) залишки розчинів і речовин злити чи зсипати у спеціальну посудину;
г) помити руки.
Фотозавдання
- Розгляньте малюнки, на яких зображені ситуації в кабінеті хімії, і виберіть ті, на яких зображені правильні дії. Прокоментуйте всі зображення.
а) б)
б) в)
в)
г) д)
д) е)
е)
є) ж)
ж) з)
з)
- Назвіть лабораторне обладнання кабінету хімії, яке зображене на малюнках. У яких випадках його використовують.

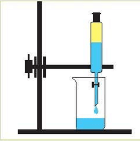
- Укажіть малюнок, на якому зображено правильне переливання речовин з пляшки:
а) 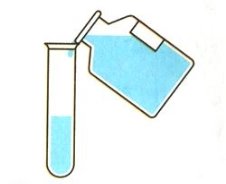 б)
б)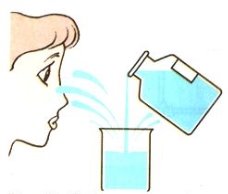
- Назвіть хімічний посуд та вкажіть його використання:
а) б)
б) в)
в)
- Назвіть хімічний посуд, який зображений. В яких цілях його використовують:
а) б)
б) в)
в)
- Поясніть будову приладів та призначення його частин:
а) б)
б)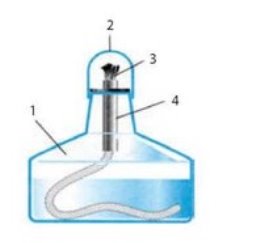
- Які процеси зображені на малюнках:
а)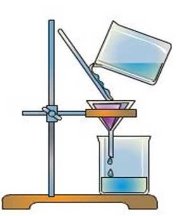 б)
б)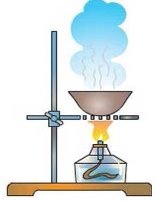 в)
в)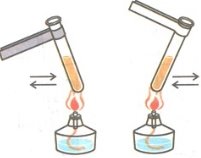
г)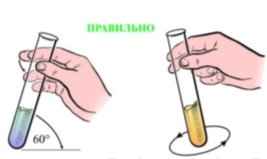 д)
д)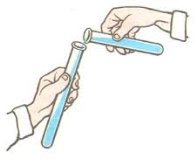 е)
е)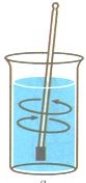
![]() є)
є)  ж)
ж) з)
з)
Тема 1. Початкові хімічні поняття
1.1 Фізичні тіла. Матеріали. Речовини. Молекули. Атоми. Як вивчають речовини. Спостереження й експеримент у хімії.
Завдання
- Наведіть приклади:
а) природних речовин;
б) штучних речовин.
- Випишіть числа, що позначають назви фізичних тіл: 1 – бензин, 2 – цвях, 3 – краплина води, 4 – дерев’яна лінійка, 5 – аркуш паперу, 6 – скло, 7 – колба, 8 – каблучка, 9 – вода, 10 – золото, 11 – пластмаса, 12 – льодяна бурулька, 13 – крейда, 14 – залізо, 15 – мідь, 16 – пробірка.
- Випишіть числа, що позначають назви фізичних тіл і речовин: 1 – термометр, 2 – срібло, 3 – деревина, 4 – стілець, 5 – торф, 6 – вуглекислий газ, 7 – алюмінієвий дріт, 8 – графіт, 9 – питна сода, 10 – ртуть, 11 – вапняк, 12 – крига, 13 – зошит, 14 – крапля роси, 15 – парта, 16 – ручка.
- Наведіть приклади предметів, які можна виготовити з наведених речовин: а) срібло, б) залізо, в) пластмаса.
- Підкресліть сучасні матеріали: глина, капрон, вовна, кістка, каучук, залізо.
- Підкресліть традиційні матеріали: поліетилен, бронза, камінь, алюміній, залізо.
- Назвіть речовини:
а) речовин молекулярної будови;
б) речовин немолекулярної будови.
- Встановіть відповідність між тілами та хімічними речовинами, якими вони утворені:
1. каблучка а) скло;
2. склянка б) ртуть;
3. зошит в) золото;
4. термометр г)папір.
- Встановіть відповідність між тілами та хімічними речовинами, якими вони утворені:
1. цвях а) деревина;
2. свічка б) скло;
3. стілець в) залізо;
4. ваза г) парафін.
Фотозавдання
- Поміркуйте, що є спільною ознакою тіл, які зображені:
а) б)
б) в)
в)
- Поміркуйте, що є спільною ознакою тіл, які зображені:
а) б)
б) в)
в)
- Поміркуйте, що є спільною ознакою тіл, які зображені:
а) б)
б) в)
в)
1.2 Фiзичні властивості речовин. Чисті речовини і суміші (однорідні, неоднорідні). Способи розділення сумішей.
Завдання
- Назвіть, які саме фізичні властивості речовин можна визначити:
а) візульно;
б) експериментально.
- Опишіть фізичні властивості речовин:
а) крейди;
б) води;
в) питної соди;
г) цукру.
- Порівняйте фізичні властивості речовин:
а) цукру та піску;
б) води та олії;
в) заліза та міді;
г) крейди та питної соди.
- За якими фізичними властивостями можна розпізнати:
а) харчову соду та пісок;
б) сірку й залізні ошурки;
в) нашатирного спирту та води.
- Виберіть фізичні властивості, притаманні залізу (за стандартних умов): тверде, рідке, має магнітні властивості, електропровідне, сріблясто-білого кольору.
- Випишіть числа, що позначають назви чистих речовин та сумішей: 1 – мінеральна вода, 2 – молоко, 3 – повітря, 4 – залізо, 5 – грунт, 6 – сметана, 7 – вуглекислий газ, 8 – кисень, 9 – цукор, 10 – граніт, 11 – нафта, 12 – кефір, 13 – мідь, 14 – дистильвана вода, 15 – кухонна сіль, 16 – оцет, 17 – попіл, 18 – цукровий сироп, 19 – крейда, 20 – золото.
- Оберіть ряд, в якому записано лише чисті речовини?
а) кисень, повітря, вуглекислий газ;
б) дистильована вода, водень, цукор;
в) мінеральна вода, мідь, кухонна сіль;
г) граніт, азот, питна сода.
- Запропонуйте способи розділення сумішей:
а) пісок і тирса;
б) залізо і сода;
в) сіль + вода + крейда;
г) рослинна олія + вода + сіль;
ґ ) залізний порошок + вода + пісок;
д) тирса + вода + спирт.
- Продумайте експеримент із розділення суміші цукру, піску, залізних ошурок і деревної тирси. Складіть його план, коротко опишіть кожен етап експерименту і розкажіть про очікувані результати.
- Запропонуйте план розділення суміші кухонної солі, мідних ошурок, сірки та подрібненого пінопласту.
- Гра «Хлопок»
На правильну відповідь учні роблять один плеск долонь, на неправильну два.
Наприклад: Визначити чисті речовини: річкова вода, сірка, вільне від пилу та вологи повітря, кисень вуглекислий газ, сметана, залізо, мідь, морська вода, спирт, золото, дистильована вода, крохмаль, грунт, алюміній.
Фотозавдання
- Заповніть схему:


- Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук:
а) б)
б)  в)
в) 
г) д)
д)  е)
е) 
є) ж)
ж)  з)
з) 
и) і)
і)  ї)
ї) 
й) к)
к) л)
л)
м) н)
н) )
) 
- Виберіть чисті речовини та суміші, відповідь обгрунтуйте:
а) б)
б) в)
в)
- Виберіть чисті речовини та суміші, відповідь обгрунтуйте:
а) б)
б)  в)
в)
г) д)
д)  е)
е)
є)  ж)
ж) з)
з) 
- Поясніть суть кожного способу розділення сумішей:
а) б)
б)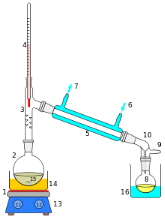 в)
в) 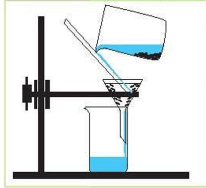
г)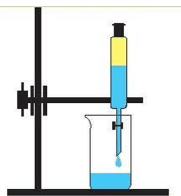 д)
д)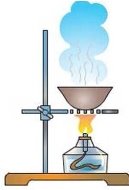 е)
е) 
- Розгляньте малюнки. На якому з них зображена чиста речовина? Відповідь обгрунтуйте:
а)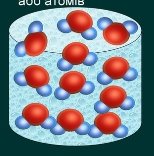 б)
б) в)
в) 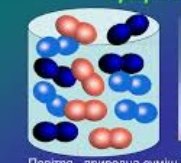
1.3 Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з Періодичною системою хімічних елементів Д.І. Менделєєва.
Завдання
- Напишіть назви наступних хімічних елементів:
Cl, N, Fe, F, O, Mg, Al, P, H, Ca, Na, Zn, Cu, S.
- Установіть відповідність між символом хімічного елемента та його назвою:
1. О а) Калій;
2. К б) Ферум;
3. Са в) Кальцій;
4. Fe г) Оксиген.
- Що таке «атом»? Схематично зобразіть будову найпростішого атома.
- Випишіть із періодичної системи символи всіх елементів, які починаються з літери: а) К; б) А. Скільки існує таких елементів?
- Користуючись додатковими джерелами, випишіть хімічні елементи, названі на честь: а) вчених; б) країн чи населених пунктів; в) планет чи зірок.
- Охарактеризуйте поширеність хімічних елементів: а) в атмосфері; б) гідросфері; в) земній корі; г) Всесвіті.
- Хімічний диктант: «Символи елементів»
Завдання: написати символи хімічних елементів, що зустрічаються у тексті: «Кілька тисяч років тому людству були відомі сім хімічних елементів: Аурум, Аргентум, Плюмбум, Меркурій, Ферум, Купрум, Сульфур. Повільно накопичувалися відомості про хімічні елементи. У XVII сторіччі були відкриті Фосфор, Цинк, Карбон, а у наступному (XVIII ст.) – Хлор, Оксиген, Нітроген, Гідроген і ряд інших. З розвитком хімії кількість заново відкритих елементів швидко зростала. У ХІХ столітті стали відомі Алюміній, Кальцій, Калій, Натрій, Магній, Флуор і багато інших. Сьогодні відомо 113 хімічних елементів».
- Заповніть таблицю:
а)
|
Символ елемента |
Назва |
Порядковий номер |
Ar |
№ періоду |
№ групи, головна чи побічна підгрупи |
Заряд ядра |
Кількість електронів |
Кількість протонів |
|
|
Манган |
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
|
|
|
|
|
4 |
І група |
|
|
|
б)
|
Символ елемента |
Назва |
Порядковий номер |
Ar |
№ періоду |
№ групи, головна чи побічна підгрупи |
Заряд ядра |
Кількість електронів |
Кількість протонів |
|
|
Нітроген |
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
3 |
ІV група, головна підгрупа |
|
|
|
|
Mg |
|
|
|
|
|
|
|
|
|
|
|
|
197 |
|
|
|
|
|
- Гра «Відгадай елемент»: пропонується три фрагменти про хімічний елемент; зачитується перший, якщо немає відповіді зачитуються наступні.
Завдання 1.
- Як самостійний хімічний елемент він був відкритий 200 років тому. Просту речовину, утворену цим елементом, відкрили незалежно один від одного двоє відомих хіміків XVIII ст. – англієць Джозеф Прістлі і швед Карл Шеєле. Але вони лише описали речовину, навіть не здогадуючись, що описують. По-справжньому її відкрив французький хімік Антуан Лоран Лавуазьє. Він пояснив процеси дихання і горіння, а також дав назву цьому елементу.
- Цей елемент найпоширеніший на Землі.
- У повітрі вміст простої речовини, утвореної цим елементом, становить 21%. (Оксиген (кисень).)
Завдання 2.
- Великий період в історії людства названий на честь простої речовини. Це був перехідний період від кам’яного віку до бронзового, коли появилися інструменти з простої речовини цього елементу.
- Ця речовина важлива для електротехніки. Вона дуже добре проводить електричний струм. За електропровідністю – друга після срібла.
- Це d-елемент з першої групи періодичної системи. (Купрум (мідь)).
Завдання 3.
- 1766 року відомий англійський вчений Генрі Кавендіш добув «штучне повітря» дією цинку, заліза чи олова на розбавлений розчин хлоридної чи сульфатної кислоти. «Повітря» Кавендіша виявилось самостійною речовиною. З якого хімічного елемента складається ця проста речовина?
- Цей елемент найпоширеніший у Всесвіті.
- 1787 року Антуан Лавуазьє довів, що цей елемент входить до складу води і назвав його «той, що народжує воду». (Гідроген (водень).)
Завдання 4.
- Цей легкий, сріблясто-білий метал уперше добув 1808 року англійський хімік Г.Деві. Він змішав зволожену магнезію з оксидом ртуті і отримав сплав цього металу з ртуттю.
- Цей метал має одну незвичайну властивість – він здатний горіти. Ошурки чи дрібні стружки легко займаються й інтенсивно горять сліпучим яскравим полум’ям. Тому його використовують у ракетах і феєрверках.
- В електронній оболонці атома цього елемента є 12 електронів. (Магній.)
Завдання 5.
- Вперше його відкрили на Сонці і назвали «сонячним газом».
- Легкий, але негорючий він став незамінний у повітроплаванні. Ним наповнюють дирижаблі, стратостати, повітряні кулі.
- В ядрі цього елемента є 2 протони. (Гелій).
Завдання 6.
- З XIX ст. цей метал набув ролі світових грошей. Переставши виконувати функції засобу обігу і засобу платежу, воно досі лишається загальним еквівалентом вартості, резервним фондом для міжнародних розрахунків.
- Метал, утворений цим елементом може розчинити лише «царська горілка» (суміш нітратної і хлоридної кислот).
- Цей елемент знаходиться в 6-му періоді, І-ій групі періодичної системи. (Аурум (золото).)
Завдання 7.
- Давньогрецький учений Арістотель назвав просту речовину, утворену цим елементом, «срібною водою». Алхіміки широко використовували цю речовину у своїх дослідах і ритуалах.
- Випари цієї речовини і її сполуки отруйні.
- Єдиний метал, який за кімнатної температури перебуває у рідкому стані.(Меркурій (ртуть).)
Завдання 8.
- Це найпоширеніший метал на Землі.
- Він легко піддається обробці: витягується в тонкий дріт, відливається, прокатується в фольгу.
- Літаки на 2/3 складаються із сплавів цього металу, тому його називають крилатим металом. (Алюміній.)
Завдання 9.
- Цей елемент – один з найголовніших елементів неживої природи. Він займає друге місце за поширеністю на Землі.
- Його часто застосовують для виготовлення сонячних батарей.
- Це неметалічний елемент з IV групи Періодичної системи. (Силіцій (крімній).)
Завдання 10.
- Китайський кодекс 1567 року до н.е. рекомендував для лікування зобу морські водорості. Завдяки якому елементу водорості мають лікувальні властивості?
- Спиртовий розчин цієї речовини має антисептичні властивості, тому використовується для обробки ран.
- Електрони в атомі цього елемента розташовані на п’ятьох енергетичних рівнях. На останньому рівні рухається 7 електронів. (Йод)
- Вправа: «Склади назву із літер»
Із запропонованих літер скласти назви хімічних елементів: н, а, р, б, й, т, к, г, у, л, д, м, і, о.
- Вправа: «Хімічний ланцюжок»
Учні по черзі називають хімічні елементи, причому остання (або передостання) буква в назві одного служить першою буквою назви наступного елемента. Розпочинають з назви елемента, порядковий номер якого №1 (гідроген). Гра зупиняться коли жодень учень не може назвати елемент.
- Гра «Я репортер»
Написати репортаж на тему «Хімічні елементи в організмі людини».
«Хімічні елементи названі на честь учених, на честь країн».
- Гра «Головна літера»
Випишіть по горизонталі назви хімічних елементів, що розпочинаються з літери «Н».
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Гра «Головоломка»
Малі пустуни H, C, P, S, K, Ca, Mg, Fe, Zn, Pb, Cl, O, N, Cu, Ag, B, F, Ba, I переплутали всі літери у своїх назвах. Допоможіть їм відновити свої імена із запропонованих літер. Якщо ви все зробите правильно, то з літер, які залишаться, складеться назва хімічного елемента, названого на честь видатного російського хіміка. Слова ламаються під прямим кутом і не перетинаються.
|
К |
І |
Д |
Р |
А |
Л |
Ь |
Й |
И |
Н |
О |
Р |
|
А |
Г |
Н |
О |
К |
І |
Ц |
І |
Ц |
К |
У |
У |
|
Р |
Б |
О |
Г |
Й |
Й |
Г |
Н |
М |
П |
Л |
Й |
|
Ф |
О |
Н |
Е |
І |
М |
А |
Р |
У |
Л |
Ф |
О |
|
Ф |
С |
С |
І |
Ц |
Й |
І |
Е |
М |
Ю |
Й |
Д |
|
О |
Р |
И |
Л |
К |
А |
Л |
Ф |
Б |
У |
І |
Р |
|
О |
К |
М |
Г |
І |
К |
У |
Г |
О |
М |
Б |
А |
|
И |
С |
У |
Т |
Д |
М |
П |
Е |
Р |
Н |
О |
Б |
|
Г |
Е |
Н |
Н |
Р |
У |
Р |
Н |
Т |
І |
Р |
Й |
|
Х |
Л |
Г |
Е |
А |
Р |
Г |
І |
Р |
У |
М |
І |
|
Р |
О |
Р |
А |
М |
Е |
Н |
Д |
Е |
Л |
Е |
В |
- Гра «Перехрестями чудової таблиці»
Мандруючи Періодичною системою, ви зустрінете немало назв хімічних елементів, що містять літеру «А» та «Н». Впишіть ці назви у запропоновані таблиці.
|
а) |
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
б) |
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
|
А |
|
|
|
|
|
|
|
А |
|
|
|
|
в) |
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
г) |
Н |
|
|
Н |
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
Н |
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
Н |
|
|
|
1.4 Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів. Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин.
Завдання
- Виберіть формули простих речовин:
а) N2, Cl2, O2, O3, Al;
б) Cu, H2O, CaO, H2SO4;
в) H2O, MgO, Cu, H3PO4;
г) HCl, H2O, H2SO4, NaOH.
- З переліку речовин випишіть окремо формули простих та складних речовин:
а) Fe, CuO, CO2, H2, Fe, CaC2, KCl, N2;
б) ZnCl2, NH3, Ba, SO3, Br2, N2O3, P.
- Що означають вирази?
3Al, 8O3, 6CO2, 4N2, C, 6F2, SiO2, 2H, 2H2.
- Напишіть формули речовин, до складу яких входять:
а) три атоми Калію,один атом Фосфору. чотири атоми Оксигену;
б) два атоми Натрію,один атом Силіцію,три атоми Оксигену;
в) чотири атоми Гідрогену,два атоми Фосфору,сім атомів Оксигену.
- Опишіть якісний і кількісний склад молекули за хімічною формулою: Al2O3; Al2(SO4)3; H3PO4; С12H22O11; N2; H2SO4; K2HPO4; FeOH(NO3)2; NH4H2PO4.
- Гра «Хрестики – нулики».
Робота в парах. Учні записують прості та складні речовини. Виграє учень, який закреслить квадратик з трьома однаковими хімічними речовинами.
|
КОН |
N2 |
H2CO3 |
|
СuО |
Na2O |
CO2 |
|
Sі |
Ca3P2 |
HNO3 |
- Гра «Атоми у нас дома »
Виготовити із пластиліну моделі молекул простих ( H2, O2, Cl2 ) і складних ( H2О, CO2, NaCl) речовин. Атоми різних елементів повинні мати різний колір і різний розмір.
- Гра «Хто спритніший »
Дана гра допомагає закріпити знання про хімічні формули речовин, відводиться певний час (2-3 хв.)
Записати у вигляді хімічних формул:
- 3 атоми Гідрогену;
- 4 молекули Н2О;
- 5 молекул кисню;
- 3 атоми Оксисену;
- 10 молекул вуглекислого газу;
- 2 атоми сірки;
- 5 молекул хлору;
- Гра « Відгадай хто ти »
Вчитель виготовляє картки з написами хімічних формул і прикріплює їх на спину кільком учням. Учень, не знаючи яка формула прикріплена на нього, має визначити за допомогою поставлених ним запитань.
Наприклад:
- Проста чи складна речовина.
- Метали, неметали.
- Назва хімічного елемента (підказка може бути вчителем – поширеність, значення даного елемента ).
- Кількість атомів.
- Кількість молекул.
- Вправа «Руки вгору».
Називати прості і складні речовини, учні піднімають руку тільки тоді, коли називається складна речовина: сульфур (VI) оксид, сірка, нітратна кислота, фосфор (V) оксид, гелій, магній силікат, марганець, літій оксид, мідь, натрій нітрат, магній, кисень, хлор, барій фосфат, хлоридна кислота, йод, плюмбум гідроксид, олово, кремній.
- Користуючись наведеним нижче переліком речовин заповніть таблицю:
|
Прості речовини |
Складні речовини |
|
|
Метали |
Неметали |
|
|
|
|
|
O2, Sn, C6H12O6, Si, Al, Br2, ZnS, Na, Al2(SO4)3, F2, H2O2, H2, Pb, V2O5.
- Гра «Індекси і коефіцієнти»
Уважно роздивіться таблицю і визначте, скільки разів у ній зустрічаються записи, які означають:
- одну молекулу простої речовини, яка складається з 2 атомів;
- два атоми хімічного елемента;
- дві молекули складної речовини;
- одну молекулу складної речовини;
- чотири молекули складної речовини.
|
2H |
2O2 |
CO2 |
2PH3 |
2Cl |
O2 |
O3 |
|
H2 |
2CO2 |
N2 |
4O2 |
O |
2O |
3CO2 |
|
2SO2 |
Cl2 |
CO |
2Cl |
4N |
4CCl4 |
N2 |
|
2N |
HNO3 |
4H2 |
H2O |
2H |
4Br2 |
4O |
|
S |
4NO |
2Cl2 |
HPO3 |
4NO2 |
CH4 |
3CO |
|
HCl |
N2O |
CS2 |
2HCl |
H |
2H2O |
2CH4 |
Фотозавдання
- Виберіть формули простих та складних речовин:
а)  б)
б) 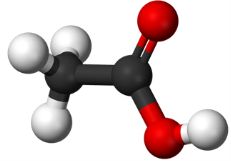 в)
в)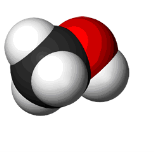
г)  д)
д)  е)
е) 
- Опишіть якісний та кількісний склад формул речовин:
а) 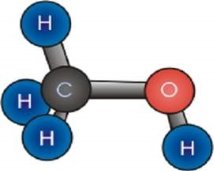 б)
б)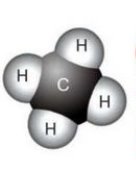 в)
в) 
г)  д)
д)  е)
е) 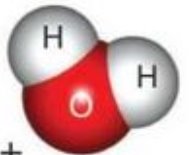
є) 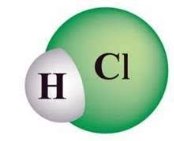 ж)
ж) 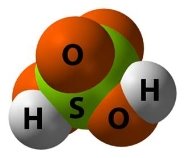 з)
з) 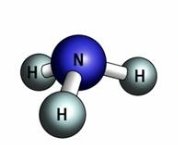
и) 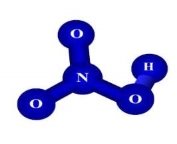 і)
і) 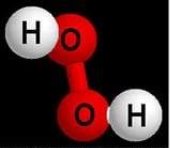 ї)
ї) 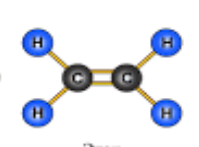
- Вкажіть загальну кількість різних атомів у молекулах речовин:
а)  б)
б) 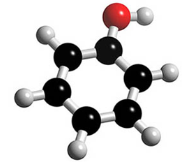 в)
в) 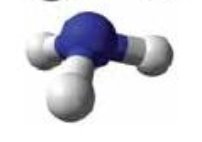
г) 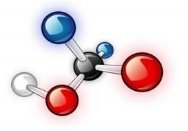 д)
д) 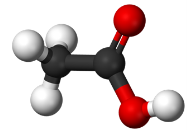 е)
е) 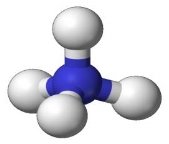
є) 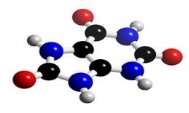 ж)
ж) 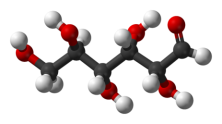 з)
з) 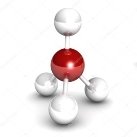
и) 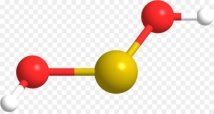 і)
і) 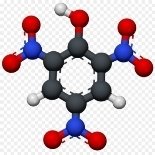 ї)
ї) 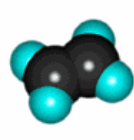
1.5 Метали й неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі.
Завдання
- Заповніть пропуски у твердженнях, використавши слово «олово» або «Станум» у відповідному відмінку:
а) За температури нижче 13,2 °С__________ перетворюється на сірий порошок.
б) Станіт – це мінерал, що містить __________.
в) З ____________ виготовляють білу жерсть, яку використовують для виготовлення консервних бляшанок.
г) У складі молекул олов’яної кислоти міститься лише один атом ______.
- Заповніть пропуски, вставивши у відповідних відмінках слова «азот» або «Нітроген»:
а) ______ - газ, якого в повітрі міститься найбільше.
б) Молекула_______ складається із двох атомів ________.
в) Сполуки _______ потрапляють у рослини із грунту.
г) _______ погано розчиняться у воді.
- Заповніть пропуски, вставивши у відповідних відмінках слова «кисень» або «Оксиген»:
а) Відомо понад 1400 мінералів, до складу яких входить ______.
б) ______ - газ, який необхідний для дихання.
в) У тілі дорослої людини масова частка ______ становить приблизно 65%.
г) Молекула _____ складається з двох атомів ______.
- Заповніть пропуски, вставивши у відповідних відмінках слова «залізо» або «Ферум»:
а) _______ - тугоплавкий метал, який притягуться магнітом.
б) Для запобігання корозії вироби із _______ покривють фарбами, лаками, мастила.
в) Завдяки ______ гемоглобін, а отже й кров, мають червоний колір.
г) _______ - це один із найважливіших металічних елементів.
- Гра «Хрестики-нулики»
- Робота в парах. Учні записують металічні та неметалічні елементи. Виграє учень, який закреслить квадратик з трьома металами чи неметалами.
- Гра «Третій зайвий»
Який з трьох елементів зайвий?
а) Na, Fe, S.
б) O, N, K.
в) P, Mg, Cl.
г) Ag, Cu, C.
Фотозавдання
- Опишіть фізичні властивості речовин та визначте метали чи нематали зображені на малюнках:
а)  б)
б)  в)
в) 
г)  д)
д)  е)
е) 
- Вкажіть метали чи нематали зображені на малюнках. Відповідь обґрунтуйте.
а)  б)
б)  в)
в) 
г)  д)
д)  е)
е) 
- Вкажіть метали чи нематали зображені на малюнках. Відповідь обґрунтуйте:
а)  б)
б)  в)
в) 
г)  д)
д)  е)
е) 
- Вкажіть метали чи нематали зображені на малюнках. Відповідь обґрунтуйте:
а)  б)
б)  в)
в) 
г)  д)
д)  е)
е) 
1.6 Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук.
Завдання
- Визначте валентність кожного елемента у формулах бінарних сполук:
а) FeBr3, Mg3N2, Mn2O7, SnO2, CuО, Cu2О, Cl2O7, Na2S, CH4, SnO;
б) AlCl3, HCl, CCl4, CO2, CaCl2, SiH4, PbO, Na3N, BaO, Ca3P2, SO3, FeCl3, NaI, CaS, HF, Cu2O.
- Скласти формули бінарних сполук із такими елементами: Натрій, Кальцій, Алюміній, Ферум (ІІ), Ферум (ІІІ), Купрум (ІІ), Купрум(І), Фосфор (ІІІ), Фосфор (V).
а) оксидів – сполук, до складу яких входить Оксиген;
б) сульфідів – сполук, до складу яких входить Сульфур, ураховуючи, що Сульфур у них має валентність ІІ;
в) хлоридів – сполук, до яких входить Хлору, якщо Хлор має в них валентність І.
- Назвіть металічний елемент, який у сполуках з Оксигеном проявляє найбільшу валентність: WO3, NiO, F2O, Al2O3, V2O5.
- Назвіть неметалічний елемент, який у сполуках з Оксигеном проявляє найменшу валентність: NO, Br2O7, NO2, K2O, Cl2O3.
- Визначте сполуку, в якій Хлор проявляє вищу валентність: HCl, HClO, HClO2, HClO3, HClO4.
- Гра « Естафета».
Клас ділиться рядами на групи, учні кожної групи по черзі виконують завдання біля дошки. Перемагає та команда, що перша дійде до фінішу. Завдання: визначити валентність елементів у формулах бінарних сполук.
- Гра «Хімічні кубики»
Гра проводиться у групах. На гранях двох кубиків зображено по два знаки хімічних елементів, з яких потрібно скласти формулу речовини за валентністю. Учні по черзі викидають кожен свій кубик, записуючи формули на дошці. За правильну формулу – 1 бал. (Учні заздалегідь виготовляють кубики.)
- Знаючи валентності хімічних елементів, напишіть формули їхніх сполук:
III II IV I I II VI II
а) Fe O, C H, Na S, S O ;
II II IV I III II IV II
б) Mg O, Si H, B O, S O ;
II II I I II I VIII II
в) C O, K Cl, Pb I, Os O ;
III II I III I II IV II
г) Al S, Na P, Ag O, Sn O ;
III I III II I I IV II
д) Al Cl, B O, H I, C O .
Фотозавдання
- Виходячи з визначення валентності як кількості хімічних зв’язків визначте валентність елементів за графічними формулами. Запишіть молекулярні формули речовин.
а) 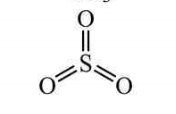 б) Са ═ О в)
б) Са ═ О в) 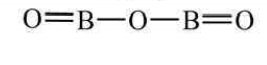
г) 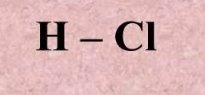 д)
д) 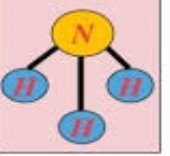 е)
е) 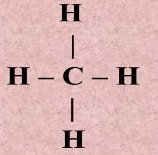
є) 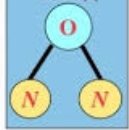 ж)
ж) 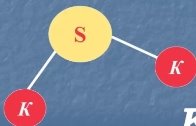 з)
з) 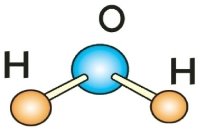
и)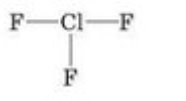 і)
і) 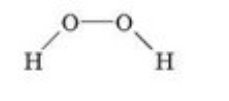 ї)
ї)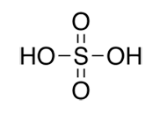
й) 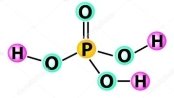 к)
к)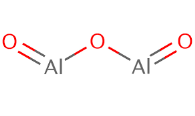 л)
л)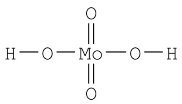
1.7 Відносна молекулярна маса, її обчислення за хімічною формулою
Завдання
- Обчисліть відносні молекулярні (формульні) маси речовин: O2, N2, O3, H2O2, H2SO4, CaF2, SiO2, H2CO3, Na2SO4, Mg(H2PO4)2, Al2(SO4), KAl(SO4)2, C6H12O6.
- Відносна молекулярна маса сполуки Хлору з Оксигеном становить 183. Відомо, що в молекулі речовини міститься 7 атомів Оксигену. Знайдіть її формулу.
- Відносна формульна маса сполуки елемента Х із Флуором удвічі більша за відносну атомну масу Фосфору. Знайдіть елемент Х і напишіть формулу сполуки.
- Обчисліть та вкажіть відношення мас атомів Гідрогену, сульфуру і Оксигену в речовині, формула якої H2SO4.
- Відносна молекулярна маса речовини, формула якої R2O5, дорівнює 142. Визначте елемент, який сховався в цій формулі.
- Складіть формулу сполуки та обчисліть її відносну молекулярну масу:
а) склад – два атоми Нітрогену та п’ять атомів Оксигену;
б) склад – два атоми Алюмінію та три атоми Сульфуру;
в) склад – два атоми Гідрогену, один атом Сульфуру та чотири атоми Оксигену.
- Вправа «Сортувальник»
Учні об’єднуються в групи , виконують завдання і презентують результат. Кожна команда одержує пакет стікерів з формулами речовин. Члени команд повинні наклеїти на аркуш паперу стікери з формулами за валентністю першого елемента. (Виконані завдання порівнюють, виправляють помилки)
Na2O, N2O3, CuO, N2O5, SO3, MnO2 (групі 1,3,5)
CrO3, MgO, Cu2O, Al2O3, P2O5, SiO2 (групі 2,4,6)
Фотозавдання
- Обчисліть відносні молекулярні маси речовин:
а) 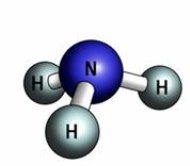 б)
б) 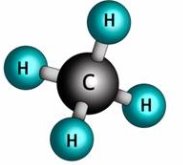 в)
в) 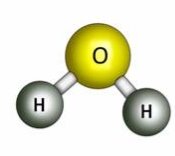
г) 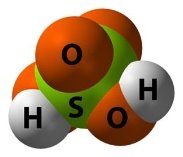 д)
д)  е)
е) 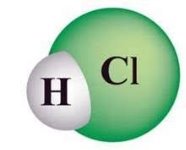
є) 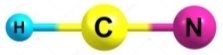 ж)
ж)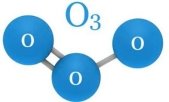 з)
з) 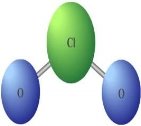
и) 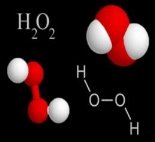 і)
і) 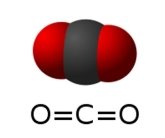 ї)
ї) 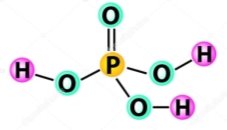
й)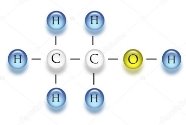 к)
к)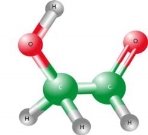 л)
л)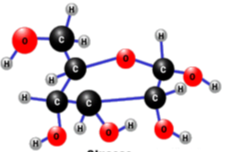
м) 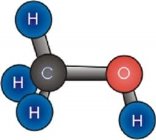 н)
н) 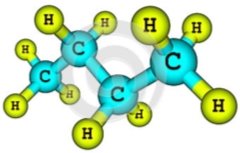 о)
о) 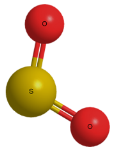
1.8 Масова частка елемента в складній речовині
Завдання
- Обчисліть масові частки хімічних елементів у речовинах: Cl2O7, Mg3N2, Cu2S, Na2O, Ag3PO4, KOH, Fe2(SO4)3, Cu2(OH)2CO3, C6H12O6.
- Обчисліть, у якій речовині більший вміст металу:
а) PbO2 Pb3P2;
б) Fe2O3 FeF2;
в) K2SO4 KNO3;
г) Cu(NO3)2 CuCl2.
- Яка маса Феруму міститься в 15,4 г ферум (ІІ) нітриді Fe3N2?
- Обчисліть масу Мангану, який можна добути із 20 т руди, що містить 14% манган (ІV) оксиду MnO2.
- Встановіть хімічну формулу речовини, якщо відомо масові частки елементів:
а) Al – 53%, O – 47%;
б) S – 40%, O – 60%;
в) Na – 59%, S – 41%;
г) N – 26%, O – 74%;
д) K – 85%, Si – 15%;
е) Mg – 13%, Br – 8%;
є) Ba – 35%, I – 65%;
ж) Ca – 40%, C – 12%, O – 48%;
з) К – 39,7%, Mn – 27,9%, O – 32,4%;
и) Ag – 77%, P – 7%, O – 15%;
і) Fe – 37%, S – 21%, O – 42%;
й) P – 22,5%, Cl – 77,45%.
- Гра «Хто швидше»
Учням пропонуються задачі за варіантами:
І варіант: Напишіть формулу сполуки, що складається з одного атома Натрію, одного атома Нітрогену і трьох атомів Оксигену. Обчисліть масові частки елементів у сполуці та масове співвідношення.
ІІ варіант: Напишіть формулу сполуки, що складається з двох атомів Калію, одного атома Карбону і трьох атомів Оксигену. Обчисліть масові частки елементів у сполуці та масове співвідношення.
- Виведіть формули речовин за даними масовими співвідношеннями:
а) m(Fe) : m(S) = 7:8;
б) m(S) : m(O) =1:1;
в) m(Cu) : m(S) = 4:1;
г) m(Br) : m(O) = 10:3;
д) m(Fe) : m(O) = 21:8;
е) m(Ca) : m(C) = 10:6.
1.9 Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин.
Завдання
- Вкажіть, які явища хімічними, а які фізичними:
а) випаровування води; и) танення криги;
б) обвуглення скалки; і) скисання молока;
в) іржавіння цвяха; ї) горіння вугілля;
г) вибух динаміту; й) підгоріння їжі на сковороді;
д) горіння сірника; к) бродіння виноградного соку;
е) згіркнення масла; л) пожовтіння листя на деревах;
є) горіння спирту; м) подрібнення шматка крейди;
ж) утворення хмар; н) плавлення шматка олова;
з) гасіння вапна; о) кристалізація солі.
- Гра «Руки вгору».
Учитель зачитує приклади хімічних і фізичних явищ. Учні піднімають руки, коли йдеться про хімічне явище. Той, хто швидше всіх підняв руку, заробляє 1бал.
- Заповніть схеми:
а) Природні процеси

б) Умови початку хімічних реакцій
![]()
![]()
![]()
![]()
_________ ________ _______ _______
_________ ________ _______ (якщо це газ)
![]()
![]()
![]()
![]()
![]()
![]() в) Ознаки протікання хімічних явищ
в) Ознаки протікання хімічних явищ
______ Зміна ______ Утворення Поява _________
______ ______ ______ або розчинення ______ _________
_____ ____ _____ __________ _____ _______
Фотозавдання
- Із запропонованих явищ оберіть фізичні та хімічні. Відповідь обґрунтуйте:
а)  б)
б)  в)
в)
г) д)
д) е)
е) 
є) ж)
ж) з)
з)
и) і)
і)  ї)
ї)
й) к)
к) л)
л)
м)  н)
н)  о)
о)
- Вкажіть ознаки протікання хімічних явищ, які зображені:
а) б)
б) в)
в)
г) д)
д) е)
е)
є) ж)
ж)  з)
з) 
и) і)
і) ї)
ї)
й) к)
к) л)
л)
1.10 Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння.
Завдання
- Розставте коефіцієнти у схемах і вкажіть їх суму:
а) K + O2 = K2O;
б) Na + Cl2 = NaCl;
в) KClO3 = KCl + O2;
г) Li+ H2O = LiOH + H2;
д) Al + H2SO4 = Al2(SO4)3 + H2;
е) Na2O + H2O = NaOH;
є) SiO2 + HF = SiF4 + H2O;
ж) Al2O3 + Fe = Fe2O3 + Al;
з) Pb(NO3)2=PbO + NO2+O2;
и) N2 + H2 = NH3.
- Складіть формули продуктів реакції і відповідні хімічні рівняння:
а) Al + F2 → AlF…;
б) Ca + N2 →Ca…N…;
в)SiH4 + O2 → SiO... + H2O;
г) FeO + Al →Fe + Al…O…;
д) AlBr3 + Cl2 →AlCl… + Br2;
е) H2S + O2→SO…+ H… O.
- Складіть і прочитайте хімічні рівняння таких реакцій:
а) при взаємодії двох газів – кисню і водню – утворюється вода;
б) при взаємодії водню з хлором утворюється гідроген хлориду (HCl);
в) при згорянні вуглецю С утворюється вуглекислий газ;
г) при взаємодіїї карбону й водню утворюється метан (СН4);
д) при взаємодії заліза з хлором утворюється ферум (ІІІ) хлорид (FeCl3);
е) при взаємодії магнію з сіркою утворюється магній сульфід (MgS).
- Прокоментуйте схеми реакцій і перетворіть їх на хімічні рівняння:
hv
а)AgCl → Ag + Cl2;
t, Pt
б) N2 + H2 → NH3 ;
MnO2
в) HgO → Hg + O2↑.
t
г) Fe2O3 + C → Fe + CO2;
t
д) Al + I2 → AlI3;
е) Na2CO3 + Ca(OH)2→ CaCO3↓ + NaOH;
- Під час згоряння 240 г вуглецю утворилося 120 г вуглекислого газу. Скільки грамів кисню прореагувало?
- Обчисліть, яка маса кальцію прореагувала з киснем (O2) масою 3,2 г, якщо утворився кальцій оксид (СаО) масою 11,2 г.
- З азотом (N2) масою 5,3 г прореагував водень (H2). Утворилось 15,7 г амоніаку (NH3). Обчисліть масу водню, який прореагував.
- Під час розкладу малахіту (CuOH)2CO3 утворилося 10 г купрум (ІІ) оксиду CuO, 5,6 г вуглекислого газу та 7,2 г води. Запишіть за допомогою хімічних формул закон збереження маси речовин. Укажіть масу малахіту, який розклався.
- Під час нагрівання 35 г крейди (СаСО3) утворилось 18 г кальцій оксиду СаО і виділився вуглекислий газ. Обчисліть масу цтого газу. Запишіть за допомогою хімічних формул закон збереження маси речовин.
Фотозавдання
- Прокоментуйте досліди, які зображені на малюнках:
![]()
![]()
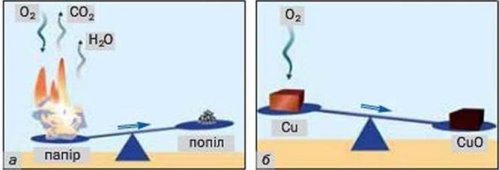
а) б)
![]()
![]()

в) г)
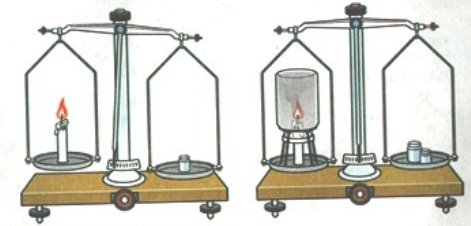
д) е)
Тема 2. Кисень
2.1 Повітря, його склад
Завдання
- Схематично зобразіть склад сухого повітря.
- Чи відрізняться склад повітря в лісі, на пішохідній вулиці та на автомобільній магістралі? Поясніть вашу думку.
- Поясніть проблеми забруднення повітря та запропонуйте шляхи їх розв’язування.
- Із запропонованих тверджень виберіть лише правильні:
а) атмосферне повітря необхідне для дихання;
б) повітря – це суміш газів;
в) у складі повітря найбільше міститься кисню;
г) тепле повітря опускається вниз;
д) тепле повітря піднімається вгору;
е) повітря добре проводить тепло;
є) від нагрівання повітря розширюється.
2.2 Оксиген. Поширеність Оксигену в природі.Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
Завдання
- Прийом «Асоціативний кущ»
Поступово біля стрілочок записати все, що пригадали про Оксиген.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
- Складіть речення, вставивши замість крапок слова «Оксиген» або «кисень» у відповідних відмінках:
а) …– проста речовина …;
б) вода утворена Гідрогеном і …;
в) молекула … складається із двох атомів …;
г) у результаті фотосинтезу рослини поглинають вуглекислий газ, а виділяють …;
д) … неохідний живим істотам для дихання;
е) … входить до складу великої кількості мінералів;
є) до складу молекули глюкози входить шість атомів … .
- Знайдіть масову частку Оксигену:
а) у вуглекислому газі;
б) в озоні;
в) у гашеному вапні Са(ОН)2;
г) у глюкозі С6Н12О6.
- Складіть формули сполук Оксигену з елементами: Na, Fe(III), Cu (II), Ca, Al, P (V), N (IV), S (VI), Cl(VII).
- Відносна молекулярна маса сполуки Сульфуру з Оксигеном удвічі більша за відносну молекулярну масу кисню. Знайдіть формулу сполуки.
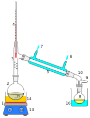
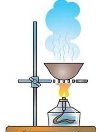
2.3 Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню.
Завдання
- У закоркованих посудинах містяться кисень, повітря, вуглекислий газ, азот. Як дізнатися, у якій колбі кисень?
- За допомогою схеми лабораторних методів добування кисню, запишіть відповідні рівняння реакцій:
NaNO3, KNO3
![]() t
t
![]()
![]() KMnO4 t t HgO
KMnO4 t t HgO
O2
![]()
![]() t, MnO2 MnO2
t, MnO2 MnO2
KClO3 H2O2
- Перетворіть на хімічні рівняння такі схеми реакцій (всі реакції відбуваються при нагріванні):
а) Ag2O → Ag + O2;
б) Mn2O7 → MnO2 + O2;
в) NO2 → NO + O2;
г) Cu(NO3)2 → CuO + NO2 + O2;
д) AgNO3 → Ag + NO2 + O2;
е) Ag2CO3 → Ag + CO2 + O2.
Фотозавдання
- За поданими малюнками запишіть рівняння одержання кисню:
а) 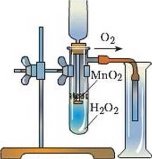 б)
б)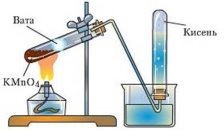 в)
в)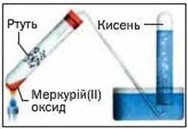
- Поясніть суть методів збирання кисню:
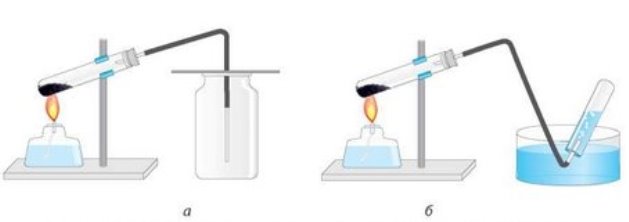
- Поясніть методи, які зображені на малюнку:

2.4 Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення.
Завдання
- Допишіть рівняння реакції горіння і розставте коефіцієнти:
а) C + O2 = д) Fe + O2 =
б) H2 + O2 = е) Cu + O2 =
в) S + O2 = є) P + O2 =
г) Mg + O2 = ж) Al + O2 =
- Допишіть формули простих речовин у схема реакцій і складіть хімічні рівняння:
а) … + … = CaO;
б) … + … = As2O3;
в) … + … = Li2O;
г) … + … = NO.
2.5 Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)
Завдання
- Складіть формули оксидів за назвами:
а) натрій оксид; е) хром (ІІІ) оксид;
б) купрум (ІІ) оксид; є) кальцій оксид;
в) стибій (V) оксид; ж) карбон (ІV) оксид;
г) ферум (ІІІ) оксид; з) фосфор (V) оксид;
д) хлор (ІV) оксид; и) алюміній оксид.
- З наведеного переліку випишіть формули оксидів і назвіть їх:
ZnO, HBr, P2O5, Cu(OH)2, Ca3(PO4)2, Ba(OH)2, SO2, H2SO4, H3PO4, Cu(OH)2, Na2O, HNO3, P2O5, Al2(SO4)3, KOH, SO3
- Гра «Хрестики-нулики»
а)
|
P2O5 |
NН3 |
H3PO4 |
|
Cu(OH)2 |
СО2 |
С7Н12 |
|
KOH |
HBr |
Н2О |
б)
|
CO |
Al2O3 |
SiO2 |
|
MgO |
P2O5 |
Na2O |
|
CuO |
Cl2O7 |
SO3 |
- Напишіть всі можливі формули оксидів Нітрогену. Обчисліть масові частки Оксигену в кожному оксиді та розмістіть в порядку зростання масових часток.
Фотозавдання
- Охарактеризуйте явища повільного окиснення:
а)  б)
б)
в) г)
г)
- Охарактеризуйте явища швидкого окиснення:
а)  б)
б) в)
в)
2.6 Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози). Умови виникнення та припинення горіння.
Завдання
- Перетворіть схеми реакцій на хімічні рівняння:
а) PH3 + O2 = д) Н2S + О2 =
б) СS2 + О2 = е) SO2 + O2 =
в) C12H22O11 + O 2 = є) CuS + O2 =
г) ZnS + O2 = ж) CuFeS2 + O2 =
- Усі органічні речовини, що містять Карбон і Гідроген, при окисненні утворюють карбон (IV) оксид СО2 і воду Н2О. Напишіть рівняння реакцій горіння речовин, що мають такі формули: C2H2, C4H8, C6H6, CH4, C6H12.
- Заповніть таблицю:
|
Ознака |
горіння |
повільного окиснення |
|
Спільна |
|
|
|
Відмінна |
|
|
|
|
|
|
Фотозавдання
- Поясніть методи припинення горіння, які зображені:
а) 


г) 
2.7 Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню
Завдання
- Зобразіть схему «Колообіг Оксигену в природі».
- Зобразіть схему «Застосування та біологічна роль кисню».
- Запропонуйте альтеративні заходи, щодо збереження чистоти повітря.
- Прийом «Асоціативний кущ»
![]() Поступово біля стрілочок записати все, що пригадали про озон.
Поступово біля стрілочок записати все, що пригадали про озон.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
- Поясніть тезу: «Кисень виступає в природі і як будівельник, і як руйнівник».
Фотозавдання
- Розгляньте та прокоментуйте малюнок, на якому зображено використання кисню:
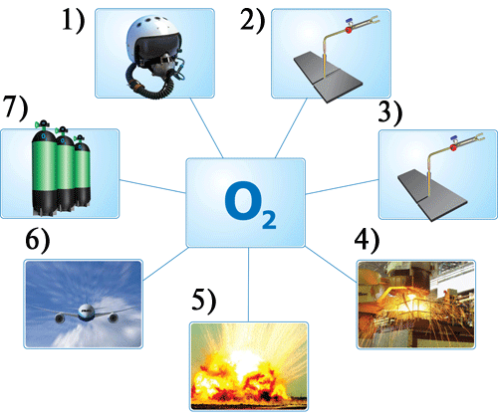
Тема 3. Вода
3.1 Вода, склад молекули, поширеність у природі, фізичні властивості. Вода – розчинник.
Завдання
- Визначте масове відношення хімічних елементів у воді.
- Обчисліть масові частки елементів у воді.
- Напишіть рівняння хімічних реакцій, серед продуктів яких вода.
- Робота в групах.
Завдання: за допомогою пластиліну двох кольорів зробити чотири молекули води і розташувати їх на аркуші картону. Першій групі – воду в твердому стані, другій – рідкому, третій – газоподібному. Зробіть відповідні висновки.
- Написати твір-мініатюру «Вода – чарівниця».
- Підготувати короткі повідомлення:
а) вода в народній творчості (прислів’я, приказки, тощо);
б) цікаве про воду.
- Вправа «Асоціативний кущ»
Поступово біля стрілочок написати все, що вам відомо про воду.
![]()
![]()

![]()
![]()
![]()
![]()
![]()
3.2 Розчин і його компоненти: розчинник, розчинена речовина
Завдання
- Назвіть рідини та гази, які добре розчинні у воді.
- Наведіть приклади розчинів, які трапляються в повсякденному житті.
- Яка вода в природі є найчистішою? Чому?
- Яку речовину назвете розчинником, а яку – розчиненою речовиною, якщо компонентами розчину є:
а) розплавлені мідь масою 3 г і золота масою 7 г;
б) етиловий спирт масою 10 г і ацетон масою 25 г;
в) вода масою 30 г і оцтова кислота масою 70 г;
г) розплавлені алюміній масою 4 г і олово масою 12 г;
д) етиловий спирт масою 96 г і вода масою 4 г.
- Вправа «Розумний куб»
Запитання:
- Що таке розчин?
- Як можна класифікувати прозорі та непрозорі розчини?
- Як ви вважаєте: розчин – це суміш чи хімічна сполука
- Чим відрізняються однорідні суміші від неоднорідних?
Фотозавдання
- Вкажіть речовини, які розчиняються у воді:
а)  б)
б)  в)
в)
г) д)
д) е)
е)
є) ж)
ж) з)
з)
3.3 Кількісний склад розчину.
Масова частка розчиненої речовини. Виготовлення розчину.
Завдання
- Обчисліть масу розчину (в грамах), для приготування якого використали:
а) 200 мл води і 0,05 кг солі;
б) 2 кг калій хлориду KCl і 1 л води;
в) 0,07 л води і 2 г барій хлориду BaCl2;
г) 300 см3 води і 60 г цукру;
д) 0,04 дм3 води і 0,1 кг хлороводню HCl.
- Обчисліть масову частку розчиненої речовини у розчинах, одержаних розчиненням:
а) 20 г калій хлориду KCl у 200 г води;
б) 5 г кухонної солі NaCl у 80 мл води;
в) 0,2 т цукру у 1 м3 води;
г) 60 г купрум (ІІ) сульфату CuSO4 у 300 мл води;
д) 0,5 кг калій гідроксиду KOH у 400 г води.
- Обчисліть масу розчиненої речовини та води, необхідних для приготування:
а) 300 г розчину з масовою часткою солі 13%;
б) 250 г розчину з масовою часткою оцтової кислоти 6%;
в) 150 г розчину з масовою часткою цукру 25%;
г) 160 г розчину з масовою часткою калій нітрату KNO3 15%;
д) 340 г розчину з масовою часткою натрій сульфату Na2SO4 10%.
- До 200 г розчину з масовою часткою солі 15% додали 40 г кристалічної солі. Визначте масову частку солі в утвореному розчині.
- Лаборант приготував 120 г розчину, в якому масова частка солі становить 6%. Скільки води потрібно додати до цього розчину, щоб отримати розчин з масовою часткою солі 4%.
- До 300г розчину калій сульфату з масовою часткою солі 20% додали 100 г води. Обчисліть масову частку солі в одержаному розчині.
- Злили 50 г розчину з масовою часткою розчиненої речовини 2% і 150 г розчину з масовою часткою 4%. Обчисліть масову частку розчиненої речовини в новоутвореному розчині.
- Обчисліть відношення мас розчинника і розчиненої речовини у таких розчинах:
а) 160 г розчину солі з масовою часткою солі 0,125;
б) 210 г розчину цукру з масовою часткою цукру 14,3%;
в) 300 г розчину калій нітрату з масовою часткою солі 8%;
г) 350 г розчину натрій хлориду з масовою часткою солі 0,53;
д) 175 г розчину магній сульфату з масовою часткою солі 0,03.
Фотозавдання
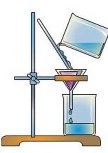
- Розгляньте хімічне обладнання, необхідне для приготування розчину. Укажіть кожний предмет.
а)  б)
б) в)
в)
г) д)
д) е)
е)
- Складіть умову задачі згідно з малюнками і розв’яжіть її:
а) 
б) 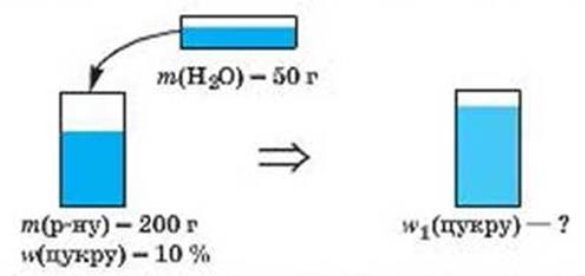
- Розгляньте етикетки на пляшечках. Поясніть записи:
а)  б)
б) в)
в)
г) д)
д)  е)
е)
є) ж)
ж) з)
з)
3.4 Взаємодія води з оксидами. Поняття про кислоти й основи. Поняття про індикатори.
Завдання
- Допишіть схеми реакцій і складіть хімічні рівняння. Серед продуктів укажіть кислоти та основи:
а) Li2О + Н2О →… е) Na2O + Н2О →…
б) N2O5 + Н2О → … є) I2O5 + Н2О → …
в) Р2О5 + Н2О → … ж) CO2 + Н2О → …
г) ВаО + Н2О → … з) SO2 + Н2О → …
д) Сl2O7 + Н2О → … и) SrO + Н2О → …
- Обчисліть відносні молекулярні маси кислот: сульфатної, нітратної, карбонатної. Обчисліть масову частку Оксигену в цих кислотах.
- Хлор утворює кілька кислот: HCl, HClO, HClO2, HClO3. Обчисліть відносні молекулярні маси кислот. Доведіть розрахунками, у якій кислоті масова частка Хлору більша.
- Яку масу натрій гідроксиду потрібно розчинити в 3 л води, що виготовити розчин із масовою часткою 0,2?
- Елемент знаходиться в І групі періодичної системи хімічних елементів Д.І. Менделєєва. Відносна маса його гідроксиду має однакове значення з відносною атомною масою з порядковим номером 20. Назвіть елемент, запишіть формулу гідроксиду.
- Оксид неметалічного елемента Е утворює кислоту Н2ЕО3, масова частка Оксигену в якій становить 58,54 %. Назвіть елемент, складіть формулу кислоти.
- Оксид невідомого металічного елемента з постійною валентність ІІ прореагував з водою. Утворився луг з відносною молекулярною масою 74. Назвіть металічний елемент та запишіть рівняння утворення лугу.
- Напишіть рівняння хімічних реакцій, як, виходячи лише з простих речовин, можна одержати карбонатну кислоту.
- Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення. Укажіть типи реакцій:
а) KNO3 → O2 → Na2O → NaOH;
б) KClO3 → O2 → BaO → Ba(OH)2;
в) S → SO2 → H2SO3;
г) KMnO4 → O2 →P → P2O5 → H3PO4.
- Чи можна використати індикатор для розпізнавання двох твердих оксидів, один з яких є сполукою металічного елемента, а інший – сполукою неметалічного елемента? Якщо можна, то – завжди чи лише в певних випадках (яких)? Як ви проведете відповідних експеримент?
- Обчисліть масу калій гідроксиду й об’єм води, які необхідно взяти для приготування 300 г розчину з масовою часткою лугу 30 %.
Фотозавдання
- Розгляньте забарвлення індикаторів у розчині кислоти (а), воді (б), розчині лугу (в) та назвіть їх:
а) 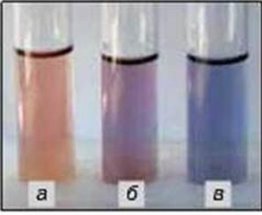 б)
б) 
в)  г)
г) 
- Розгляньте малюнки та назвіть індикатор, який використовують у кожному з випадків:
![]()
![]() а)
а) б)
б) в)
в)
г) д)
д) е)
е)
- Визначте, яка речовина в пробірках, якщо індикатори змінили забарвлення:
а)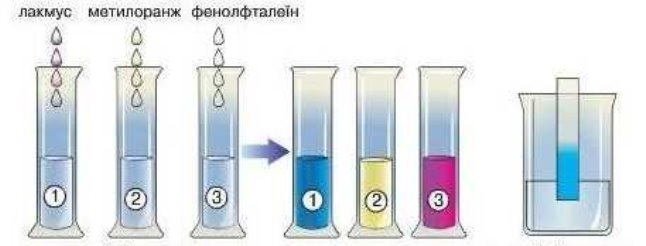
б) 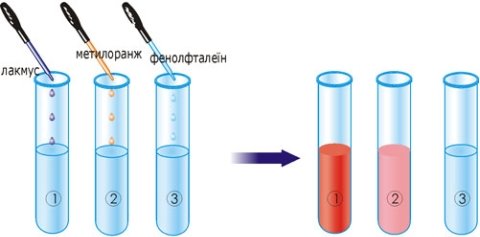
- Поясніть, чому відбулися зміни забарвлення універсального індикаторного папірця:

3.5 Значення води і водних розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення. Очищення води на водоочисних станціях та в домашніх умовах.
Завдання
- Вправа «Дерево рішень»
Завдання: на Землі дуже багато води. Чому ж людство потерпає від її нестачі? Назвіть основні фактори, що роблять воду непридатною для використання.
- З’ясуйте, які засоби побутової хімії використовуються у вас вдома. Яка загальна маса цих засобів витрачається щомісяця? Куди потрапляють залишки від їх використання?
- Охарактеризуйте, способи очищення води в побуті та в промисловості.
- Заповніть схему:

Фотозавдання
- Опишіть процеси зображені на малюнках:
а) 
б)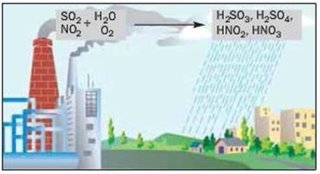
в)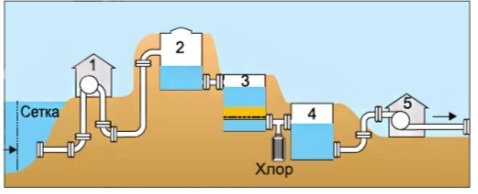
Список використаних джерел:
- Дячук Л.С., Гладюк М.М. Хімія: підручник для 7 кл. загальноосвіт. навч. закл. /Л.С. Дячук, М.М. Гладюк. – Тернопіль: Навчальна книга – Богдан, 2015. – 240 с.: іл.
- Попель П.П., Крикля Л.С. Хімія: підр. для 7 кл. загальноосвіт. навч. закл. / П.П. Попель, Л.С. Крикля. – К. : ВЦ «Академія», 2015. – 192 с. : іл..
- Березан О. Хімія. Робочий зошит-посібник. 7 клас / О. Березан. – Тернопіль : Підручники і посібники, 2016. – 128 с.
- Буринська Н.М. Хімія, 8 кл.: Підручник для загальноосвіт. навч. закл. – К.; Ірпінь: ВТФ «Перун», 2008.
- Березан О. Хімія. Комплексна підготовка до ЗНО / О. Березан. – Видання 3-тє, виправлене і доповнене – Тернопіль : Підручники і посібники, 2018. – 384 с.
- Попель П.П., Крикля Л.С. Хімія: підр. для 7 кл. загальноосвіт. навч. закл. – К. : ВЦ «Академія», 2007. – 136 с. : іл..
Інтернет-сайти:
- mon.gov.ua;
- http://chemists.at.ua;
- https://www.google.com
![]()
1
-
дякую!
-


про публікацію авторської розробки
Додати розробку

