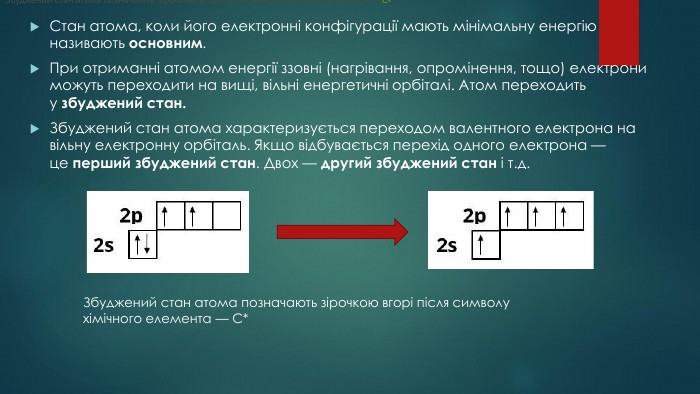
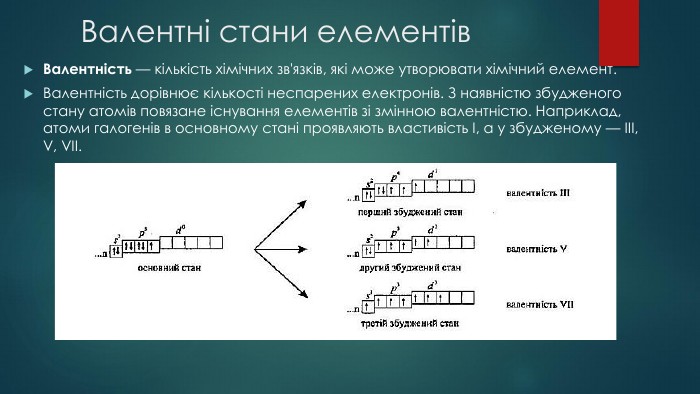
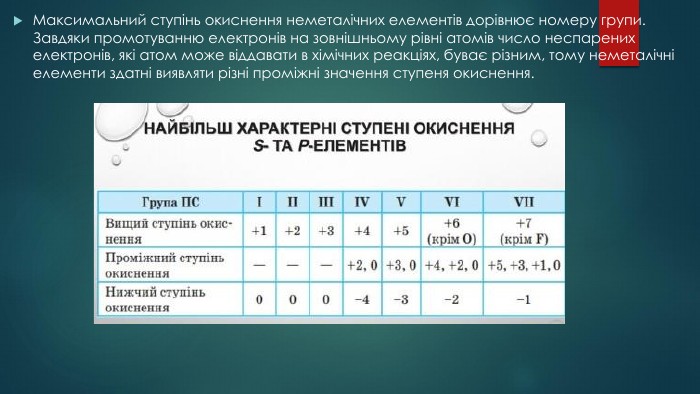
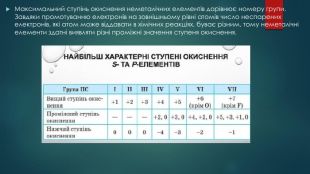
Збуджений стан атома. Валентні можливості атомів ІІ-ІІІ періодів.
Про матеріал
Презентація до уроку "Збуджений стан атома. Валентні можливості атомів ІІ-ІІІ періодів." Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку