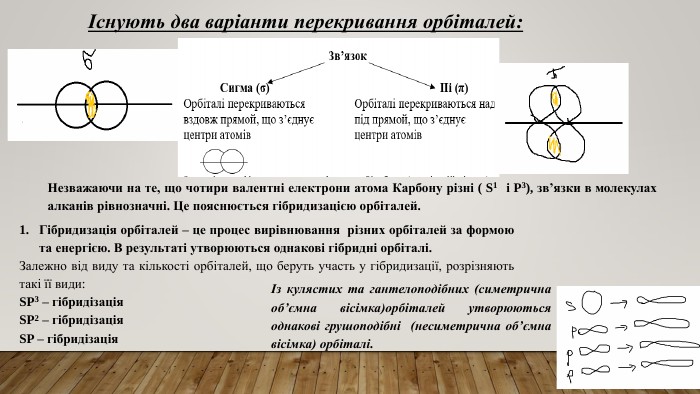
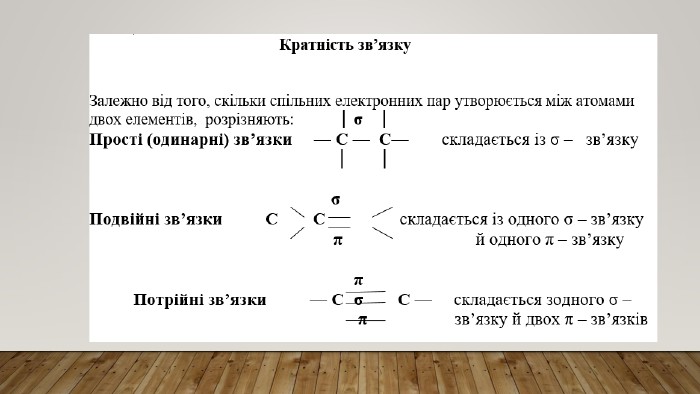
10 клас КОВАЛЕНТНІ КАРБОН-КАРБОНОВІ ЗВ’ЯЗКИ У МОЛЕКУЛАХ ОРГАНІЧНИХ СПОЛУК
Про матеріал
10 клас КОВАЛЕНТНІ КАРБОН-КАРБОНОВІ ЗВ’ЯЗКИ У МОЛЕКУЛАХ ОРГАНІЧНИХ СПОЛУК
містить завдання на повторення ізомерії і новий матеріал Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую. Ваша праця допомагає людям.
pptx
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку