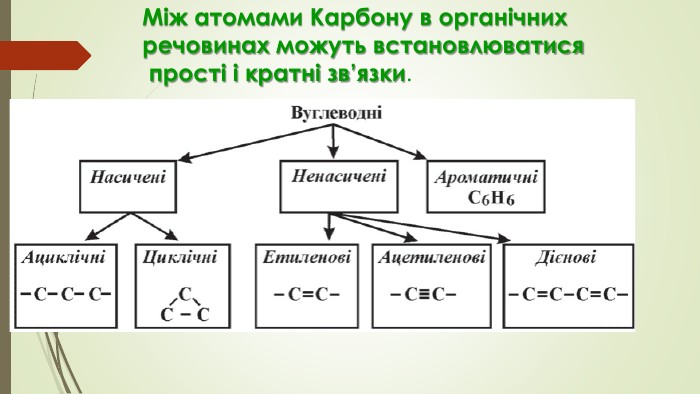
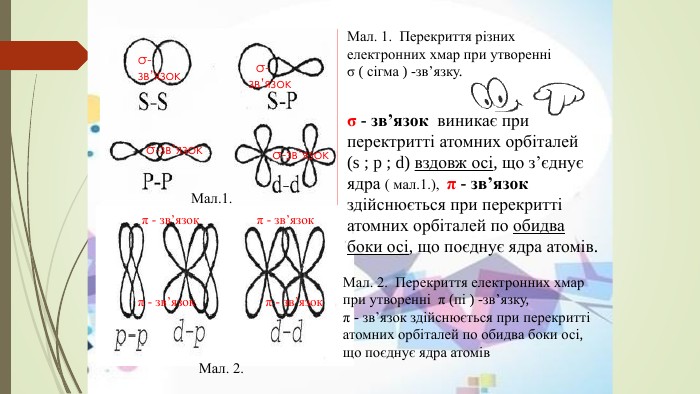
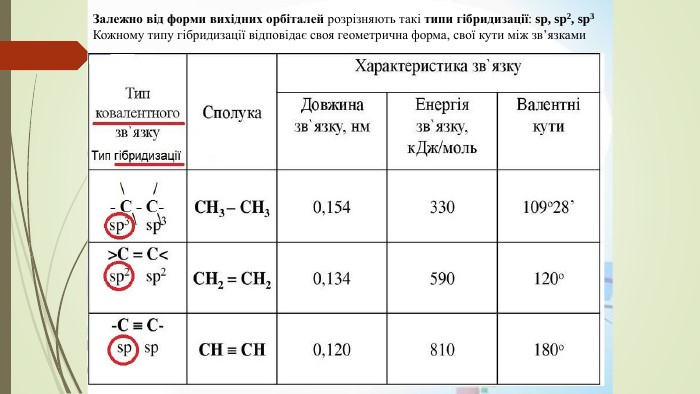
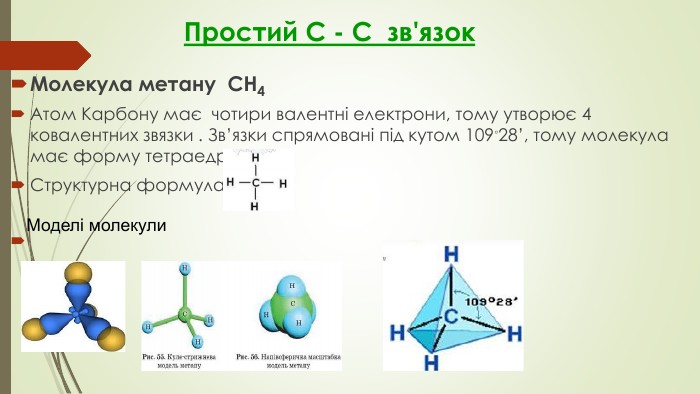
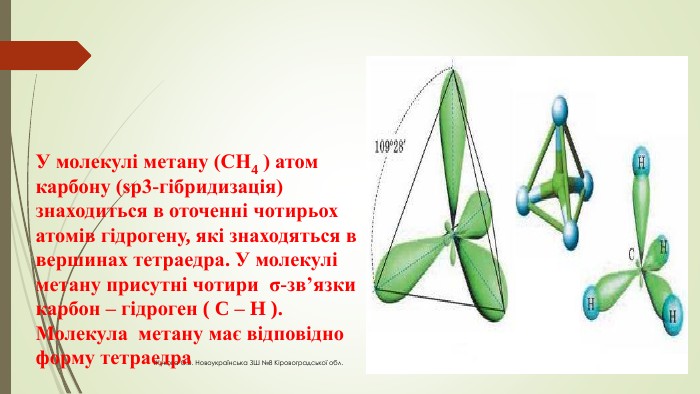
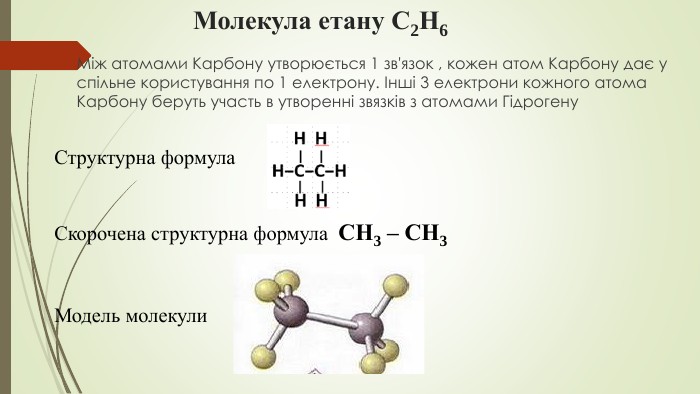
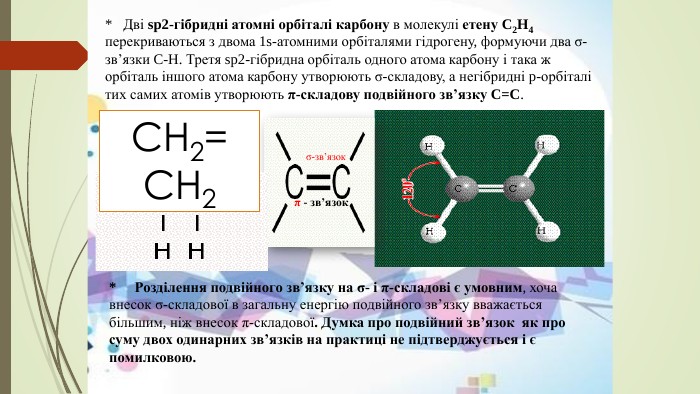
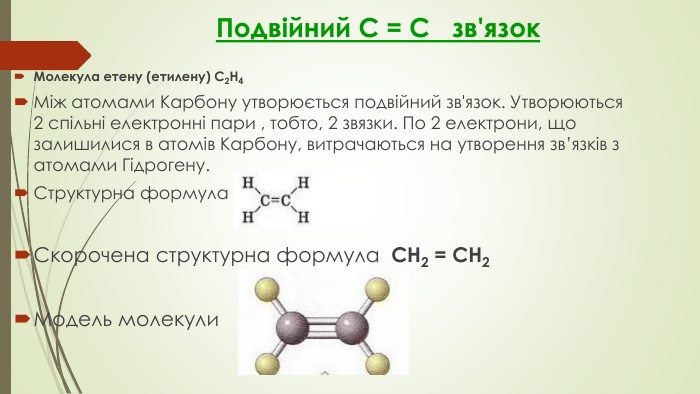
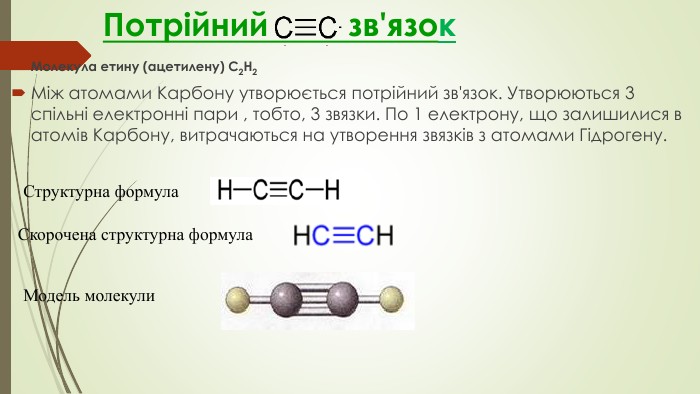
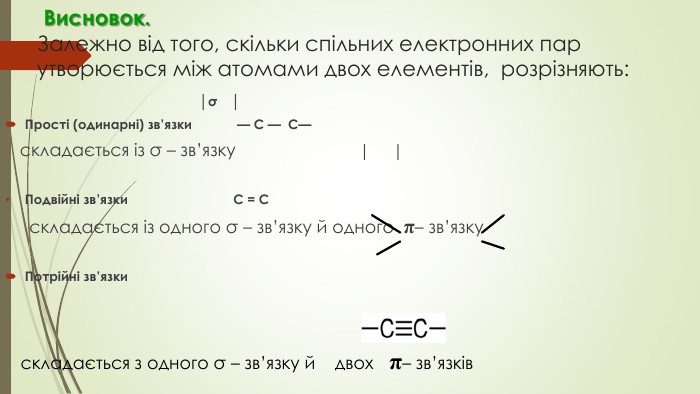
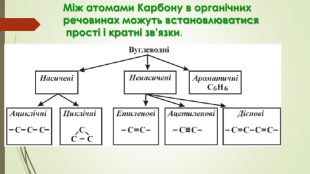
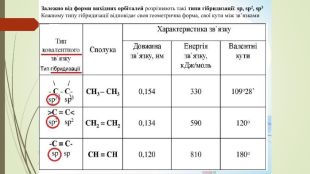
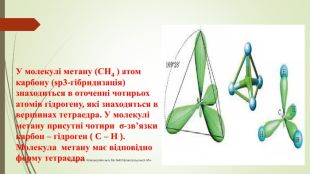
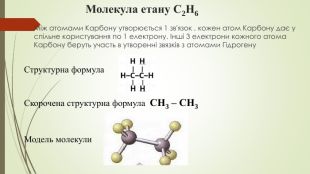
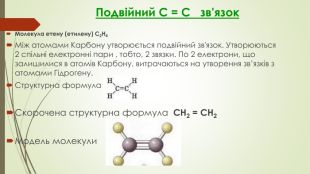
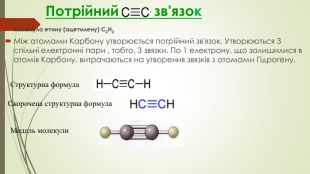
Презентація до уроку "Ковалентні карбон-карбонові зв’язки у молекулах органічних сполук: простий, подвійний, потрійний.."
Про матеріал
Презентація до уроку "Ковалентні карбон-карбонові зв'язки у молекулах органічних сполук: простий, подвійний, потрійний." є зручним матеріалом при викладанні під час дистанційного навчання. Матеріал викладено коротко, яскраво, доступно.
Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку