10клас_КОНКУРС_РОЗРОБКА УРОКУ З ТЕМИ: «ХІМІЧНИЙ ЕЛЕМЕНТ. АТОМ. ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ»
Розробка уроку подана на конкурс розробок
до інтегрованого курсу" Природничі науки" для 10 класу
Навчальний матеріал враховує знання базового компоненту з фізики, хімії основної школи. Трансформує та модифікує вже отримані знання, поглиблюючи та закріплюючи їх. Враховує потреби людини та суспільства щодо соціалізації наукових знань до повсякденного життя, не виключаючи при цьому потреби навколишнього середовища. Поряд з традиційними підходами гармонійно застосовуються інноваційні, враховуючи нові тренди в освіті. Урок побудований у контексті розвитку критичного мислення. Провідна ідея: формування висновків, спираючись виключно на власному досвіді. Дана розробка є трансформером та може бути адаптована під будь-який рівень сформованості знань учнів з урахуванням їх профільної направленості.
Чекаємо на Ваші відгуки!))
Всеукраїнський конкурс навчальних матеріалів до інтегрованого курсу «Природничі науки»,
2018-2019 н.р.
РОЗРОБКА УРОКУ З ТЕМИ:
«ХІМІЧНИЙ ЕЛЕМЕНТ. АТОМ.
ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ»
10 клас
Навчальна програма до інтегрованого курсу: «Природничі науки» для закладів загальної середньої освіти під керівництвом авторського колективу під керівництвом Засєкіної Т. М.
ІНФОРМАЦІЯ ПРО АВТОРІВ
Автор: Стеблич Галина Федорівна, учитель хімії Комунального закладу освіти «Гімназія №3» Дніпровської міської ради, вчитель вищої категорії, вчитель-методист, тел.- 099-954-94-99, e-mail- steblichgal@gmail.com
Співавтор: Довгаль Олена Сергіївна, учитель фізики Комунального закладу освіти «Гімназія №3» Дніпровської міської ради, вчитель вищої категорії, старший вчитель, тел.- 050-101-25-39, e-mail- dovgalbird@gmail.com
КОРОТКИЙ ОПИС МАТЕРІАЛУ
Навчальний матеріал враховує знання базового компоненту з фізики, хімії основної школи. Трансформує та модифікує вже отримані знання, поглиблюючи та закріплюючи їх. Враховує потреби людини та суспільства щодо соціалізації наукових знань до повсякденного життя, не виключаючи при цьому потреби навколишнього середовища. Викладення навчального матеріалу вдало поєднує минуле, майбутнє та сьогодення. Поряд з традиційними підходами гармонійно застосовуються інноваційні, враховуючи нові тренди в освіті. Урок побудований у контексті розвитку критичного мислення. Провідна ідея: формування висновків, спираючись виключно на власному досвіді. Дана розробка є трансформером та може бути адаптована під будь-який рівень сформованості знань учнів з урахуванням їх профільної направленості.
Всеукраїнський конкурс навчальних матеріалів до інтегрованого курсу «Природничі науки»,
2018-2019 н.р.
Автор: Стеблич Галина Федорівна,
учитель хімії Комунального закладу освіти
« Гімназія №3» Дніпровської міської ради,
вчитель вищої категорії, вчитель-методист
Співавтор: Довгаль Олена Сергіївна,
учитель фізики Комунального закладу освіти
« Гімназія №3» Дніпровської міської ради,
вчитель вищої категорії, старший вчитель
Тема: Хімічний елемент. Атом. Періодична система хімічних елементів
Мета: розглянути будову атома, враховуючи еволюцію її розвитку, а також народження хімічних елементів та їх класифікації, враховуючи базові знання з курсу фізики та хімії основної школи; пояснити взаємозв’язок між положенням елемента в періодичній системі та характером сполук; розвивати вміння застосовувати отримані знання у повсякденному житті
Компетенції учнів на уроці: критичне мислення, креативність, дизайн-мислення, вміти організовувати свою роботу; командна робота, вміти знаходити нові рішення; навчання протягом життя
Тип уроку: урок вивчення нового матеріалу
Обладнання: мультимедійний комплекс, Internet, обладнання для проведення дослідів
Дидактичні та методичні матеріали: інтерактивні вправи, медіа супровід, відео експерименти
План та хронометраж уроку:
|
Організація класу |
2хв |
Вступне слово вчителя Вправа на активізацію роботи мозку |
|
Виклик, або вступна частина уроку |
2хв 3хв |
Вступне слово вчителя Виконання тестових завдань
|
|
Осмислення, або основна частина уроку
|
4хв 15хв 10хв |
Робота в групах над створення глосарію Виконання завдань в гетерогенних групах Обговорення, доповнення, коригування та формулювання висновків |
|
Рефлексія, або підбиття підсумків |
7хв |
Розв’язування завдань на розвиток критичного мислення |
|
Домашнє завдання |
2хв |
Пояснення, формування завдання з урахуванням результатів рефлексії |
Хід уроку:
- Організація класу
Отже, погодься: оскільки існують означені чітко
Первісні тільця, що завжди свою зберігають природу,
Що і відходом своїм, і приходом, і різним порядком
Різною роблять природу речей і зумовлюють зміни…
Тіт Лукрецій Кар
Хімічний елемент намагається пояснити властивості речовини, їх зміну. Урізноманітнення навколишнього світу має свій особливий порядок, що пояснює протікання того чи іншого процесу.
Виконання кінезіологічної вправи: «Лобно-потиличний обхват»
(допомагає зосередитися та налаштуватися на навчальний процес, тому чудово підходить для виконання на початку уроку)
Попросіть учнів сісти рівно, а потім покласти одну долоню на лоба, іншу – на потилицю. Потім треба заплющити очі, сконцентруватися на майбутньому занятті та зробити кілька глибоких вдихів-видихів.
- Виклик
Виклик є вступною частиною уроку з розвитку критичного мислення.
За час «виклику» відбувається актуалізація опорних знань, уявлень, умінь, пов’язаних з темою уроку, виявляються прогалини, формується контекст для сприйняття нових ідей; зацікавленість у процесі навчання.
Д. І. Менделєєв був не першим, хто сказав про періодичність змін властивостей хімічних елементів. Але він першим сформулював періодичний закон та застосував його на практиці: передбачив існування декількох елементів, які на той час ще не відкрили.
У 8 класі ви вивчали Періодичний закон: Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їхніх атомних ядер.
Що ви знаєте про графічний вираз періодичного закону? (періодична система – графічний вираз періодичного закону)
2019 рік - Міжнародний рік періодичної системи
У 8 класі на хімії ви вивчали тему: «Періодичний закон і періодична система хімічних елементів. Будова атома», а на фізиці у 7, 8, 9 класах розглядаючи агрегатні стани речовини, електростатику та електричний струм, фізику атома та атомного ядра. Давайте перевіримо, що ви засвоїли з даної теми.
Виконання тестових завдань за допомогою google form Що я знаю про атом!)
На заповнення google form пропонується 1 хв. Після чого результати у вигляді діаграм оприлюднюються на екрані мультимедійної дошки. Це дасть змогу учителеві зорієнтуватися щодо перерозподілу часу при поясненні нового матеріалу.
- Осмислення
Осмислення є основною частиною уроку, за яку учні «власноруч» отримують знання та навички, формують власне ставлення до питань, що розглядають. Досвід неодмінно повинен бути спочатку, лише потім обмін думками: формування дизайн-мислення
Тема уроку: Хімічний елемент. Атом. Періодична система хімічних елементів.
- Для вивчення теми Ви повинні володіти термінами
Завдання: Створіть глосарій термінів (атом, нуклід, хімічний елемент, ізотопи, електронегативність, енергія іонізації, електронна спорідненість)
Робота виконується в групах, використовуються власні гаджети, інтернет джерела
Очікувані відповіді:
Атом – електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Нуклід – це різновид атомів із певним числом протонів і нейтронів у ядрі.
Хімічні елементи – це нукліди з однаковим зарядом ядра.
Ізотопи – це різні нукліди одного хімічного елемента.
Енергія іонізації – мінімальна енергія, що потрібна для відриву електрона від атома, який знаходиться в стаціонарному стані.
Спорідненість до електрона – це енергетичний ефект процесу приєднання електрона до нейтрального атома з перетворенням його в негативно заряджений іон.
Електронегативність – це узагальнена функція, що характеризує здатність атома даного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів тієї самої сполук.
- Клас поділяється на гетерогенні групи (5 учнів у групі). Кожна група отримує завдання для опрацювання. Час на виконання завдання – 10хв
І група. Історики
Познайомитися з історією вивчення будови атома. Переглянути Youtube канал « Діти науки»- відео презентація "Історія розвитку уявлень про будову атома Липки Оксани учениці КЗО"Гімназія№3"ДМР та створити схему
Очікувані результати:
Атом Демокріта ------ Атом професора Алексеева, початок XIX ст. Будова атома схожа до будови Сонячної системи. ------ Атом Томсона (Кельвіна), 1902 р. Сфера, в яку вбудовані негативні заряди. ----- Атом Ленарда, 1903 р. «Динаміди» - об’єднання електронів і масивного позитивно зарядженого тіла. ------ Атом Нагаока, 1904 р. Навколо позитивно зарядженого ядра розподілені електрони. Під час коливань вони випромінюють енергію ------ Атом Резерфорда, 1911 р. Навколо позитивно зарядженого ядра по коловим орбітам рухаються електрони.------ Атом Н. Бора, 1911р. Електрони рухаються навколо ядра по коловим стаціонарним орбітам. Перехід на вищу орбіту супроводжується поглинанням фотона, а на нижчу — випромінюванням ----- Сучасна модель
ІІ група. Фізики
Будова ядра атома. Нуклід. Ізотопи
Те, що атомне ядро має складну будову, було теоретично доведено на початку XX століття. Експериментально першими це довели англійські вчені Е. Волтон і Д. Кокрофт. Вони расщепили ядро атома Літію у квітні 1932 року. Але лише п’ять місяців по тому 10 жовтня 1932 року цей експеримент блискуче повторили вчені А. К. Вальтер, Г. Д. Латишев, О. І. Лейпунський, К. Д. Синельников на базі Українського фізико-технічного інституту (зараз — Національний науковий центр «Харківський фізико-технічний інститут»). 10 жовтня 2002 року перед головним будинком ННЦ «ХФТІ» було відкрито пам’ятник на честь 70-річчя розщеплення атомного ядра.
Очікувані результати:
- Розумітися на будові ядра атома (масове та зарядове число, нуклон)
- Розрізняти поняття хімічний елемент , нуклід
- Вміти користуватися періодичною системою хімічних елементів для запису електронної формули нукліда
- Давати фізичну характеристику впливу кількості нейтронів у ядрі, ізотопу
- Описувати властивості радіонукліду, умови його виникнення
ІІІ група. Біологи
Вплив радіоактивного випромінювання на живі організми (робота з інформацією)
Переглянути Youtube канал «Діти Науки» відеоролик Полосіної Олександри « Природний радіаційний фон. Радіонукліди»
Очікувані результати:
- Розрізняти природний радіаційний фон від штучного
- Розумітися на понятті радіоактивності та захисту від неї
- Біологічна дія радіоактивного випромінювання
- Виокремлювати біологічні наслідки дії радіації
ІV група. Хіміки
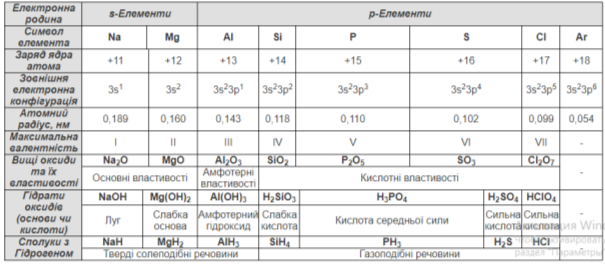
Схарактеризувати закономірності змін властивостей хімічних елементів залежно від положення елемента в періодичній системі на прикладі елементів ІІІ періоду
- Кількість енергетичних рівнів
- Кількість електронів на останньому енергетичному рівні
- Радіус атома
- Електронегативність
- Енергія іонізації
- Електронна спорідненість
- Зміна металічних та неметалічних властивостей
Пояснити, як положення хімічного елемента в періодичній системі впливає на властивості його вищих оксидів та їхніх гідратів
Очікуваний результат роботи:
|
Кількість енергетичних рівнів |
Залишається такою самою |
|
Кількість електронів на останньому енергетичному рівні |
Збільшується від одного |
|
Радіус атома |
Збільшується |
|
Електронегативність |
Збільшується |
|
Енергія іонізації |
Збільшується |
|
Електронна спорідненість |
Збільшуються |
|
Зміна металічних та неметалічних властивостей |
Металічні властивості елементів послаблюються, а неметалічні — посилюються |
У періоді зі збільшенням порядкового номера: відновні властивості послаблюються, а окисні — посилюються
Оформлення таблиці (див. Додаток 1.)
Посилення кислотних властивостей оксидів та гідратів оксидів; послаблення основних властивостей.
V група. Хіміки
Проаналізувати, як положення хімічних елементів впливає на властивості простих і складних речовин на прикладі елементів І групи (лужні метали) та VІІ групи (галогени)
- Кількість енергетичних рівнів
- Кількість електронів на останньому енергетичному рівні
- Радіус атома
- Електронегативність
- Енергія іонізації
- Електронна спорідненість
- Зміна металічних та неметалічних властивостей
Очікуваний результат роботи:
|
Кількість енергетичних рівнів |
Збільшується |
|
Кількість електронів на останньому енергетичному рівні |
Залишається такою самою |
|
Радіус атома |
Зростає |
|
Електронегативність |
Зменшується |
|
Енергія іонізації |
Зменшується |
|
Електронна спорідненість |
Зменшується |
|
Зміна металічних та неметалічних властивостей |
Металічні властивості посилюються, а неметалічні властивості елементів послаблюються |
Відновні властивості посилюються, а окисні послаблюються. Посилення металічних властивостей для лужних металів. Послаблення неметалічних властивостей для галогенів.
- Обговорення результатів роботи, доповнення, коригування
Скласти узагальнюючі схеми. Сформулювати висновок
Очікувані висновки:
- Склад атома безпосередньо або опосередковано зашифровано в Періодичній системі хімічних елементів.
- Будова зовнішнього енергетичного рівня атомів зумовлює можливі валентні стани та ступені окиснення хімічних елементів, а отже, й можливі хімічні сполуки, які вони утворюють.
- Металічні властивості елементів однієї підгрупи найсильніше виражені в елементів із найбільшим радіусом (найбільшим порядковим номером), а неметалічні — в елементів із найменшим радіусом
- Періодичність змін властивостей хімічних елементів та їхніх сполук пов’язана з періодичністю повторюваності електронної будови атомів
- Рефлексія
Завдання на розвиток критичного мислення
- Поясніть один із законів діалектики: «Перехід кількості в якість»
- Відео запитання. Чи існує зв'язок між світом атомів і зірок?
(відеоролик розглядається до половини його часу, а друга половина на самостійне опрацювання вдома, по бажанню)
- Охарактеризуйте причинно-наслідкові зв’язки між характером вищих оксидів та гідратів вищих оксидів елементів та положенням елементів у періодичній системі на прикладі елементів ІІ періоду
- Домашнє завдання:
Використовуючи додаткові джерела інформації, проаналізуйте експеримент Резерфорда з визначення будови атома. Які результати цього досліду дозволили йому зробити висновки про планетарну будову атома?
Францій і Флуор – рекордсмени за багатьма властивостями. Обгрунтуйте твердження.
Як Ви вважаєте зміною яких властивостей елементів можна пояснити зміну металічних та неметалічних властивостей речовин?
- Список використаних джерел
|
№ з/п |
Назва ресурсу |
|
|
Природничі науки 10-11 (авторський колектив під керівництвом Засєкіної Т.М.) |
|
|
|
|
|
|
|
|
|
|
5. |
Як розвивати критичне мислення в учнів, Олена Пометун, член-кореспондент НАПН України |
|
6. |
|
Додаток 1.


про публікацію авторської розробки
Додати розробку
