Адсорбція із розчинів
КУРСОВА РОБОТА
Тема роботи: Адсорбція із розчинів
Харків – 2020
РЕФЕРАТ
Курсова робота: 30 с., рис. - 2, 10 літературних джерел.
Об’єкт дослідження – адсорбція із розчинів.
Мета роботи – провести аналіз літературних джерел із вказаної теми.
В даній роботі проведений аналіз теоретичного матеріалу, щодо становлення і досягнення найважливішої області колоїдної хімії – адсорбційних явищ. Розглянута загальна характеристика і фізико-хімічні параметри адсорбції із розчинів та їх застосування в науці та виробництві.
АДСОРБЦІЯ, АДСОРБЕНТ, АДСОРБТИВ, ІЗОТЕРМИ АДСОРБЦІЇ, ЕМПІРИЧНЕ РІВНЯННЯ ФРЕЙНДЛІХА, ПРАВИЛО ДЮКЛО-ТРАУБЕ
ЗМІСТ
ВСТУП 3
1 ТЕОРЕТИЧНІ ОСНОВИ АДСОРБЦІЇ З РОЗЧИНІВ 4
1.1 Загальна характеристика адсорбційних явищ 4
1.2 Адсорбція на межі поділу тверде тіло – рідини 8
1.3 Молекулярна адсорбція 10
1.4 Адсорбція електролітів з розчинів 13
1.5 Йоннообмінна адсорбція 15
1.6 Іоннообмінна хроматографія 20 2 ПРИКЛАДИ ВИКОРИСТАННЯ АДСОРБЦІЇ З РОЗЧИНІВ 23
ВИСНОВКИ 29
ПЕРЕЛІК ПОСИЛАНЬ 30
ВСТУП
Зародження наукового розуміння явища адсорбції пов’язують із першими публікаціями шведського хіміка К. Шеєле (1773) та італійського абата Ф. Фонтана (1777) про явище поглинання газів деревним вугіллям.
Процес адсорбції з розчинів на деревному вугіллі вперше описав 1785 російський фармацевт Т. Ловіц. Він застосував на практиці дане явище з розчинів для знебарвлення фармацевтичних препаратів, а також очищення горілки і питної води. Наступні дослідження Н. Сосюра (1814) адсорбції газів, а також розроблені Р. Острейком на початку 20 ст. в Німеччині технології отримання активовованого вугілля з кісткового борошна, деревини і торфу були покладені в основу організації його виробництва в деяких країнах і запровадження в процесах очищення цукрових сиропів та горілки, а також у медицині як антидоту при отруєнні й лікуванні багатьох захворювань.
Науковий термін «адсорбція» в сучасному розумінні запровадив 1881 р. Х. Кайзер. Термін «активоване вугілля» запропонував 1915 р. професор М. Зелінський, який був також ініціатором робіт щодо створення протигаза з активованим вугіллям для очищення повітря від бойових отруйних речовин. Найбільший внесок у науку про адсорбцію в 20 ст. зробили американські вчені І. Ленґмюр, Т. Гілл, англійські лорди Кельвін, Ф. Лондон, Дж. Макбен та Д. Еверетт, німці Г. Фрейндліх та Е. Геккель, голландець Дж. де Бур, угорці М. Поляні та С. Брунауер, росіяни М. Цвєт, М. Шилов, М. Дубинін та А. Кисельов.
Метою даної курсової роботи є літературний огляд адсорбції з розчинів, описання фізико-хімічних параметрів даного явища та його застосування в науці та виробництві.
1 ТЕОРЕТИЧНІ ОСНОВИ АДСОРБЦІЇ З РОЗЧИНІВ
1.1 Загальна характеристика адсорбційних явищ
Адсорбція (від лат. ad – на, при і sorbeo – поглинаю) – концентрування і достатньо міцне утримування речовин (адсорбатів, адсорбтивів) із газової фази чи розчинів на поверхні твердих тіл (адсорбентів) або на межі поділу (поверхні) рідин. Вона є окремим випадком ширшого поняття – сорбція, яке охоплює також абсорбцію – поглинання речовин в об’ємі рідини чи твердого тіла. Зумовлюється тими самими міжмолекуляр. силами (вандерваальсові взаємодії, диполь-дипольні взаємодії, водневий зв’язок та ін.), що діють у рідинах чи твердих тілах.
Нескомпенсованість цих сил на межі поділу, тобто наявність силового поля на поверхні, і є причиною адсорбції. Розрізняють фізичну адсорбцію, при якій молекули зберігають свою індивідуальність, і хемосорбцію, тобто утворення поверхневих сполук між речовиною, що адсорбується, та поверхнею адсорбенту.
Фізична адсорбція – процес оборотний і, як правило, супроводжується виділенням тепла. Вона зменшується при підвищенні температури (десорбція) та збільшується зі зростанням парціального тиску адсорбату чи підвищенням його концентрації в розчині. Хемосорбція ж, навпаки, зростає з підвищенням температури; при цьому хемосорбовані молекули втрачають свою індивідуальність.
Явище адсорбції на поверхні рідин і його взаємозв’язок зі змінами поверхневого натягу отримали вичерпну інтерпретацію в працях американського фізика Дж. Ґіббса (1876). Він установив також кількісний зв’язок між зміною поверхнего натягу та величиною адсорбції розчинених речовин на межі поділу газ–рідина чи рідина– рідина.
Адсорбція, як типовий масообміний процес, є вибірковою та зворотною. Для виділення поглинених компонентів і відновлення поглинальних властивостей адсорбентів у промисловості проводять процес десорбції - видалення поглиненої речовини з поверхні або з об'єму адсорбенту й виділення речовини в концентрованому чистому вигляді. Звичайно процеси адсорбції й десорбції реалізуються в адсорбційно-десорбційних установках.
Різновидом процесу адсорбції є іонний (йонний) обмін - процес вибіркового вилучення іонів (аніонів та катіонів) компонента з рідин і розчинів поверхнею адсорбенту або іоніту.
В основу процесів адсорбції покладені закони фізико-хімічної й дифузійної взаємодії молекул речовини з молекулами й поверхнею твердих тіл - адсорбентів. Характер міжмолекулярної взаємодії на межі розділу фаз визначає механізм процесу адсорбції.
Адсорбційна здатність більшою або меншою мірою є характерною для багатьох твердих пористих матеріалів - адсорбентів, однак, для вилучення з газової суміші цільового компонента, як правило, вибирають адсорбент із високою активністю, під якою розуміють масу цільового компонента, поглиненого одиницею маси або об'єму адсорбента в умовах рівноваги. Характеристикою активності адсорбента є поглинальна здатність - ємність адсорбенту, що дорівнює:
ai = mi / Ga, (1.1)
де mi - маса поглиненого цільового компонента;
Ga - маса адсорбента.
Поглинальна здатність адсорбентів залежить від багатьох факторів, основними з яких є: природа адсорбента і його фізико-хімічні властивості (густина, розмір часток, пористість і діаметр пор, питома поверхня та ін.), фізичні параметри процесу (температура й тиск), а також фізико-хімічні властивості речовини, що поглинається.
Адсорбенти повинні задовольняти таким основним вимогам:
- забезпечувати можливо найбільшу поглинальну здатність;
- проявляти високу селективність - здатність вибіркового вилучення цільового компоненту, не поглинаючи інших;
- мати високу механічну міцність, що дозволяє проводити багаторазову регенерацію адсорбенту;
- бути недорогими і доступними, легко піддаватися регенерації.
У промисловості як адсорбенти найбільш часто застосовують штучно приготовлені речовини: активоване (активне) вугілля; алюмогелі й силікагелі; цеоліти та інші природні і штучно виготовлені матеріали.
Активне вугілля виготовляють із різних вуглецевовмісних матеріалів за допомогою їх високотемпературної термічної обробки без доступу повітря. Як сировину для одержання активованого вугілля використовують деревину різних сортів (сосну, березу, дуб та ін.), плодові кісточки, кам'яне й буре вугілля, кістки й кров тварин, цукор та ін. У результаті термічної обробки матеріалів відбувається їх обвуглювання й спучування, смолисті речовини випаровуються й вивітрюються, а кістякова структура вугілля стає досить пористою, утворюючи мікро- і макропори діаметром (5 - 200) 10-9 м. Отримане вугілля затим піддають додатковій спеціальній обробці - парогазовій (перегрітою парою, аміаком, двоокисом вуглецю і ін.) або хімічному активуванню солями, водно-сольовими розчинами й розчинами кислот.
Виготовляється активоване вугілля у вигляді порошків з розмірами часток 0,2 - 0,5 мм або у вигляді часток неправильної форми й гранул розміром 2 - 5 мм. Залежно від пористості й розміру пор питома поверхня активованого вугілля різних марок становить 600 - 1500 м2/г. При адсорбції молекули речовини, що поглинається, звичайно заповнюють мікропори, питомий об'єм мікропор становить (0,2 - 0,6) ·10-3 м3/кг.
1.2 Адсорбція на межі поділу тверде тіло-розчин
Ізотерми адсорбції речовин із розчинів подібні до ізотерм адсорбції газів. Разом з тим адсорбція з розчинів - значно складніший процес, який залежить від природи розчиненої речовини та її концентрації, природи розчинника та адсорбенту. Особливості цього виду адсорбції такі:
- На поверхні адсорбенту, поряд з адсорбцією розчиненої речовини, відбувається адсорбція розчинника, тобто молекули розчинника конкурують з молекулами розчиненої речовини за адсорбційні центри на поверхні твердого тіла. Тому можливі два види адсорбції з розчинів: позитивна, коли молекули розчиненої речовини адсорбуються краще за молекули розчинника, і негативна, коли молекули розчинника адсорбуються краще за молекули розчиненої речовини.
- Адсорбція з розчинів відбувається повільніше від адсорбції газів.
- З підвищенням температури розчину адсорбція зменшується.
- Залежність адсорбції речовин (газуватих або твердих) від їх концентрації у розчині описують емпіричним рівнянням Фрейндліха:
![]() , (1.2)
, (1.2)
де х - кількість речовини адсорбтиву, моль;
т - маса адсорбенту;
р - рівноважний тиск;
С - рівноважна концентрація;
k і 1/n - емпіричні константи.
Наведене рівняння (1.2) показує: що вищий тиск або концентрація розчиненої речовини, то більша кількість речовини адсорбується на поверхні адсорбенту, але пропорційність має не прямий, а експоненціальний характер.
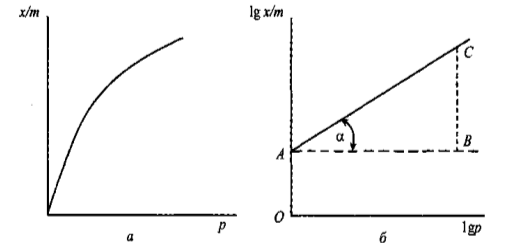
Рис. 1.1 – Ізотерма адсорбції (а) та визначення констант рівняння Фрейндліха (б)
Константа k залежить від властивостей адсорбенту, адсорбату і температури і має назву питомої адсорбції, тобто вона чисельно дорівнює адсорбції за рівноважної концентрації 1 моль/дм3.
Для визначення констант рівняння Фрейндліха перетворюють логарифмуванням на лінійну форму (рис. 1.1б):
![]() (1.3)
(1.3)
Зазначимо, що рівняння Фрейндліха справджується лише за середніх значень тиску.
Розчинена речовина може знаходитись у розчині у вигляді молекул (не-електроліти, слабкі електроліти) або йонів (сильні електроліти), тому залежно від природи адсорбованих частинок на твердій поверхні адсорбцію поділяють на молекулярну та йонну.
1.3 Молекулярна адсорбція
Для молекулярної адсорбції характерні такі закономірності.
- Адсорбція - вибірковий процес, який залежить від полярності адсорбенту. Доведено, що на полярних адсорбентах краще адсорбуються полярні речовини, а на неполярних - неполярні. Наприклад, на поверхні полярного адсорбенту силікагелю Si02 легко адсорбуються спирти, вода, аміни тощо, а на неполярному вугіллі або сажі С - неполярні органічні речовини, причому чим більша молярна маса адсорбтиву, тим інтенсивніше відбувається адсорбція.
- Важливу роль у процесі адсорбції речовин з розчинів відіграє полярність розчинника, мірою якої є діелектрична проникність є. Академік П. Ребіндер сформулював правило вирівнювання полярностей: на полярних адсорбентах краще адсорбуються полярні речовини із неполярних або малополярних розчинників, а на неполярних - неполярні речовини із полярних розчинників. Отже, процес адсорбції відбувається у бік вирівнювання полярностей фаз, причому чим більша різниця полярностей, тим швидше відбувається цей процес.
Це твердження узгоджується з правилом Шилова: що краще речовина розчиняється у розчиннику, то гірше вона адсорбується на твердій поверхні, і навпаки, що речовина менш, розчинна, то вона краще адсорбується.
При адсорбції речовин із багатокомпонентних розчинів спостерігається витіснення одних речовин з поверхневого шару і заміна їх іншими залежно від їх поверхневої активності. Підтверджується правило витіснення Фрейндліха: що краще адсорбується речовина з індивідуального розчину, то краще вона адсорбується і з суміші, оскільки має здатність витісняти інші речовини.
Сам механізм витіснення одних молекул субстрату на поверхні ферментів іншими відбувається під час ферментативних процесів, оскільки поверхнева активність продуктів розкладання є меншою за поверхневу активність вихідних речовин.
- При адсорбції з розчинів підтверджується правило Дюкло-Траубе. Адсорбція представників гомологічного ряду ПАР на гідрофобних адсорбентах з водних розчинів збільшується зі зростанням довжини вуглеводневого радикалу: НСООН <СН3СООН <С2Н5СООН <С3Н7СООН <С4Н9СООН.
Вивчаючи взаємний вплив полярності адсорбенту, адсорбтиву і розчинника, Ребіндер сформулював правило вирівнювання полярностей. Із полярних розчинників на полярному адсорбенті легше всього адсорбується речовина, яка зрівнює полярності двох фаз, що дотичні між собою.
На полярних адсорбентах легше адсорбуються полярні речовини. Неполярні адсорбенти краще адсорбують неполярні адсорбтиви. Якщо дисперсна фаза і дисперсійне середовище значно різняться за полярністю, то взаємодія між ними незначна, а поверхнева енергія – велика. Це створює сприятливі умови для адсорбції саме розчиненої речовини. Чим більша вільна поверхнева енергія на межі поділу, тим більша вірогідність її зниження за рахунок адсорбції розчиненої речовини, яка має проміжну полярність.
Залежність молекулярної адсорбції з розчинів від концентрації адсорбтиву характеризується звичайними ізотермами адсорбції. У випадку розбавлених розчинів адсорбція добре описується рівнянням Ленгмюра. Кількість речовини, адсорбованої з розчину 1г адсорбенту, можна розрахувати за рівнянням Ленгмюра-Фрейндліха:
Г = (С0 – С)∙V / (1000∙m), (1.4)
де С0 і С – відповідно початкова концентрація розчину і концентрація розчину після встановлення адсорбційної рівноваги, моль/л;
V – об'єм розчину, з якого відбувається адсорбція, мл;
m – маса адсорбенту, г.
На величину молекулярної адсорбції з розчинів впливає також температура. Із збільшенням температури адсорбція з розчинів зменшується, але в меншій мірі, ніж адсорбція газів. Якщо розчинена речовина відноситься до важкорозчинних, то при збільшенні температури розчинність речовини зростає. Як наслідок цього, буде збільшуватись концентрація розчину і відповідно зростатиме величина адсорбції.
Залежність адсорбції від будови молекул адсорбата дуже складна, і вивести будь-які закономірності досить важко. Молекули багатьох органічних речовин складаються з полярної (гідрофільної) і неполярной (гидрофобной) угруповань, тобто є поверхнево-активними речовинами (ПАР). Молекули ПАР при адсорбції на твердому адсорбенті орієнтуються на його поверхні таким чином, щоб полярна частина молекули була звернена до полярної фазі, а неполярная - до неполярной. Так, при адсорбції аліфатичних карбонових кислот з водних розчинів при неполярному адсорбенті - активованому вугіллі - молекули орієнтуються вуглеводневими радикалами до адсорбентів; при адсорбції з бензолу (неполярний розчинник) на полярному адсорбенті - силікагелі - орієнтація молекул кислоти буде зворотною (рис. 1.2).
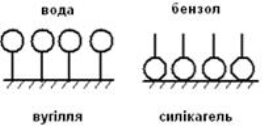
Рис. 1.2 - Орієнтація молекул ПАР на поверхні адсорбенту
1.4 Адсорбція електролітів із розчинів
Адсорбція з водних розчинів електролітів відбувається, як правило, таким чином, що на твердому адсорбенті з розчину адсорбуються переважно іони одного виду. Переважна адсорбція з розчину або аніона, або катіона визначається природою адсорбенту і іонів. Механізм адсорбції іонів з розчинів електролітів може бути різним; виділяють обмінну і специфічну адсорбцію іонів.
Адсорбція сильних електролітів із розчинів істотно відрізняється від молекулярної адсорбції, адже електроліти в розчинах знаходяться у вигляді йонів. При цьому йони зазвичай адсобуються на полярних адсорбентах.
Адсорбцію на твердій поверхні з розчинів електролітів називають йонною. Йонна адсорбція - це хімічна взаємодія між Нонами розчиненої речовини і твердою поверхнею адсорбенту. Проте енергії утвореного нового хімічного зв'язку недостатньо для того, щоб відірвати поверхневі атоми адсорбенту. Тому зв'язок нової сполуки з твердим сорбентом зберігається. Особливістю такої адсорбції є те, що на межі поділу тверде тіло-рідина виникає подвійний електричний шар. Тому поверхня адсорбенту набуває певного заряду, наявність якого спричинює притягання з розчину йонів протилежного знака.
Залежно від механізму процесу розрізняють вибіркову та йонообмінну адсорбцію сильних електролітів.
Вибіркова (селективна) адсорбція визначається процесом адсорбції катіонів або аніонів і підпорядковується правилам вибіркової адсорбції, сформульованим Панетом і Фаянсом:
- Кристалічну ґратку адсорбенту добудовують ті йони електроліту, що входять до її складу, ізоморфні з її йонами або ті, що утворюють з ними важкорозчинні сполуки.
- На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду яких протилежний знаку заряду поверхні адсорбенту.
Згідно з правилами Панета-Фаянса, для здійснення вибіркової адсорбції адсорбент має бути важкорозчинною сполукою і мати кристалічну будову, а розчин - надлишок саме тих йонів, з яких складається ґратка адсорбенту.
Наприклад, згідно з реакцією:
![]() (1.5)
(1.5)
де КІ взятий у надлишку, одержано важкорозчинну сполуку - Agl, яка має кристалічну будову.
На поверхні кристалічної ґратки аргентум йодиду в певній послідовності розміщені йони Ag+ і І», що робить її електронейтральною. Тому кристалічну ґратку Agl добудовують не йони К+ або NO3-, а йони, що утворюють з ними важкорозчинну сполуку. При цьому крім електростатичних сил притягання діють хімічні сили. Йони І" міцно адсорбуються, входять у кристалічну ґратку адсорбенту і надають їй негативного заряду.
Під дією негативного заряду поверхні ґратки, завдяки електростатичному притяганню, у шарі рідини біля негативно зарядженої поверхні перебувають йони Калію. На межі тверде тіло-розчин виникає подвійний електричний шар.
Природа йонів значною мірою впливає на їх здатність до адсорбції. Остання залежить від валентності, радіуса йона, ступеня його гідратації. За адсорбційною здатністю йони розміщують у ліотропні ряди Гофмейстера.
Доведено, що чим більший заряд йона, тим краще він адсорбується на твердій поверхні. Наприклад:
![]() (1.6)
(1.6)
Адсорбційна здатність йонів однакового заряду залежить від їх радіуса та здатності до сольватації (гідратації). Ліотропні ряди однозарядних йонів мають такий вигяд:
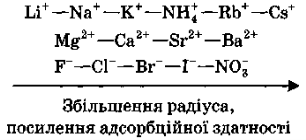 (1.7)
(1.7)
Наведені правила вибіркової адсобції йонів відіграють особливу роль у побудові колоїдних частинок, що розглядається.
1.5 Йоннообмінна адсорбція
Йонообмінна адсорбція - це процес еквівалентного обміну однойменно зарядженими Нонами між адсорбентом і розчином. При цьому тверда поверхня адсорбенту поглинає з розчину катіони або аніони, а замість них віддає у розчин еквівалентну кількість інших йонів того самого знака, тому цей процес може бути описаний стехіометричним рівнянням. Адсорбенти, на поверхні яких відбувається процес еквівалентного обміну, називають йонообмінниками. Йонообмінники не розчинні ні у воді, ні в кислотах, ні в лугах.
Іонний обмін являє собою процес взаємодії розчину з твердою фазою, що має здатність обмінювати іони, що утримуються в ній, на інші іони, присутні в розчині. Речовини, що складають цю тверду фазу, називаються - іонітами. Вони практично не розчинні у воді. Ті з них, що здатні вбирати з розчинів електролітів позитивні іони, називаються катіонами, негативні іони - аніонітами. Перші мають кислотні властивості, другі - основні. Якщо іоніти обмінюють і катіони, і аніони, їх називають амфотерними.
За походженням йонообмінники бувають неорганічні та органічні, природні (глина, ґрунт, цеоліти та інші мінерали) та синтетичні (йоніти), серед яких найчастіше використовують йонообмінні смоли - високомолекулярні сполуки, на полімерній матриці яких розміщені ковалентно зв'язані йоногенні групи.
Функціональні властивості йонітів зумовлені природою йоногенних груп, і за цією ознакою йоніти поділяють на катіоніти, аніоніти та амфоліти. Останні залежно від умов здатні до обміну як катіонами, так і аніонами.
Елементарну комірку катіоніту можна розглядати як високомолекуляр-ний полівалентний аніон (Rn), відокремлений поверхнею поділу від середовища, що його оточує. Такий полівалентний аніон містить на поверхні велику кількість йонів Гідрогену, які здатні обмінюватися на катіони, що знаходяться в рідині. Тому катіоніт можна умовно записати так: Rn-_(nН+). Сильнокислотні катіоніти містять залишки сульфатної, фосфатної та інших сильних кислот; слабкокислотні - карбоксильні —СООН, сульфогрупу —S03H та інші групи, що слабо дисоціюють. Наприклад, катіоніт марки КУ-1 є продуктом поліконденсації фенолобензолсульфокислоти і є біфункціональним катіонітом (містить фенольний гідроксил —ОН і сульфогрупу —S03H).
На поверхні катіонітів відбувається катіонний обмін, який загалом можна зобразити таким рівнянням:
![]() (1.8)
(1.8)
Комірку аніоніту можна уявити як високомолекулярний полівалентний катіон, протиіонами якого є гідроксид-іони 0Н~, здатні до обміну на аніони розчину, наприклад: Rn+(пОН~). Йоногенними групами сильнодсновних аніонітів є амонієві основи, а слабкосновних - аміногрупи різного ступеня заміщення (—NH2, =NH, =N—) та залишки інших органічних основ. Наприклад, аніоніт марки АН-10 є сіллю четвертинних амонієвих основ.
Схему аніонного обміну, який відбувається на поверхні аніоніту, можна зобразити так:
![]() (1.9)
(1.9)
Однією з головних характеристик йонітів є їх обмінна ємність, тобто число мілімолів йонів, що зв'язує 1 г сухого йоніту з розчину за рівноважних умов.
Оскільки йонний обмін є оборотним процесом, це дає можливість регенерувати використані йоніти. Катіоніти регенерують кип'ятінням їх у 1М розчині НСІ, аніоніти - відповідно в 1М розчині лугу.
Поглинальна здатність іонітів характеризується обмінною ємністю, яка визначається числом еквівалентів іонів, які поглинаються одиницею маси або об’єму іоніту. Розрізняють повну, статичну і динамічну обмінні ємності.
Повна ємність - це кількість поглинаючої речовини при повному насиченні одиниці об’єму або маси іоніту.
Статична ємність - це обмінна ємність іоніту при рівновазі в даних робочих умовах. Статична обмінна ємність звичайно менша за повну.
Динамічна обмінна ємність - це ємність іоніту до “проскакування” іонів у фільтрат, обумовлена в умовах фільтрації. Динамічна ємність менша за статичну.
Природні і синтетичні іоніти. Іоніти (катіоніти і аніоніти) бувають неорганічні (мінеральні) і органічні. Це можуть бути природні речовини або речовини, отримані штучно.
До неорганічних природних іонітів відносять цеоліти, глинисті мінерали, польові шпати, різні слюди й ін. Катіонообмінні властивості їх обумовлені вмістом алюмосилікатів типу Na20∙А1203∙nSi02∙тН20.
Іонообмінні властивості мають також фторапатит [Са5(PO4)3]F і гідроксидапатит [Са5(Р04)3]0Н. До неорганічних синтетичних іонітів відносять силікагелі, пермутити, важкорозчинні оксиди і гідрооксиди деяких металів (алюмінію, хрому, цирконію й ін.). Катіонообмінні властивості, наприклад силікагелю, обумовлені обміном іонів водню гідроксидних груп на катіони металів, які проявляються в лужному середовищі. Катіонообмінні властивості мають і пермутити, одержані сплавленням сполук, які містять алюміній і кремній.
Органічні природні іоніти - це гумінові кислоти ґрунтів і вугілля. Вони виявляють слабокислотні властивості. Для посилення кислотних властивостей і обмінної ємності вугілля подрібнюють і сульфують у надлишку олеуму. Сульфовугілля є дешевим поліелектролітом, що містить сильно- і слабокислотні групи. До недоліків таких іонітів варто віднести їх малу хімічну стійкість і механічну міцність зерен, а також невелику обмінну ємність, особливо в нейтральних середовищах.
До органічних штучних іонітів відносять іонообмінні смоли з розвиненою поверхнею. Саме вони мають найбільше практичне значення для очищення стічних вод. Синтетичні іонообмінні смоли являють собою високомолекулярні сполуки, вуглеводневі радикали, які утворюють просторову сітку з фіксованими на ній іонообмінними функціональними групами. Просторова вуглеводнева сітка (каркас) називається матрицею, а іони, що обмінюються, - протиіонами. Кожний протиіон з’єднаний із протилежно зарядженими іонами названими фіксованими, або анкерними. Полімерні вуглеводневі ланцюги є основою матриці, пов’язані (зшиті) між собою поперечними зв’язками, що додає міцності каркасу.
При скороченому написанні іоніту матрицю позначають у загальному вигляді (R), а активну групу вказують повністю. Наприклад, сульфокатіоніти записують як RSO3H. Тут R - матриця, H - протиіон, S03 - анкерний іон.
Іоніти одержують методом сополімеризації або сополіконденсації із наступним з’єднанням утворюючих ланцюгів. У конденсаційних іонітах з’єднання поперечних зв’язків здійснюється за рахунок метиленових (-СH-) або метилових (=СН-) містків, а також азототримаючих угруповань, у полімеризаційних - найчастіше з допомогою дивініл- бензолу і його ізомерів. Числу таких поперечних зв’язків сприяють розмір осередків сітки і твердість матриці.
Залежно від ступеня дисоціації катіонообмінні смоли бувають сильно- і слабокислотні, а аніонообмінні - сильно- і слабоосновні. До сильнокислотних відносять катіоніти, що містять сульфогрупи (S03Н) або фосфорнокислі групи [РО(ОН)2]. До слабокислотних - карбоксильні (СООН) і фенольні (С6Н5ОН) групи. Сильноосновні іоніти містять четвертинні амонієві основи (R3NOН).
Властивості синтетичних іонітів в основному визначаються числом та типом фіксованих іонів, а також будовою матриць, особливо кількістю поперечних зв’язків у ній. Кількість гідрофобних груп та кількість поперечних зв’язків у матриці визначають ступінь набухання, рухливість та ін. Синтетичні іонообмінні смоли на основі полістирола частіше використовуються в аналітичній хімії. Іоніти на целюлозній основі гідрофільні, це дає можливість розділяти лабільні високополімерні сполуки.
Так, для розділення білків використовують іонообмінники, що характеризуються гідрофільними властивостями. Використовують іоніти на целюлозній основі: ДЕАЕ-целюлоза – диетиламіноетилцелюлоза, ТЕАЕ-целюлоза – триетиламіноетилцелюлоза, КМ-целюлоза – карбоксиметилцелюлоза.
ДЕАЕ-целюлоза – при синтезі набуває властивостей аніонообмінника, КМ-целюлоза – властивостей катіонообмінника. Крім целюлози як матрицю використовують декстран, поліакриламід, сополімер стиролу та дивінілбензолу.
Іоніти, що містять однакові активні групи, називаються моно- функціональними, а іоніти, що містять функціональні групи різної хімічної природи, - поліфункціональними. Вони можуть мати змішані сильно-слабоосновні властивості.
Катіоніти як протиіони можуть містити не іони водню, а іони металів, тобто знаходитися в сольовій формі. Так само і аніоніти можуть знаходитися в сольовій формі, якщо як протиіони вони містять не іони гідроксиду, а іони тих або інших кислот.
При нагріванні іонітів у воді і в повітрі можливе руйнування їхніх зерен, відщеплення активних груп, що приводить до зменшення ємності. Кожна смола має температурну межу, вище якої її використовувати не можна. У загальному випадку термічна стійкість аніонітів нижча, ніж катіонітів.
Іоніти в контакті з водою не розчиняються, але поглинають деяку кількість води і набухають, будучи гелями з обмеженою набухливістю. При набряканні іонітів розмір мікропор зростає від 0,5-1,0 нм (5-10 А) до 4 нм (40 А), а розмір мікропор становить 70-130 нм (700-1300 А). При цьому обсяг іонітів збільшується в 1,5-3 рази. Ступінь набрякання залежить від будови смоли, природи протиіонів, від сполуки розчину. Набрякання впливає на швидкість і повноту обміну іонів, а також на селективність іоніту. Воно припиняється після того, як різниця осмотичних тисків до і після обміну зрівноважиться пружними силами розтягання і стиску іоніту.
Сильно набрякаючі смоли, названі гелеподібними, мають питому обмінну поверхню 0,1-0,2 м2/г. Макропористі іоніти мають розвинену обмінну поверхню, яка дорівнює 60-80 м2/г. Синтетичні іоніти набухають у воді більше і мають більшу обмінну ємність, ніж природні. Термін служби синтетичних катіонітів значно більший, ніж аніонітів. Це пояснюється низькою стабільністю груп, які в аніонітах виконують роль фіксованих іонів.
Селективність обміну залежить від величини тиску набрякань в порах смоли і від розміру пор іоніту. При малому розмірі пор великі іони не можуть досягти внутрішніх активних груп. З метою підвищення селективності іонітів до певних металів до складу смоли вводять речовини, здатні утворювати з іонами цих металів внутрікомплексні сполуки (хелати). Встановлені ряди іонів за енергією їх витіснення із сильно- і слабокислотних катіонів.
1.6 Іоннообмінна хроматографія
В основі іонообмінної хроматографії (Ion-exchange сhromatography) лежить зворотний стехіометричний обмін іонів, що містяться у хроматографічному розчині, на рухомі іони, які входять до складу речовин, що називаються іонітами, або іонообмінниками. Розділення суміші іонів, що містяться у розчині, засновано на неоднаковій здатності їх до обміну з іонами іоніту. Важко провести чітку межу між адсорбційною та іонообмінною хроматографією, так як звичайні адсорбенти діють як і іоніти, а на іонітах має місце фізична адсорбція.
Ознаки хроматографії та послідовність етапів проведення хроматографічного аналізу. Нерухома тверда фаза, як правило, складається з сорбенту (смоли) з ковалентно зв’язаними аніонами або катіонами. Протилежно заряджені іони розчиненої речовини у рідкій, рухомій фазі електростатичними силами притягуються до іонів сорбенту. Для адсорбованих компонентів зразка потім проводять елюювання, з використанням сольового градієнту, що поступово десорбує молекули зразка. Внаслідок своєї роздільної здатності іонообмінна хроматографія є одним з найбільш важливих типів хроматографічних методів виділення і очищення білкових препаратів.
Фаза, що не рухається, має заряджені функціональні групи, які взаємодіють з іонізованими молекулами протилежного заряду, що аналізуються.
Виділяють два типи – (1) катіонну та (2) аніонну іонообмінні хроматографії:
- при проведенні катіонної іонообмінної хроматографії затримуються додатньо заряджені катіони, так як нерухлива фаза має від'ємно заряджені функціональні групи;
- при проведенні аніонної іонообмінної хроматографії затримуються від'ємно заряджені аніони, так як нерухлива фаза має додатньо заряджені функціональні групи.
Як вже зазначалось, сорбент для іонного обміну представляє собою тверду нерозчинну речовину, що містить у своїй структурі іоногенні групи, здатні до реакції іонного обміну. Наприклад, для здійснення катіонного обміну сорбент має містити у своїй структурі кислотні групи, іон водню яких здатний обмінюватись на катіон електроліту, що знаходиться у розчині (катіонообмінний сорбент або катіоніт). У випадку аніонообмінної сорбції сорбент містить у своїй структурі групи, що характеризуються властивостями основ, тобто гідроксиду, іон цих груп повинен обмінюватись на аніони електроліту, що знаходиться у розчині (аніонообмінний сорбент або аніоніт).
Отже, іонообмінні сорбенти представляють собою групу носіїв-електролітів, які повинні містити у своїй структурі іони, здатні до дисоціації, і у той же час вони мають бути нерозчинними. Одночасність таких властивостей досягається поєднанням іонних груп або атомів ковалентними зв’язками, у результаті чого утворюється високомолекулярна сполука просторової або сітчастої структури.
2 ПРИКЛАДИ ВИКОРИСТАННЯ АДСОРБЦІЇ З РОЗЧИНІВ
Адсорбція із розчинів на поверхні твердого тіла має велике значення для життєдіяльності організмів: адсорбція субстрату на поверхні ферментного комплексу, адсорбція на мембранах клітин (15 тис.м2 у організмі), адсорбція білків на поверхні гідрофобних частинок для перенесення їх кров’ю та транспорт кисню гемоглобіном еритроцитів. Такі тверді адсорбенти, як активоване вугілля та йонообмінники, застосовуються для дезінтоксикації організму (очистки організму від сторонніх речовин, отрут, які потрапили в шлунок; шкідливих продуктів життєдіяльності; надлишкових ліків). Поверхня поділу фаз однієї таблетки активованого вугілля (0,25 г) досягає 125 м2. Отже, у медичній практиці широко використовують ентеросорбенти. Адсорбційна терапія здійснюється різними методами, такими як гемосорбція (очищення крові від токсинів), плазмосорбція, лімфосорбція, лікворосорбція (очищення спинномозкової рідини), аплікаційна сорбція, ентеросорбція. Адсорбція застосовується також для очистки вітамінів та антибіотиків. У медичній практиці використовуються імобілізовані препарати, тобто ферменти, гормони, антибіотики, які закріплені на неорганічних та органічних полімерах. Хроматографія ̶ метод розділення й аналізу сумішей газів, випарів, рідин або розчинених речовин за допомогою сорбційних процесів. Цей метод застосовується з метою діагностики, клінічного контролю за перебігом лікування, контролю процесу детоксикації організму при отруєннях. Це дозволяє визначати шляхи профілактики та лікування різних хвороб. Хроматографію застосовують у токсикологічній хімії, судовій медицині, криміналістиці та гігієні.
Для виділення мембранних білків можна використовувати класичні іонообмінні системи. Найбільш популярні – це слабкозаряджені ДЕАЕ- та КМ-іоніти (на основі целюлози та декстрана). Якщо їх використовують у присутності детергенту, то треба впевнитись, що він не перешкоджає взаємодії білка з адсорбентом. Ефективність очищення залежить від властивостей білка: якщо білок гідрофільний, можна підібрати умови, за яких він буде міцно зв’язуватись з іонітом. Білки, які занурені у бішар, після солюбілізації щільно оточені детергентною оболонкою, тому менш ймовірна взаємодія з зарядженим адсорбентом.
З врахуванням цього ДЕАЕ-колонки, як правило, зрівноважують буфером низької іонної сили (наприклад, 0,1 М трис-НСl або фосфатним буфером), що містить детергент (0,1%) при рН 6,5–8,0. Елюювання проводять сольовими розчинами зростаючої концентрації (0-1 М NaCl або КCl), які також містять детергент. КМ-сорбенти як правило зрівноважують при слабкокислих рН (5,5–7,0), а для елюювання частіше за все використовують розчини з градієнтом рН, а не солі.
Іонообмінна хроматографія широко використовується в промисловості для очищення різних речовин, наприклад, для знесолювання води, при отриманні антибіотиків, в біології метод використовують для одержання та очищення білків (ферментів), нуклеїнових кислот, у фармакології – для очищення цільових продуктів терапевтичного призначення та ін. Іонообмінна хроматографія використовується для кількісного та якісного визначення амінокислот за допомогою аналізатора амінокислот.
З обміном йонів пов'язана більшість процесів у живих системах. Кров як одну з найважливіших рідин організму можна розглядати як розчин електролітів із середньою концентрацією 075М. Йонообмінні властивості мають структурні елементи клітин: ядра, мітохондрії, мембрани, мікросоми та ін. Отже, можна вважати, що організми побудовані з йонітів. Найпростіший йонний обмін виявляється також у дії ферментів та біологічних мембран.
Властивості йонітів мають тканини рослин і тварин. їх катіонообмінні властивості визначаються наявністю карбоксильних та фосфатних груп, а здатність обмінюватися аніонами - аміногрупами білків.
Йоніти використовують також як каталізатори деяких реакцій, для очищення стічних вод, у йонообмінній хроматографії - для виділення та очищення амінокислот. їх застосовують у медичній практиці для консервування крові, при отруєннях йонами важких металів (Pb2+, Hg2+, Cd2+ тощо). Катіоніти призначають як антацидні засоби при ацидозах, для лікування набряків, пов'язаних із декомпенсацією серцевої діяльності, та запобігання їм. За допомогою йонообмінників виготовляють дитяче харчування - йонітне молоко.
Широке застосування знайшла адсорбція з розчинів у медицині для детоксикації організму від токсинів, харчових отруєнь, відкладань солей.
Новий напрям медицини, який, на відміну від традиційної, ґрунтується не на введенні ліків в організм, а на виведенні з нього шкідливих і токсичних речовин, називають адсорбційною, або еферентно, медициною. Головним завданням методів еферентної медицини є моделювання природних методів детоксикації.
Залежно від конкретної мети сорбційна детоксикація може здійснюватись методом гемосорбції, плазмосорбції, лімфосорбції, лікворосорбції, ентеросорбції, аплікаційної сорбції.
Принцип гемосорбції полягає у пропусканні крові через колонку з адсорбентом, яка підключена до системи циркуляції крові. У медичній практиці цей метод часто називають гемоперфузією і застосовують при нирковій та печінковій недостатності, екзогенних та індогенних отруєннях снодійними препаратами, нейролептиками, фосфорорганічними сполуками та ін., аутоімунних та алергійних захворюваннях тощо. Для широкого застосування гемосорбції потрібно вирішити проблему створення відповідних гемосорбентів з високою гемосумісністю і селективністю, які не змінюють реологічних характеристик крові, є хімічно стійкими, виявляють високу адсорбційну здатність стосовно того чи іншого токсину.
Суть плазмосорбції - пропускання плазми крові, попередньо відокремленої від формених елементів через колонку із сорбентом. Цей метод застосовують при тяжких отруєннях у тих випадках, коли не можна використати гемосорбцію.
Лімфосорбцію (очищення організму пропусканням лімфи через колонку із сорбентом) найчастіше застосовують при екзогенних отруєннях алкалоїдами блідої поганки, хлоропохідними вуглеводнів та ін. Перевагою цього методу є відносна нетравматичність (відсутність ушкодження формених елементів, порушень згортання крові та змін у серцево-судинній системі).
Ентеросорбцію здійснюють за допомогою перорального вживання сорбентів, так званих ентеросорбентів, які під час проходження через травний канал адсорбують шкідливі речовини, зменшуючи тим самим їх вміст у крові. Застосовують цей метод для виведення алкалоїдів, наркотичних речовин, барбітуратів тощо, лікування алергійних захворювань. Розроблено ентероеорбенти на основі рослинних волокон - фітосорбенти, які очищують організм від радіонуклідів, важких металів.
Для лікування інфікованих ран, опіків ефективною є аплікаційна терапія - один із методів детоксикації організму накладанням на рану або зону опіку марлевої пов'язки із сорбційним матеріалом. Це сприяє звільненню ушкоджених тканин від продуктів розпаду білків, інтенсифікації процесів регенерації тканин, зменшенню інтоксикації цілого організму. Розроблено волокнисті вугільні сорбенти з іммобілізованими на поверхні ферментами, які сприяють швидшому загоєнню ран. Вони можуть бути також носіями лікарських засобів - антибіотиків, антисептиків та інших антибактеріальних препаратів.
В Україні становлення та розвиток досліджень адсорбції з розчинів пов’язані з Інститутом фізичної хімії НАНУ. На поч. 30-х рр. 20 ст. співробітник цього інституту М. Поляков запропонував ідею формування пористості силікагелів за допомогою органічних формувачів, тобто фактично передбачив напрям, який нині активно розвивається в адсорбції, – темплатний синтез та імпринтинг селективних сорбентів та каталізаторів.
І. Неймарк, учень М. Полякова, експериментально дослідив закономірності пороутворення в неорганічних гелях; першим в Україні і СРСР розробив синтетичні цеоліти. Досліджння хімії поверхні, іонообмінних, електрохімічних та сорбційних властивостей активовованого вугілля і силікагелів здійснили Д. Стражеско та І. Тарковська.
В. Стрелко запропонував молекулярні механізми формування пористості неорганічних сорбентів та іонообмінників, обґрунтував уявлення про синтет. вугілля як про новий різновид вуглецевих сорбентів, розробив методи й технології синтезу та організував виробництво вуглецевих медичних сорбентів для очищення крові (гемосорбентів) та прийому всередину (ентеросорбентів).
Дедалі більшого значення набувають сорбенти в медицині – як універсальны засоби детоксикації організму при лікуванні отруєнь і широкого спектра захворювань.
Найбільше поширення в сорбційних технологіях отримали активов. вугілля, силікагелі, оксиди алюмінію, природні мінеральні сорбенти та синтет. цеоліти. Синтезовано нові різновиди цих матеріалів, наприклад, мезопористі цеоліти, активововане вугілля з молекулярно-ситовими властивостями, комбіновані вуглець-мінеральні сорбенти – їх усебічно досліджують. Обсяги виробництва цих матеріалів у розвинених країнах досягають десятків та сотень тис. т. В Україні питаннями адсорбції займається Інститут сорбції та проблем ендоекології НАНУ, який розробляє сорбенти для екології, медицини й тонких хімічних технологій.
У харчовій промисловості явище адсорбції використовують у процесах очищення дифузійного соку і сиропу в цукровому виробництві, сиропів у крохмальному виробництві, очищення (просвітлення) і стабілізації вин, просвітлення соків у консервному виробництві, рафінування рослинних олій, очищення спирту і водноспиртових сумішей у спиртовому та лікеро-горілчаному виробництві.
Абсорбцію із розчинів застосовують для насичення безалкогольних напоїв, пива та мінеральних вод вуглекислим газом, сульфітації фруктових соків сірчистим газом.
Процеси іонної адсорбції, як правило, організовують у замкнутих циклах. Наприклад, щоб пом'якшити воду, яка призначена на виготовлення безалкогольних і алкогольних напоїв та очистити виноматеріали, оскільки смакові якості цих продуктів поліпшуються в разі зменшення в них кількості іонів магнію, міді, заліза тощо.
На сучасному етапі у консервній промисловості освітлення плодових соків здійснюється за допомогою ферментних препаратів, желатину, таніну та іншими способами. Існуючі способи освітлення фруктових соків не завжди забезпечують їх належне освітлення і очищення від небажаних компонентів. У харчовій промисловості застосовують такі природні глинисті адсорбенти: бентоніти, сапоніти, глауконіти, цеоліти. Зокрема, бентоніти застосовують для освітлення олій, вин, соків; сапоніти – для очищення рідин, видалення радіонуклідів; глауконіти – для очищення та декальцинації соків та сиропів цукрового виробництва; цеоліти (водні алюміносилікати) – для концентрування соків та очищення газів компресорнохолодильних установок; палигорськіт – в технології освітлення яблучного соку.
Завдяки пористій структурі та високорозвиненій поверхні такі мінеральні сорбенти здатні селективно вилучати з водних розчинів різні речовини, а їхня не токсичність робить можливим використання цих реагентів для потреб різних галузей харчової промисловості. Придатність природних адсорбентів для освітлення соків і вин, зумовлена перш за все, наявністю великої адсорбційної поверхні порівняно з поверхнею штучних адсорбентів. Завдяки присутності мікропор і пор перехідних розмірів ці пористі мінерали ефективно поглинають дрібні та великі молекули і колоїдні утворення. Окрім того, природні адсорбенти – дешевші в десятки разів за синтетичні, тому навіть одноразове їх використання є рентабельним.
ВИСНОВКИ
1 Розглянута загальна характеристика процесу адсорбції із розчинів, його застосування в науці та виробництві.
2 Знайдено, що адсорбція є процесом концентрування і достатньо міцного утримування речовин (адсорбатів, адсорбтивів) із газової фази чи розчинів на поверхні твердих тіл (адсорбентів) або на межі поділу (поверхні) рідин.
3 Показано, що при адсорбції з розчинів на поверхні адсорбенту, поряд з адсорбцією розчиненої речовини, відбувається адсорбція розчинника, тобто молекули розчинника конкурують з молекулами розчиненої речовини за адсорбційні центри на поверхні твердого тіла.
4 Відзначено, що до адсорбції з розчинів відносять адсорбцію на межі поділу тверде тіло-розчин, з водних розчинів електролітів (іонний обмін) та іонообмінну хроматографію.
ПЕРЕЛІК ПОСИЛАНЬ
1 Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія: Навч. посібник. - Львів: Світ, 1994. - 280 с.
2 Гомонай В. І., Гомонай О. В. Фізична хімія. — Ужгород : Патент, 2004. — 712 с.
3 Ковальчук Є. П., Решетняк О. В. Фізична хімія: Підручник. – Львів: Видавничий центр ЛНУ імені Івана Франка, 2007. – 800 с.
4 Кірєєв В. А. Курс фізичної хімії. — М. : Хімія, 1975. — 776 с.
5 Природні мінеральні сорбенти. К., 1960;
6 Дубінін М. М. Адсорбція та пористість. Москва, 1972;
7 Тарасевич Ю. І., Овчаренко Ф. Д. Адсорбція на глинистих мінералах. К., 1975;
8 Ніколаєв В. Г., Стрєлко В. В. Гемосорбція на активованому вугіллі. К., 1979;
9 Синг К. Адсорбція, питома поверхня, пористість / Пер. з англ. Москва, 1984;
10 Слинякова І. Б., Денисова Т. І. Кремнійорганічні адсорбенти. К., 1988.
1

про публікацію авторської розробки
Додати розробку
