Алкани. Зведена таблиця.
|
|
Добування |
Хімічні властивості |
||
|
реакції |
умови |
реакції |
умови |
|
|
СnH2n+2
А Л К А Н И СН4-метан С2Н6-етан С3Н8-пропан С4Н10-бутан С5Н10-пентан С6Н14-гексан С7Н16-гептан С8Н18-октан С9Н20-нонан С10Н22-декан |
nCO + (2n+1)H2→ СnH2n+1 + nH2O
|
5000С, Ni t0С
t0С
|
1.Р-ція заміщення а) СН4 + Cl2 → CH3Cl + HCl → CH2Cl2 + HCl → CHCl3 + HCl → CCl4 + HCl б) СН3-СН3+НО-NО2 → СН3-СН2-NО2 + Н2О 2. Горіння СН4 + 2О2 → СО2 + 2Н2О + тепло 2СnH2n+2 + (3n+1)O2 → 2nCO2 + (2n+2) H2О 3. Неповне окиснення а)4СН4 +2О2 → CH≡CH+СО+Н2О+СО2 б) СН4 + О2→ CH3-OH в) С4Н10 + О2 →2СН3-СООН 4. Розщеплення(розклад)крекінг-піроліз а) СН4→ С + 2H2 б) 2СН4 → CH≡CH + 3H2 в) 2СН4 → CH=CH + 2H2 г) CH3-CH3 → CH2=CH2 + H2 д) CH3-CH2-CH2-CH3 → CH2=CH2+CH3-СH3 5. Ізомерізація
Пентан 2-метилбутан CH3
|
світло
t0С›1000 t0С=1500
t0С=550-650 t0С=830
t0С, AlCl3 |
|
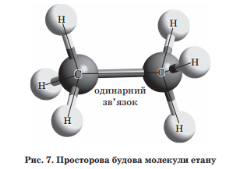
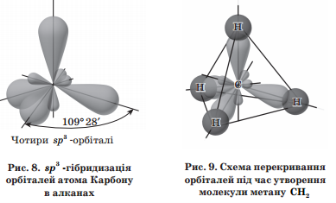
Фіз.властивості. СН4 – С4Н10 - гази С5Н12 – С15Н32 – рідини С16 ≤- тверді Легше води, не розчинні у воді. t0пл, і t0кип. зростають із збільшенням атомів С Будова
|
||||
|
|
||||


про публікацію авторської розробки
Додати розробку