Конспект уроку з хімії для 10 класу на тему:" Поняття про вищі (насичені й ненасичені) карбонові кислоти"
Поняття про вищі (насичені й ненасичені) карбонові кислоти
Мета уроку: формувати знання учнів про вищі насичені й ненасичені карбонові кислоти; закріпити поняття про принципи класифікації карбонових кислот; ознайомити з окремими представниками цього класу, практичним значенням реакції вищих карбонових кислот з утворенням солей — основного компонента мила; показати практичне значення й застосування вищих карбонових кислот; розглянути промислові й лабораторні способи одержання карбонових кислот, галузі їх застосування, хімічні реакції, що лежать в основі застосування карбонових кислот
Обладнання. Таблиця «Класифікація органічних сполук»
Тип уроку. Комбінований
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашньої роботи
- Установити відповідність між
назвою кислоти та її типом
- Оцтова монокарбонова
- Масляна насичена
- Пальмітинова ненасичена
- Стеаринова жирна
- Мурашина вища
- Пропіонова нижча
- «Естафета визначень»
- Реакція відщеплення води від будь якої сполуки називається (дегідратація).
- Реакція під час якої поглинається теплота називається (ендотермічна)
- Реакція між речовиною і киснем в результаті якої виділяється тепло і світло називається (реакцією горіння)
- Реакція обміну між сполукою і водою називається (гідроліз)
- Реакція приєднання водню до органічних сполук називається (гідрування)
- Реакція відщеплення водню від сполуки називають (дегідруванням)
- Реакція між карбоновою кислотою і спиртом називається (реакцією етерифікації)
- Реакція сполучення багатьох однакових молекул внаслідок руйнування кратних зв’язків називається (реакцією полімеризації)
- Реакція між речовиною і киснем називається (реакцією окиснення)
- Реакція між органічною речовиною і хлором називається (реакцією хлорування)
- Реакція , яка відбувається за участі каталізатора називається (каталітичною)
- Брейн – ринг
(завдання для учнів, які цікавляться хімією)
- Солі мурашиної кислоти (Форміати)
- Найпростіша двохосновна органічна кислота (Щавлева)
- Солі щавлевої кислоти (Оксалати)
- Ароматична кислота (Бензойна)
- Солі лимонної кислоти (Цитрати)
- Солі оцтової кислоти (Ацетати)
- Найсильніша одноосновна насичена карбонова кислота (Мурашина)
- «Відгадай, хто я»
Визначити речовину за такими ознаками:
1. Будучи безводною, ця сполука дуже небезпечна. У разі потрапляння на шкіру вона не лише пече, але й буквально розчиняє її.
2. Ця речовина розчиняє капрон, нейлон та інші полімери, на які не діють розведені розчини кислот і лугів.
3. Речовина має сильні дезінфікуючі властивості. Її водні розчини використовуються як харчові консерванти, а слабкий водноспиртовий розчин застосовують у медицині для розтирань.
4. Ця речовина міститься в бджолиній отруті, сосновій хвої, у гусеницях шовкопряда.
5. Уперше цю речовину одержав англійський ботанік і зоолог Джон Рей у 1670 р. Він помістив у посудину рудих лісових мурах, налив води, довів до кипіння і пропустив крізь посудину струмінь гарячої пари. Рей одержав розчин хімічної сполуки. Вона виявляла типові властивості кислот. Ця речовина — ... (Мурашина кислота)
Про властивості яких речовин ми сьогодні говоритимемо? Яка мета нашого уроку?
II. Оголошення теми й очікуваних навчальних результатів
ІІІ. Актуалізація опорних знань
- яка функціональна група карбонових кислот;
- чим ненасичені вуглеводні відрізняються від насичених і як їх виявляють;
- що таке гліцерин і які його властивості;
- чим аналіз відрізняється від синтезу;
- які умови необоротності перебігу реакції між сіллю й кислотою;
- чим відрізняються оборотні реакції від необоротних;
IV. Виклад необхідної інформації
Розповідь вчителя. За вмістом атомів Оксигену всі карбонові кислоти належать до оксигеновмісних кислот. За ступенем дисоціації всі карбонові кислоти є слабкими. Причому зі збільшенням вуглеводневого радикалу їх сила зменшується.
![]()
![]()
![]() Класифікація за кількістю карбоксильних груп
Класифікація за кількістю карбоксильних груп
Одноосновні Двоосновні Триосновні
Оцтова щавелева лимонна
Пропіонова малонова
Бензойна бурштинова
Мурашина яблучна
Саліцилова винна
Акрилова
Карбонові кислоти поширені в природі. Вони та їх похідні входять до складу продуктів рослинного та тваринного походження, містяться у природних водах та ін.
Запитання. Як же на сучасному етапі одержують карбонові кислоти?
Повідомлення учня. Мурашина кислота вперше була добута в ХVІІ столітті перегонкою червоних лісових мурашок, звідки і походить історична назва цієї кислоти. Її солі називають форміатами. У промисловості кислоту добувають взаємодією СО з розплавленим NаОН: СО + NаОН (тв) →НСООNа;
НСООNа + НСl → НСООН + NаСl
Знаходження в природі. Досить поширена в природі. У вільному стані виявлена в організмі мурашок, кропиві; виділяється із тваринних організмів у складі сечі та поту.
Фізичні властивості. Безбарвна рідина з гострим, подразливим запахом, змішується з водою у будь – яких співвідношеннях, належить до кислот середньої сили, характеризується невисокою термічною стійкістю.
Робота з підручником. Скласти схему класифікації вищих карбонових кислот
Вищі карбонові кислоти деякою мірою відомі вам з повсякденного життя. Чи не кожен з вас спостерігав горіння стеаринової й пальмітинової кислот, запалюючи новорічні стеаринові свічки, наносив ці кислоти на шкіру у складі косметичних засобів. Компонентом живильних і зм'якшувальних кремів, засобів догляду за волоссям також є ненасичена олеїнова кислота.
- Звідки люди дізналися про існування цих кислот?
- У який спосіб і з яких сполук одержали їх у чистому вигляді?
Відповіді на ці запитання тісно пов'язані з речовинами, які ви використовуєте щодня. Ідеться про жири й мила.
Повідомлення учня. Жири - природна сировина, з якої за допомогою хімічних перетворень уперше добули вищі карбонові кислоти - насичені й ненасичені.
Перші припущення щодо наявності в жирах «прихованої кислоти» були зроблені ще в XVII столітті. Мила - натрієві й калієві солі вищих карбонових кислот - здавна виготовляли варінням жирів з лугом. 1741 р. французький хімік Клод Жозеф Жоффруа (1685-1752) дією сильної неорганічної кислоти на мило добув масну на дотик суміш. Він припустив, що добута маса є жиром. Досліджуючи її властивості, науковець виявив, що це не так. Які ж були подальші кроки на шляху з'ясування хімічної природи жирів? Гідроліз жирів - хімічна реакція, за допомогою якої 1779 р. шведський хімік Карл Вільгельм Шеєле виявив: один з продуктів гідролізу (розкладання під дією води) жирів - гліцерин. У 1817 р. його співвітчизник Шеврьоль не лише добув з жирів уже відому «солодку олію Шеєле», яку назвав гліцерином. Непересічне значення мало відкриття ним у продуктах дії водних розчинів лугів і кислот на різноманітні жири раніше невідомих сполук. Ними виявилися вищі карбонові кислоти - стеаринова, пальмітинова, олеїнова.
Цікаво дізнатися.
Вищі карбонові кислоти
|
Кількість атомів Карбону |
Назва кислоти |
Брутто формула |
Природне джерело |
|
11 |
Ундецилова |
С11Н22О2 |
- |
|
12 |
Лауринова |
С12Н24О2 |
Лаврова олія |
|
13 |
Тридецилова |
С13Н26О2 |
- |
|
14 |
Міристинова |
С14Н28О2 |
Олія міристинових рослин |
|
15 |
Пентадецилова |
С15Н30О2 |
- |
|
16 |
Пальмітинова |
С16Н32О2 |
Пальмова олія |
|
17 |
Маргаринова |
С17Н34О2 |
- |
|
18 |
Стеаринова |
С18Н36О2 |
Сало та інші жири |
|
19 |
Нонадецилова |
С19Н38О2 |
- |
|
20 |
Арахісова |
С20Н40О2 |
Арахісова олія |
|
21 |
Генейкозанова |
С21Н42О2 |
- |
|
22 |
Бегенова |
С22Н44О2 |
Бегенова олія |
|
23 |
Трикозанова |
С23Н46О2 |
- |
|
24 |
Лігноцеринова |
С24Н48О2 |
Смола дерева буку |
|
25 |
Пентакозанова |
С25Н50О2 |
- |
|
26 |
Церотинова |
С26Н52О2 |
Бджолиний віск |
|
27 |
Гептакозанова |
С27Н54О2 |
- |
|
28 |
Монтанова |
С28Н56О2 |
Гірський віск |
|
29 |
Нонакозанова |
С29Н58О2 |
|
|
30 |
Мелісинова |
С30Н60О2 |
Бджолиний віск |
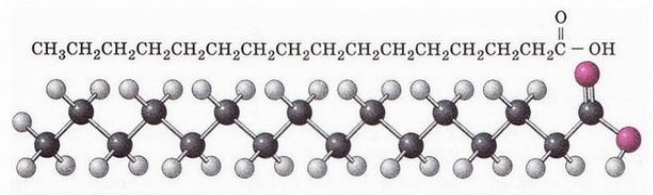
Пальмітинова і стеаринова кислоти
С15Н31СООН і С17Н35СООН , високомолекулярні, жирні, тверді, нерозчинні у воді речовини. У вигляді естерів з гліцерином вони входять до складу більшості жирів.
Н2С- ОН Н2С –О – СО – С17Н35
| |
НС – ОН + СООН – С17Н35 → НС – О- СО – С17Н35
| |
Н2С - ОН Н2С – О –СО – С17Н35
Пальмітинова кислота у вигляді складного естеру мірицилового спирту входить до складу бджолиного воску
(С15 – Н31 – СО – О – С31Н63). Як самі ці кислоти, так і їх солі одержують каталітичним гідролізом жирів. Солі вищих карбонових кислот називають милами.
Застосування. Суміш цих кислот називають стеарином і використовують для різних технічних потреб, наприклад виготовлення свічок.
V. Практичне засвоєння матеріалу
Виконайте завдання
- Визначте структурну формулу речовини складу C3H6O2, якщо її водний розчин змінює забарвлення метилоранжу на червоний колір. З надлишком хлору ця речовина утворює сполукуC3H5Cl2O, а її натрієва сіль унаслідок нагрівання з NaОН утворює етан.
2) Як змінюється ступінь дисоціації кислот зі більшенням молекулярної маси? Напишіть
рівняння дисоціації хлоридної, пропіонової, масляної та олеїнової кислот. Яка з них сильніша?
3) Висловіть припущення, як можна хімічним шляхом розрізнити парафінову й стеаринову свічки. Обґрунтуйте свою думку.
VІ. Підбиття підсумків уроку, оцінювання роботи учнів
1. Які питання були найбільш важкими для розуміння?
VIІ. Домашнє завдання
Вивчити §


про публікацію авторської розробки
Додати розробку
