Алюміній. Будова атома. Фізичні і хімічні властивості: взаємодія з киснем, сіркою, водою, кислотами, лугами. Застосування Алюмінію та його сполук. Поширення в природі та біологічна
1
Алюміній. Будова атома. Фізичні і хімічні властивості: взаємодія з киснем, сіркою, водою, кислотами, лугами. Застосування Алюмінію та його сполук. Поширення в природі та біологічна роль
Освітні цілі: розглянути фізичні і хімічні властивості, застосування Алюмінію та його сполук, поширення в природі та біологічну роль. Формувати вміння складати рівняння реакцій, характерних для амфотерних сполук
Хід заняття
|
Етапи уроку |
Зміст |
Методи і методичні прийоми |
||||||||||||||||
|
Організа-ційний момент
Мотивація навчальної діяльності учнів
Мотивація навчальної діяльності учнів
|
Привітання з учнями класу. Перевірка готовності їх до уроку.
Кожен із нас має свою адресу. У хімічних елементів теж є дім. Це-періодична система Д.І.Менделєєва. Сьогодні ми з вами познайомимося ще з одним мешканцем. Він живе на третьому поверсі у третьому під’їзді. Що ж це за елемент ? Так, ви не помилилися. Найбільш поширений метал Як глина, у землі лежав Але знайшли чудовий спосіб І добувають його й досі. Він легкий в каструлях наших В яких ми варим борщ чи кашу Він срібний, наче сніг чи іній І зветься гарно-Алюміній |
Бесіда
Бесіда, розповідь, Демонс-трація таблиць, презента- ції
Бесіда, розповідь, Демон-страція таблиць, презента-ції |
||||||||||||||||
|
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу |
А тепер зайдемо до нього в гості, щоб ближче познайомитися. Та перед цим, щоб легше було спілкуватися з господарем, знайдемо його у періодичній системі та охарактеризуємо за планом : План 1)Символ елемента 2)Порядковий номер 3)Номер групи та підгрупи 4)номер періоду 5)Електронна будова атома 6)Валентність та ступені окиснення А тепер перевіримо: 1) Що ви можете сказати про положення Алюмінію у періодичній системі елементів? 2) Якою є електронна будова атома Алюмінію? 3)Чому дорівнює валентність алюмінію? 4)Який ступінь окиснення характерний для Алюмінію? 5)Які властивості (окисника чи відновника) проявляє Алюміній? 6)Яку просту речовину утворює Алюміній?
За допомогою ряду напруг зробіть висновки про активність Алюмінію.
Що ж являє собою господар квартири? Фізичні властивості алюмінію
|
Самостійна робота учнів
Самостійна робота учнів
Самостійна робота учнів
Самостійна робота учнів
Бесіда
Бесіда
Бесіда, демонстрація зразків алюмінію, робота з підручни ком
Бесіда, робота з підручником |
||||||||||||||||
|
Етапи уроку |
Зміст |
Методи і методичні прийоми |
||||||||||
|
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Вивчення нового матеріалу
Закріплення знань учнів
Оголошення домашнього завдання |
Написати рівняння реакцій: AL+O2= AL+CL2= AL+S= AL+H2SO4(p)= AL+H2SO4(k)= AL+HCL= AL+CuCL2= AL+NaOH+H2O= Що таке амфотерність? 2AL+6HCL=2ALCL3+H2 AL+2NaOH+2H2O=Na[AL(OH)4]+3H2
І. Застосування алюмінію (Технологи) Завдання для роботи в групі: Що таке металотермія? – відновлення активними металами менш активних металів з їх оксидів Хто є основоположником металотермії? – Бекетов Де використовується алюміній та його сплави? – літакобудування, металургія та ін. Чому Алюміній називають крилатим? – тому що його використовують в літакобудуванні (роблять корпус літаків) ІІ. Добування Алюмінію (Металурги) Завдання для роботи в групі: Заповнити таблицю:
ІІІ. Завдання для групи «Географи» Користуючись картою України, довідниками і підручниками, заповнити таблицю:
ІV. Завдання для групи «Історики» Хто першим відкрив Алюміній? – Велер Чому стародавнього майстра наказали осліпити? – правитель боявся, що «срібло з глини» знецінить золото і срібло з державної казни Чому алюміній називають «срібло з глини»? – Алюміній входить до алюмосилікатів, а глини – найпоширеніші з них. Як Велер добув Алюміній? – відновленням металічним калієм із алюміній хлориду Завдання для групи «Токсикологи» До мікро- чи до мікроелементів належить Алюміній? – мікро В яких органах і тканинах організму людини виявлено найбільший вміст Алюмінію? – див. текст для самостійного опрацювання та таблиці додатку. Яка роль йонів Алюмінію в організмі людини? – див. текст для самостійного опрацювання та таблиці додатку. У чому полягає токсична роль йонів алюмінію? – див. текст для самостійного опрацювання та таблиці додатку. Із 135 кг відходів було виплавлено 107 кг алюмінію. Яку масу бокситу було зекономлено? Здійснити перетворення:
Див. [52,75-78]
[52, 75-78]
|
бесіда робота з підручником
Пояснення, запис рівнянь, бесіда, демонстрація досліду Групова робота
Групова робота
Групова робота
Групова робота, робота з таблицями додатку, текстом для самостійного опрацювання, презентацією
Робота учнів біля дошки
бесіда
|
Додаток 1
Текст для самостійного опрацювання
Антропогенні джерела: стічні води підприємств хіміко-фармацевтичного, паперового, текстильного виробництв, виготовлення та використання алюмінієвих деталей, предметів, конструкцій, а також пакувального матеріалу (після термічної обробки продуктів в алюмінієвому посуді вміст його в них збільшується вдвічі).
Біологічна роль. В організмі людини вміст Алюмінію — 10-3%, Виявлений в усіх органах і тканинах. Найбільший вміст в легенях, печінці, кістках, головному мозку. Алюміній бере участь у побудові епітеліальної та сполучної тканин, у процесах регенерації кісткової тканини. Залежно від концентрації в організмі, здійснює активуючу чи інгібуючу дію на активність травних ферментів. Відомо, шо АI(NОз)з підвищує загальну кислотність організму і травну здатність шлункового соку, збільшує вміст у ньому вільної соляної кислоти. Алюміній впливає на центральну нервову систему (підвищений вміст в крові викликає її збудження, а понижений — гальмування).
Токсична дія: Алюміній — біологічний конкурент Феруму, Кальцію та Фосфору. Надлишок його в організмі людини призводить до порушення мінерального обміну, сповільнюється ріст і розмноження клітин. Алюміній має нейротоксичну дію — порушує рухову активність, викликає судоми, погіршує пам'ять.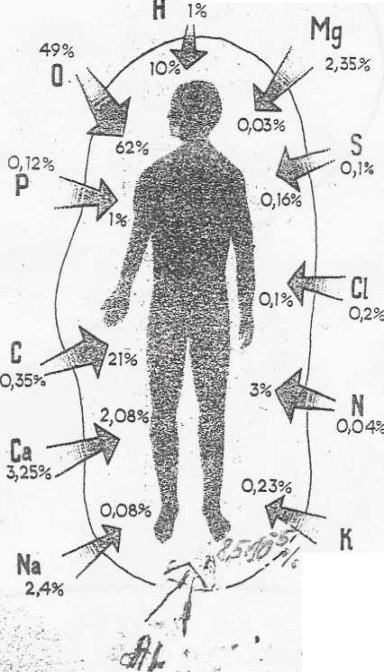
Рис 1 Вміст деяких елементів в організмі людини
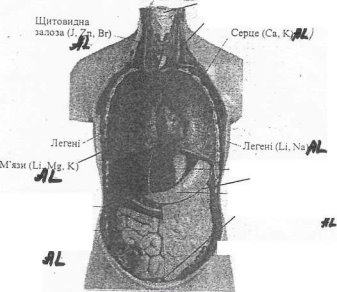
Рис. 2 Тканини і органи людського організму, які містять Алюміній
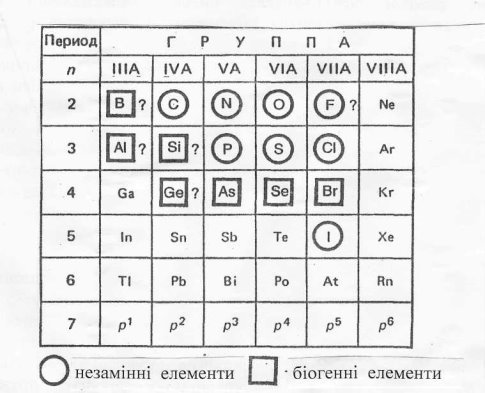
![]() Рис.3 Загальна характеристика р- елементів ( р- блок)"
Рис.3 Загальна характеристика р- елементів ( р- блок)"


про публікацію авторської розробки
Додати розробку
