Аміни. Ароматичні аміни. Властивості та застосування амінів
Тема. Нітрогеновмісні органічні речовини. Аміни, склад, будова їхніх молекул. Властивості.
Мета: вивчити склад та будову нітрогеновмісних органічних сполук, звернути увагу на аміни як представники цих сполук та їхні властивості, пояснити ці властивості на основі будови молекул амінів.
Очікуваний результат:
Учень:
- знає, які властивості мають нітрогеновмісні органічні речовини,
- пояснює властивості амінів,
- порівнює їхні властивості із можливими галузями застосування,
- розуміє значення будови та її взаємозв’язку із властивостями,
- аналізує властивості амінів.
Тип уроку: засвоєння нових знань.
Форми проведення уроку: робота з підручником, хімічним словничком, робота із схемами, групова робота.
Прилади і реактиви: схеми.
І. Організаційний момент.
ІІ. Мотивація навчальної діяльності.
Ми вивчили вуглеводні та оксигеновмісні органічні речовини. Як ви думаєте, чи є у складі органічних речовин інші елементи, крім тих, які ми знаємо: крім Карбону, Гідрогену, Оксигену? Виявляється, є. І це великий клас органічних сполук, що містять Нітроген – нітрогеновмісні органічні сполуки. Про них ми будемо говорити на сьогоднішньому уроці.
ІІІ. Вивчення нового матеріалу.
Вчитель. Нітрогеновмісні органічні сполуки є кількох видів.

![]()
![]()
 НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
![]()
![]()
![]()
![]()
![]()
АМІНИ АМІНОКИСЛОТИ БІЛКИ НУКЛЕЇНОВІ КИСЛОТИ
Аміни – це продукти заміщення атомів Гідрогену в молекулі амоніаку на вуглеводневі залишки.
![]()
![]()
![]() Первинні Вторинні Третинні
Первинні Вторинні Третинні
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() N N N
N N N
СН3 Н СН3 Н СН3 СН3
Н СН3 СН3
R – NH2 (NH2 – аміногрупа)
Завдання для класу: Як, на вашу думку, чи це усі види амінів?
Орієнтовна відповідь: Залежно від будови вуглеводневих залишків та особливостей хімічного зв’язку в них розрізняють насичені, ненасичені, циклічні й ароматичні аміни, а серед вторинних і третинних – ще й змішані.
Робота з підручником:
Група 1. Як даються назви амінам? (стор. 233)
Група 2. Якими чинниками зумовлена ізомерія амінів?
(Звіт груп)
ІV. Закріплення вивченого матеріалу.
Вправа 1. Визначте кількість ізомерних амінів, що мають формулу С3Н9N.
Вправи з підручника: № 282 – 286.
V. Домашнє завдання: вивчити відповідний §
Тема. Нітрогеновмісні органічні речовини. Аміни, склад, будова їхніх молекул. Властивості. Взаємодія амінів з водою і кислотами, горіння.
Мета: вивчити склад та будову нітрогеновмісних органічних сполук, звернути увагу на аміни як представники цих сполук та їхні властивості, пояснити ці властивості на основі будови молекул амінів.
Очікуваний результат:
Учень:
- знає, які властивості мають нітрогеновмісні органічні речовини,
- пояснює властивості амінів,
- порівнює їхні властивості із можливими галузями застосування,
- розуміє значення будови та її взаємозв’язку із властивостями,
- аналізує властивості амінів.
Тип уроку: засвоєння нових знань.
Форми проведення уроку: фронтальна бесіда, робота з підручником, групова робота, робота із схемами.
Прилади і реактиви: схеми.
І. Організаційний момент.
ІІ. Актуалізація життєвого досвіду.
- Перевірка домашнього завдання.
- Фронтально:
* що таке аміни?
* яка їхня загальна формула?
* чи всі аміни підпорядковуються цій формулі?
* чи мають аміни ізомерів?
ІІІ. Мотивація навчальної діяльності.
Кожного разу, вивчаючи новий клас речовин, після загального ознайомлення з ним ми переходимо до вивчення фізичних та хімічних властивостей. Сьогоднішній урок – не виняток: властивості амінів вивчатимемо на прикладі насичених амінів та їхнього найпростішого представника – метиламіну.
ІV. Вивчення нового матеріалу.
Вчитель. За будовою молекула метиламіну нагадує молекулу амоніаку. В обох молекулах атом Нітрогену сполучений простими ковалентними зв’язками із трьома іншими атомами.
Робота з підручником: прочитайте текст на стор. 236 та поясніть будову молекули метиламіну.
Групова робота:
Група 1. Скласти схему «Фізичні властивості метиламіну».
Група 2. Обґрунтувати тезу про те, що аміни є органічними основами.
Група 3. Пояснити за допомогою хімічних реакцій хімічні властивості амінів.
Група 4. Як добувають аміни?
Звіт груп – орієнтовно:
Група 1. Фізичні властивості:


![]()
![]()
 МЕТИЛАМІН
МЕТИЛАМІН
ГАЗ запах РІЗКИЙ РОЗЧИНЯЄТЬСЯ ТЕМПЕРАТУРА
НЕПРИЄМНИЙ У ВОДІ КИПІННЯ – 6,30С
Група 2. Насичені аміни є основами, сильнішими за амоніак. Завдяки більшому негативному заряду на атомі Нітрогену в молекулі аміну здатність цього атома сполучатися з катіоном Н+ зростає. Основні властивості у вторинних та третинних амінів виражені яскравіше, ніж у первинних.
Група 3. Хімічні властивості амінів:
- Взаємодія з водою: СН3NН2 + НОН → [СН3NН3]+ + ОН- (йон метиламонію)
- Взаємодія з кислотами: СН3NН2 + НСІ → [СН3NН3]СІ (метиламоній хлорид)
Їхні солі реагують з лугами: [СН3NН3]СІ + NаОН → СН3NН2 + NаСІ + НОН
- Реакції окиснення (горіння): 4СН3NН2 + 9О2 → 4СО2 + 2N2 + 10НОН
Група 4. Добування амінів:
У промисловості аміни добувають реакцією спиртів з амоніаком (під час нагрівання та в присутності каталізатора):
СН3ОН + NН3 → СН3NН2 + НОН
Подальша взаємодія аміну із спиртом призводить до утворення вторинного і третинного амінів.
Вчитель. Застосовують аміни у виробництві полімерів, синтетичних волокон, барвників, лікарських препаратів. Аміни різного складу і будови поширені у природі. Деякі з них мають високу фізіологічну активність. Багато з них – токсичні. Метиламін подразнює слизові оболонки, спричиняє порушення дихання, негативно діє на нервову систему і внутрішні органи.
V. Закріплення вивченого матеріалу.
1. Виконати вправи в підручнику
2. Скласти і розв’язати власний ланцюжок перетворень за участю амінів.
VІ. Домашнє завдання: вивчити відповідний §
Тема. Нітрогеновмісні органічні речовини. Анілін, склад, будова молекули. Властивості. Добування, застосування.
Мета: вивчити склад та будову нітрогеновмісних органічних сполук, звернути увагу на анілін як представник цих сполук та його властивості, пояснити ці властивості на основі будови молекули аніліну.
Очікуваний результат:
Учень:
- знає, які властивості мають нітрогеновмісні органічні речовини,
- пояснює властивості аніліну,
- порівнює їхні властивості із можливими галузями застосування,
- розуміє значення будови та її взаємозв’язку із властивостями,
- аналізує властивості аніліну.
Тип уроку: засвоєння нових знань.
Форми проведення уроку: робота з підручником, схемами та з хімічними перетвореннями, групова робота, «мікрофон».
Прилади і реактиви: схеми.
І. Організаційний момент.
ІІ. Актуалізація життєвого досвіду.
- Перевірка домашнього завдання.
- Здійсніть перетворення: метан → ацетилен → бензен → нітробензен → анілін.
ІІІ. Мотивація навчальної діяльності.
Остання речовина у вищезгаданому ланцюгу перетворень – анілін – являє собою ароматичний амін, тобто аміногрупу, сполучену з ароматичним кільцем. По-іншому його ще називають феніл амін. Ця речовина має велике промислове значення: з нього виготовляють міцний барвник чорного кольору, стійкий проти мила і світла. Одержують цей барвник взаємодією аніліну з хромовою сумішшю (К2Сr2О7 і Н2SО4), внаслідок якої одержують чорний осад. Крім того, анілін лежить в основі виробництва пластмас, вибухових речовин, виготовлення лікарських препаратів (білого стрептоциду, сульфадимезину тощо). Отож, анілін і буде сьогодні темою нашого уроку.
ІV. Вивчення нового матеріалу.
Вчитель. Анілін – це ароматичний амін, у якому бензенове кільце сполучене з аміногрупою. Формула його С6Н5NН2. По іншому його ще називають феніламін.
Робота з підручником:; розглянемо будову молекули аніліну.
Робота із схемою «Фізичні властивості аніліну»:


Безбарвна рідина Характерний запах
![]()


Розчиняється у спирті С6Н5NН2 Розчиняється у бензені


Речовина малорозчинна у воді Токсична речовина
Хімічні властивості аніліну
-
За участю аміногрупи (анілін проявляє слабші основні властивості, ніж амоніак та насичені аміни):
- Взаємодіє лише з сильними кислотами. Продуктами реакцій є солі – йонні сполуки, розчинні у воді.
С6Н5NН2 + НСІ → [С6Н5NН3]СІ (феніламоній хлорид).
При додаванні натрій гідроксиду до розчину солі феніламонію утворюється анілін, натрій хлорид і вода. Анілін виділяється у вигляді токсичних крапель.
- За участю бензенового кільця (анілін швидко реагує з бромною водою з утворенням жовтувато-білого осаду, при цьому відбувається заміщення у бензиновому кільці відразу трьох атомів Гідрогену на атоми Брому):
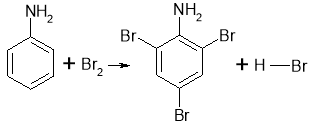
Завдання учням: Розставте коефіцієнти в даній реакції.
-
Реакції окиснення.
- Анілін, на відміну від бензену, окислюється на повітрі, перетворюючись на різні сполуки. Це – результат впливу аміногрупи на бензенове кільце.
- Якщо окисник – суміш калій дихромату К2Сr2O7 і концентрованої сульфатної кислоти утворюється барвник чорного кольору – так званий чорний анілін.
- Під час добавляння хлорного вапна або хлорної води до водного розчину аніліну виникає фіалкове забарвлення, яке мають продукти окиснення аміну. Це – якісна реакція на анілін.
- Повне окиснення відбувається так само, як і в бензену: анілін горить кіптявим полум’ям.
Робота у групах:
Група 1. Проаналізувати процес добування аніліну.
Група 2. Охарактеризувати умови під час добування аніліну.
Група 3. Пояснити галузі застосування аніліну.
Орієнтовні відповіді груп:
Група 1. Процес добування аніліну базується на реакції Зініна (1842 р.) – відновлення нітробензену за рівнянням:
С6Н5NО2 + 6Н → С6Н5NН2 + 2Н2О
Реакція відбувається за участі заліза і хлоридної кислоти. Цей процес і зараз використовують у промисловості.
Група 2. Процес добування аніліну за реакцією Зініна відбувається за допомогою відновлення нітробензену. Відновником є атомарний водень (атоми Гідрогену), які утворюються в перший момент взаємодії активного металу (заліза або цинку) з хлоридної кислотою.
Група 3. Із аніліну добувають багато його похідних, барвники, ліки, фотоматеріали, полімери, вибухові речовини.
V. Закріплення вивченого матеріалу.
І. «Мікрофон»:
- Що являє собою анілін?
- Чому основні властивості в аніліну виражені меншою мірою, ніж у метиламіну?
ІІ. Здійсніть перетворення: метан → ацетилен → бензен → нітробензен → анілін → 2,4,6-триброманілін.
ІІІ. Задача. Відновленням нітробензену масою 12,3 г добули анілін масою 4,4 г. Обчисліть масову частку виходу продукту реакції.
VІ. Домашнє завдання: вивчити відповідний § у підручнику


про публікацію авторської розробки
Додати розробку
