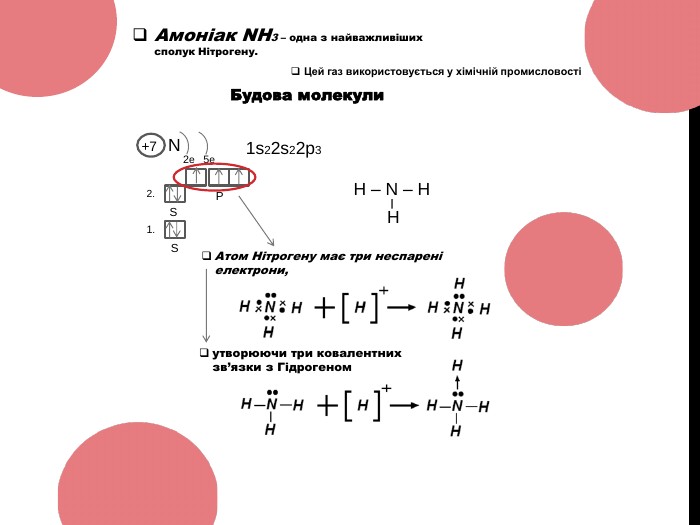
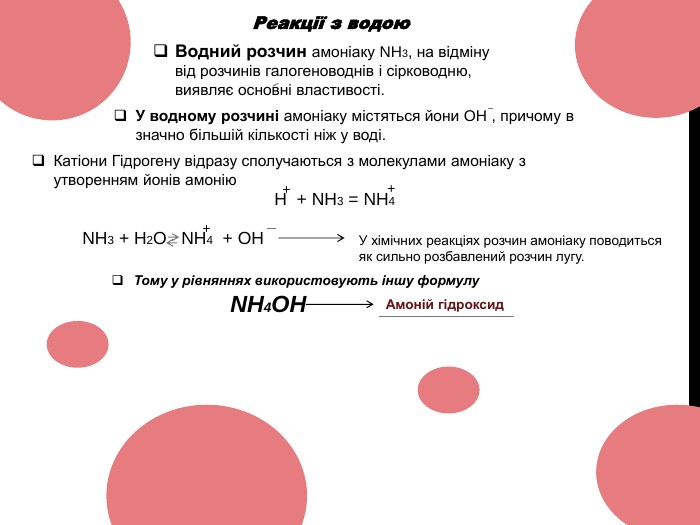
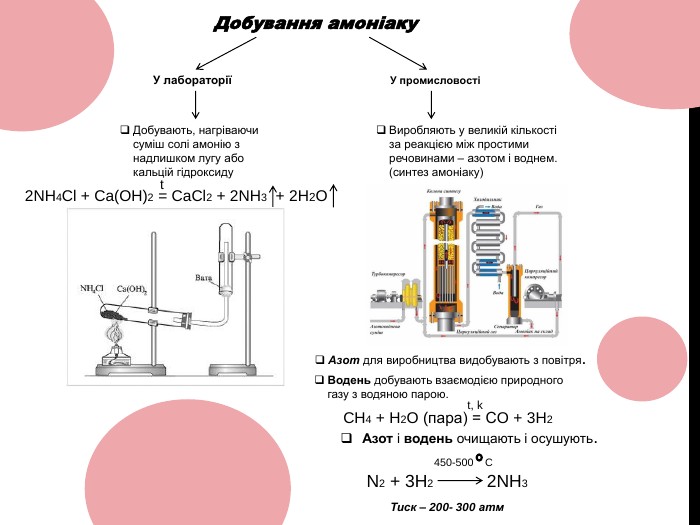
Амоніак 10 клас ( NH3 )
Про матеріал
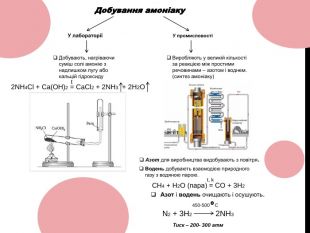
Хороша презентація до теми уроку: Амоніак (NH3). Матеріал містить відео з реакціями добування в лабораторії , його видобування в промисловості тощо… Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку