Ароматичні вуглеводні. Бензен
. Арени. Бензен
ПОНЯТТЯ ПРО АРЕНИ. За якісним складом арени належать до вуглеводнів і мають циклічну будову карбонового ланцюга.
Перший представник цього класу вуглеводнів — бензен С6Н6.
У структурній формулі бензену, запропонованій німецьким ученим Фрідріхом Августом Кекуле, шість атомів Карбону утворюють правильний шестикутник. Ще одним хімічним зв'язком кожний атом Карбону сполучений з атомом Гідрогену. Усі атоми розташовані в одній площині:
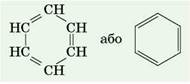
На перший погляд може видатись, що в молекулі бензену між атомами Карбону існують три подвійні і три одинарні ковалентні хімічні зв'язки. Але це не так, тому що бензен не знебарвлює ані бромну воду, ані розчин калій перманганату. Тобто не виявляє властивостей ненасичених вуглеводнів — алкенів чи алкінів. Пояснюється це тим, що в молекулі бензену існує особливий вид хімічного зв'язку — ароматичний зв'язок. Під час його утворення одна р-орбіталь кожного атома Карбону перекривається з такими самими двома р-орбіталями (по одній від кожного сусіднього атома Карбону). Тому всі зв'язки С—С у бензені однакові й мають довжину 0,140 нм. Ця відстань менша від відстані між атомами Карбону в алканів, але більша, ніж в алкенів. Тому точнішим є запис структурної формули бензену у вигляді правильного шестикутника з колом усередині нього (так зване бензенове кільце):
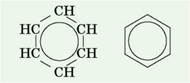
Формула Фрідріха Кекуле також досить часто використовується, але при цьому зважають, що вона лише умовно передає будову молекули бензену.
ФІЗИЧНІ ВЛАСТИВОСТІ АРЕНІВ. Бензен — безбарвна рідина з характерним запахом, нерозчинна у воді й легша за неї. Він добре розчиняється в різних органічних розчинниках, і сам є розчинником багатьох органічних речовин. Бензен — дуже токсична речовина, вдихання навіть незначної кількості парів якої викликає запаморочення й головний біль. За більш високої концентрації бензену в повітрі людина може втратити свідомість. Бензен здатний проникати через шкіру. Так само небезпечні для довкілля викиди підприємств і смог, до складу яких входить бензен. У роботі з бензеном необхідно неухильно дотримуватися правил безпеки, усі досліди проводити під витяжкою, уникати потрапляння на відкриті ділянки шкіри.
ХІМІЧНІ ВЛАСТИВОСТІ БЕНЗЕНУ. Наявність особливого ароматичного хімічного зв'язку, в утворенні якого беруть участь відразу шість р-електронів, визначає хімічні властивості бензену та його гомологів.
Характерними для бензену є реакції, що відбуваються зі збереженням ароматичного зв'язку. Приклад — реакції заміщення атома Гідрогену атомом галогену.
1. Реакції заміщення.
1.1. Галогенування. Ця реакція відбувається в присутності каталізаторів.
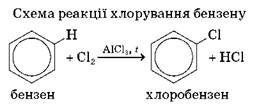
або
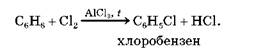
2. Реакції приєднання. Бензен вступає також у реакції приєднання, але важче, ніж алкени чи алкіни. У цих реакціях ароматичний зв'язок руйнується, внаслідок чого в молекулі з'являється шість (по одному біля кожного атома Карбону) неспарених електронів. Вони беруть участь в утворенні шести одинарних ковалентних хімічних зв'язків з атомами реагенту (водню чи галогену). Розглянемо це на прикладах.
2.1. Гідрування. Приєднання водню до бензену відбувається за підвищеної температури в присутності каталізаторів.
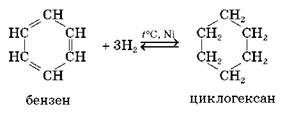
2.2. Приєднання галогенів. Як і приєднання водню, ця реакція відбувається за участю всіх атомів Карбону бензенового кільця завдяки розриву ароматичного зв'язку. Для її проведення реагенти опромінюють ультрафіолетом і нагрівають.
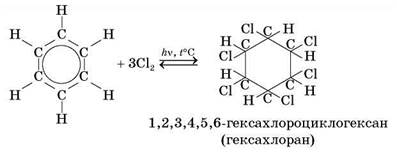
Хлорування бензену має практичне значення. Одержану речовину — гексахлоран — використовують у боротьбі з комахами (шкідниками полів і садів).
3. Окиснення бензену. Бензен стійкий до дії окисників і не знебарвлює розчин калій перманганату. Більш сильні окисники окиснюють його.
3.1. Горіння (повне окиснення) бензену. Бенезен легкозаймистий на повітрі й згорає кіптявим полум'ям унаслідок високого вмісту Карбону в молекулі.
2С6Н6 + 15О2 → 12СО2 + 6Н2О; ΔΗ = 3135,6 кДж
Проведіть обчислення та порівняйте вміст Карбону (у %) у гексані й бензені.
З повітрям і киснем бензен утворює вибухонебезпечні суміші.
Від будови молекули бензену залежать його властивості. У реакції заміщення він вступає легше, ніж алкани, у реакції приєднання — важче, ніж алкени.
Бензен використовують у виробництві пластмас, барвників, отрутохімікатів, лаків, вибухових речовин, синтетичних волокон, ліків та багатьох інших органічних речовин.
Сторінка ерудита
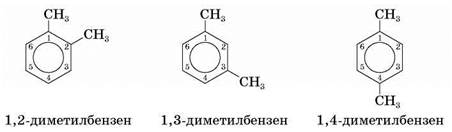
Назва аренів за систематичною номенклатурою складається з назви вуглеводневого замісника (префікс) і слова бензен (корінь).

Якщо замісників два чи більше, положення кожного зазначають номером атома, з яким він зв'язаний. Нумерацію кільця проводять так, щоб локанти замісників були найменшими. Наприклад:
Стисло про основне
• Бензен С6Н6 — найпростіший представник вуглеводнів класу арени.
• Молекула бензену має особливий ковалентний хімічний зв'язок, утворений одночасним перекриванням електронних хмар шести р-електронів. Тому, незважаючи на різницю в кількісному складі молекул гексену й бензену, якісні реакції з бромною водою та розчином калій перманганату для бензену не властиві.
• Для бензену більш характерні реакції заміщення зі збереженням бензенового кільця, ніж приєднання з його розривом.
Знаємо, розуміємо
- 1. Назвіть молекулярну формулу бензену, напишіть відомі вам структурні формули цієї речовини.
- 2. Перелічіть фізичні й хімічні властивості бензену, про які ви довідалися з параграфа.
- 3. Які речовини є продуктами горіння, галогенування, гідрування бензену?
Застосовуємо
1. Установіть відповідність між вуглеводнем і класом, до якого він належить.
Вуглеводень
- 1 Гексин
- 2 Гексен
- 3 Бензен
- 4 Гексан
Клас речовин
- А Алкани
- Б Арени
- В Алкіни
- Г Алкадієни
- Д Алкени
2. Укажіть правильне твердження щодо фізичних властивостей бензену.
- А важчий за воду
- Б має специфічний запах
- В темно-бурого кольору
- Г розчинний у воді
3. Проаналізуйте твердження.
I. Бензен і бутан мають однаковий якісний склад.
II. Гідрування бензену належить до реакцій розкладу.
III. Бензен — оксигеновмісна органічна речовина.
IV. Бензен — отруйна речовина.
Правильні з-поміж них лише...
- А І і III
- Б І і IV
- В II і III
- Г II і IV
4. Розташуйте речовини за збільшенням кількості атомів Гідрогену в молекулі.
- А етен
- Б пропан
- В бензен
- Г етин
5. Обчисліть кількість теплоти, що виділяється в навколишнє середовище внаслідок згорання бензену кількістю речовини 6 моль.
6. Який об'єм вуглекислого газу виділиться внаслідок згорання достатньої кількості бензену в кисні об'ємом 300 л (н. у.)?
7*. Установіть причиново-наслідкові зв'язки між складом і будовою бензену.


про публікацію авторської розробки
Додати розробку
