Атоми і молекули. Будова атома. Наноматеріали.










![Фізична величина, яка дорівнює кількості молів частинок речовини, називається кількістю речовини ν : ν = N/NA, де N – число частинок речовини, NA – стала Авогадро. Одиниця кількості речовини в СІ – моль: [ν] = 1 моль. Фізична величина, яка дорівнює кількості молів частинок речовини, називається кількістю речовини ν : ν = N/NA, де N – число частинок речовини, NA – стала Авогадро. Одиниця кількості речовини в СІ – моль: [ν] = 1 моль.](/uploads/files/1797597/243034/262332_images/11.jpg)
![Маса даної речовини, узятої в кількості 1 моль (6,02 × 1023 молекул), називається молярною масою М речовини: M = mo × NA,де mo - маса молекули (атома) даної речовини. Одиниця молярної маси в СІ – кілограм на моль: [M] = 1 кг/ моль. Молярна маса дорівнює відносній молекулярній масі, поданій у грамах: M = Mr × 10-3 кг/моль Маса даної речовини, узятої в кількості 1 моль (6,02 × 1023 молекул), називається молярною масою М речовини: M = mo × NA,де mo - маса молекули (атома) даної речовини. Одиниця молярної маси в СІ – кілограм на моль: [M] = 1 кг/ моль. Молярна маса дорівнює відносній молекулярній масі, поданій у грамах: M = Mr × 10-3 кг/моль](/uploads/files/1797597/243034/262332_images/12.jpg)



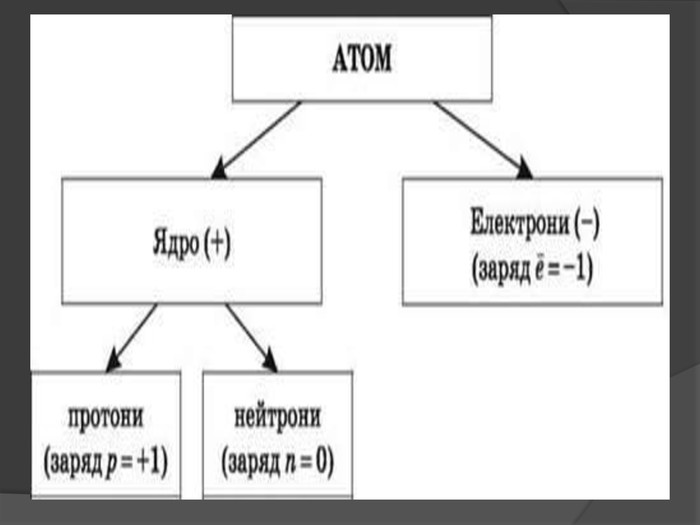
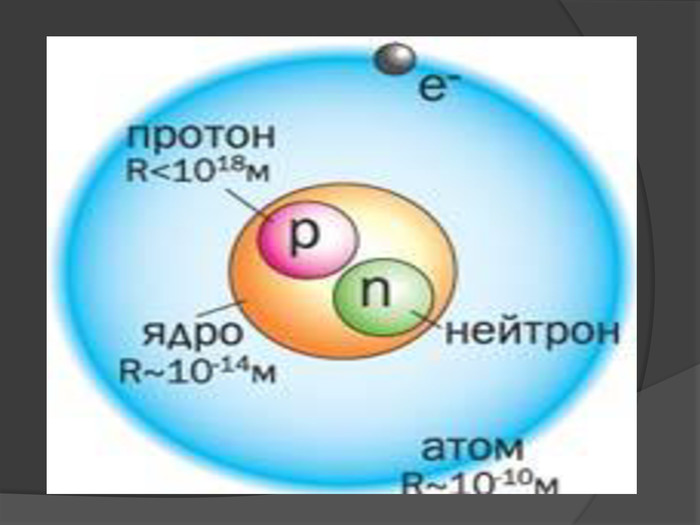








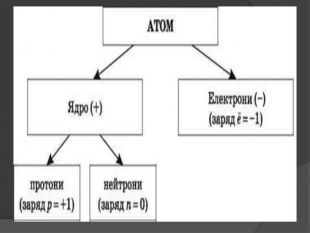
Іон – атом або молекула, який має електричний заряд. Якщо іон має позитивний заряд , його називають катіоном, а якщо від’ємним – аніоном. У вигляді самостійних частинок іони зустрічаються у всіх агрегатних станах речовин: газах, рідинах, твердих станах та у плазмі. Якщо атом або молекула втратили один або кілька електронів, вони стають позитивним йоном; якщо ж до атома (молекули) приєднались один або кілька електронів, утворюється негативний йон.
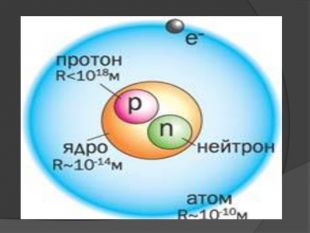
Розміри атомів і молекул. Розміри молекул настільки малі, що це важко уявити. Якщо молекулу води (d ≈ 3×10-10 м) збільшити в мільйон разів, то вона матиме розмір крапки (≈ 0,3 мм). Зрозуміло, що й маси атомів і молекул теж малі (порядку 10-26 кг). Вимірювати їх у таких одиницях, як кілограм, дуже незручно, тому було впроваджено позасистемну одиницю – атомну одиницю маси, яка дорівнює 1/12 маси атома Карбону 12 6 C:1 а.о.м. = 1/12 mо (12 6 C) ≈ 1,66 × 10-27кг
Макроскопічні тіла складаються з величезного числа частинок. Визначимо, наприклад, кількість молекул у склянці води (m = 0,2 кг). Маса молекули води mo ≈ 3, 0 × 10-26 кг. Отже, у склянці води міститься: N = m/mo ≈ 7×1024 молекул. Рахують таку величезну кількість мікрочастинок певними «порціями» - молями. В одному молі будь – якої речовини міститься однакова кількість атомів або молекул, - стільки, скільки атомів Карбону міститься у вуглеці масою 12 г. Це число має назву стала (число) Авогадро: NA ≈ 6,02 × 1023 моль-1.
Маса даної речовини, узятої в кількості 1 моль (6,02 × 1023 молекул), називається молярною масою М речовини: M = mo × NA,де mo - маса молекули (атома) даної речовини. Одиниця молярної маси в СІ – кілограм на моль: [M] = 1 кг/ моль. Молярна маса дорівнює відносній молекулярній масі, поданій у грамах: M = Mr × 10-3 кг/моль
Кількість речовини масою m і молярною масою M можна визначити за формулою:ν = m/M Число N молекул речовини дорівнює: N = m/M × NA Відношення числа молекул N до об’єму V, який займають ці молекули, називається концентрацією молекул і позначають n:n = N/V. Концентрація молекул вимірюється в 1/м3 ., .
Учимося розв’язувати задачі. Задача 1. Скільки вільних електронів міститься в алюмінієвому бруску розмірами 1× 4× 5 см? Вважайте, що кожний атом Алюмінію дає один вільний електрон. Задача 2. Визначте, яку масу мають 50 молів вуглекислого газу CO2. Задача 3. Визначити у молях кількість речовини, яка міститься у 200 г води.
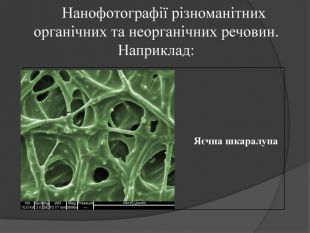
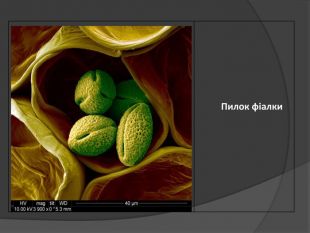
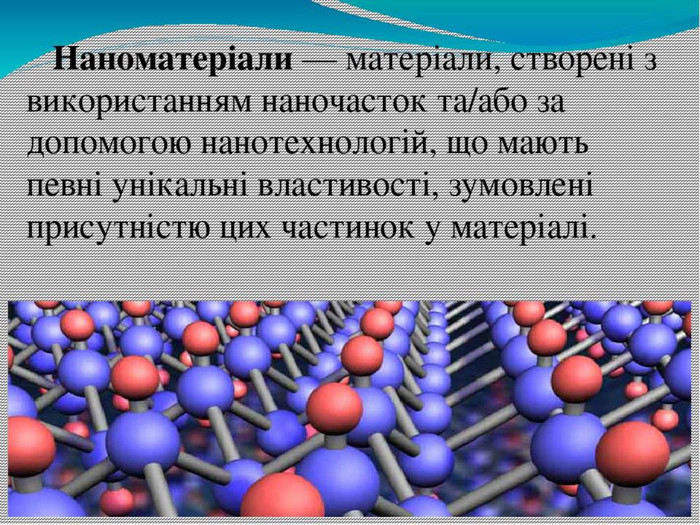
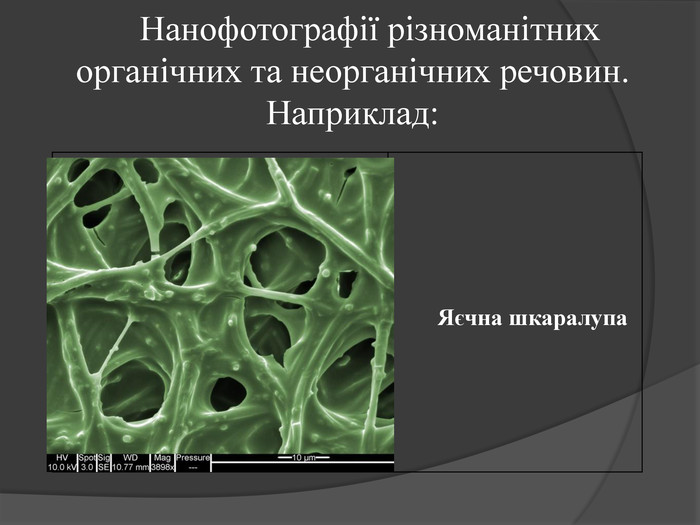
Нанотехнології — технології розроблення продуктів і компонентів, розмір яких не перевищує 100 нанометрів (один нанометр дорівнює мільярдній частині метра: 1 нм = 1·10–9 м). Розвиток нанотехнологій став можливим після відкриття фулеренів – нової алотропної модифікацї атома Карбону(1985 р.). Властивість Карбону утворювати надтонкі матеріали і стало основою сучасних нанотехнологій. Графен – штучно отримана гексагональна модифікація (2004 р.) з одноатомного шару Карбону. Його міцність на порядок вища за міцність будь-якої відомої науці речовини. Має надзвичайну електропровідність.


про публікацію авторської розробки
Додати розробку