: Бензен як представник ароматичних вуглеводнів: склад, електронна і структурна формули, фізичні властивості.
Тема: Бензен як представник ароматичних вуглеводнів: склад, електронна і структурна формули, фізичні властивості.
Цілі:
- Формування ключових компетентностей:
- комунікативна;
- технологічна;
- уміння вчитись упродовж життя;
- соціальна;
- формування предметних компетентностей:
- ознайомити учнів з ароматичними вуглеводнями на прикладі бензену; розглянути склад, електронну і структурну формули; фізичні властивості бензену.
- звернути увагу на отруйність бензену.
Обладнання: пробірки з водою, жир, бензен, розчин калій перманганату, бромна вода.
Тип уроку: вивчення нового матеріалу
Форми проведення: бесіда, розповідь, демонстрація, складання таблиць, робота учнів у парах, складання опорного конспекту
Очікування результатів навчальних досягнень:
знати: загальну формулу аренів, склад , електронну і структурну формули; фізичні властивості , правила техніки безпеки при роботі з ними.
СТРУКТУРА УРОКУ
1.Організаційний етап
2.Оголошення теми й мети уроку
3.Актуалізація опорних знань
4.Мотивація навчальної діяльності
5.Вивчення нового матеріалу
6 Первинна перевірка засвоєння знань.
7 Підсумок уроку. Рефлексія.
8 Домашнє завдання
Хід уроку
I.Організація класу
З метою визначення психологічного настрою учнів на співробітництво проводимо тест “Личка”. Учням пропонують намалювати усмішку на виданому малюнку. Заняття проводять з урахуванням отриманих даних від учнів.
II.Оголошення теми й мети уроку
III. Актуалізація опорних знань
Розв’язування задач на знаходження молекулярної формули речовини
Учням пропонується дати характеристику речовин, що відповідають отриманому складу.
Задача1.
Знайдіть молекулярну формулу речовини масові частки Карбону та Гідрогену у якій відповідно становлять 92,3% та 7,7%. Відносна густина пари речовини за воднем дорівнює 39.( C6H6)
Задача2.
Вивести формулу речовини , що містить 82,75% Карбону, 17.25% Гідрогену. Відносна густина парів цієї речовини за повітрям дорівнює 2.
(С4Н10)
Задача 3.
Визначте молекулярні формули вуглеводнів, масова частка Карбону в якому дорівнює 85,7%, а Гідрогену – 14,3%. Відносна густина речовини за дорівнює
28. ( С4Н8)
Бесіда
1.Які реакції є якісними на ненасичені вуглеводні?
2.Назвіть загальні формули вивчених насичених, ненасичених вуглеводнів. Як в них змінюється співвідношення кількості атомів Карбону і Гідрогену?
Аналіз результатів задач
У 2 та 3 задачах ми вивели формули речовин, які належать до знайомих гомологічних рядів, а у 1 задачі ми отримали формулу речовини , яка нам ще невідома й невідомий гомологічний ряд, до якого вона належить.
IY.Мотивація навчальної діяльності
Отже, виникла проблема, яку ми маємо розв’язати на уроці. Сьогодні ми ознайомимось із новою групою органічних речовин.
Історія відкриття бензену ( розповідь вчителя)
Ще одним гомологічним рядом вуглеводнів є ряд ароматичних сполук ( арени). Назва першого представника ароматичних вуглеводнів – бензен. Молекулярна формула бензену- C6H6,[7]
Прийом “Проблемне питання ”
- Ознайомлення із молекулярною формулою бензену наштовхує нас на думку про ненасиченість цієї сполуки. А чи справді це так?
Y.Вивчення нового матеріалу
- Демонстрація
Взаємодія бензену з розчином калій перманганату або бромною водою
Бензен вливають у розчин калій перманганату або бромної води. Знебарвлення цих розчинів не відбувається. Отже, бензен не належить до ненасичених вуглеводнів.
Деякі учні сприймають забарвлення шару бензену бромною водою як реакцію між цими сполуками. Слід нагадати , що в реакціях з ацетиленом та етиленом спостерігається знебарвлення брому, а в цьому досліді спостерігається змішування бензену і брому, отже ,відбувається не хімічне, а фізичне явище.
Таким чином, склад бензену свідчить про ненасиченість сполуки, а досліди не підтверджують цього. Яка ж структура бензену?
Така сама проблема стала перед хіміками середини XIXст.. Історія розкриття хімічної будови бензену, що тривала протягом 40 років( обов’язково треба дати змогу учням пофантазувати і запропонувати свої варіанти формул складу C6H6).
Прийом “Інформаційна хвилинка”
“ Днем народження ” теорії будови бензену як ароматичної сполуки є 27 січня 1865 рік – день, коли в Бюлетні Паризького хімічного товариства було опубліковано інформацію про “ Конституцію ароматичних речовин”.
Формула, запропонована А.Кекуле, хоча і є загально прийнятою, але не зовсім точна :
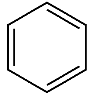
Зокрема , згідно з цією у молекулі бензену мають бути зв’язки різної довжини: одинарні- 0,154нм і подвійні – 0,134нм, а насправді усі вони вирівняні і становлять 0,149нм.
Причина: енергія спряження трьох подвійних зв’язків . Завдяки спряженню всі C-C зв’язки вирівняні. Це якісно нові зв’язки , їх називають ароматичні, або полуторні.
На основі з’ясування електронної будови молекули була запропонована формула з кільцем усередині шестикутника:
- Наявність кільцевого Π-зв’язку характерні для всіх ароматичних вуглеводнів.
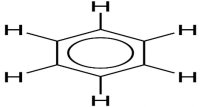
Вона дає змогу пояснити і стабільність молекули бензену завдяки рівномірному розподілу електронної густини між атомами Карбону всередині шестикутника. Однак хіміки більш полюбляють користуватись формулою Кекуле. Це не лише данина традиції, бо завдяки цій формулі вдається пояснювати деякі електронні ефекти, що спостерігаються в молекулі бензену. Відомості про будову молекули бензену учні самостійно узагальнюють у вигляді схеми:
Структурна формула:
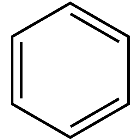
Довжина зв’язку: 0,140нм
Валентний кут: 120 ⁰
Тип гібридизації: sp2- гібридизації
Енергія зв’язку: 412 кДж ̷ моль
- Учням дається завдання зіставити схеми будови для етану, етилену, ацетилену. На основі цих схем складається узагальнююча таблиця.
- “Творча лабораторія ”
Учні працюють із куле-стрижневими моделями, вчаться моделювати молекулу бензену та звертають увагу: а) на однакову довжину C –Cзв’зку; б) на плоску будову молекули.
- Визначення понять
- арени;
- ароматичність;
- ароматичний зв’язок;
- ароматичне ядро;
- Фізичні властивості бензену
- Робота з підручником
Пропонуємо учням виписати фізичні властивості бензену.
- ДЕМОНСТРАЦІЯ
ЗМІШУВАННЯ БЕНЗЕНУ З ВОДОЮ
Бензен з водою при змішувані утворює емульсію, яка при відстоюванні розділяєтьсяса два шари: бензен і воду.
РОЗЧИНЕННЯ ЖИРУ У ВОДІ І БЕНЗЕНІ
До води і бензену додати кілька крапель жиру .З водою жир при збовтуванні утворює емульсію, яка при відстоюванні поділяється на два шари. У бензені жир розчиняється з утворенням однорідного розчину.
- Біологічні властивості бензену
Розповідь учителя. Складається опорна схема:
![]() БЕНЗЕН Отруйний
БЕНЗЕН Отруйний
![]() Викликає запоморочення , головний біль
Викликає запоморочення , головний біль
![]()
Втрата свідомості
![]() Подразнення очей, слизової оболонки
Подразнення очей, слизової оболонки
![]() Систематичне вдихання парів викликає лейкемію і анемію\
Систематичне вдихання парів викликає лейкемію і анемію\
![]() Робота з бензеном вимагає особливої обережності
Робота з бензеном вимагає особливої обережності
YI. Первинна перевірка засвоєння знань
- Прийом “ Бліцопитування ”
- Що значить поняття “ ароматичність ”?
- Загальна формула аренів.
- Молекулярна формула аренів.
- Який тип гібридизації електронних хмар атомів Карбону в молекулі бензену?
- Схарактеризуйте ароматичний зв’язок у порівнянні з ординарним і подвійним?
- Назвіть ознаки будови молекули бензену за схемою
- Чому робота з бензеном вимагає особливої обережності?
YII. Підсумок уроку. Рефлексія.
- Прийом “ Робимо висновок ”
Учні формують висновок у трьох реченнях.
Рефлексія. Прийом “Продовжте фразу”
- Сьогодні на уроці я довідався….
- Тепер я можу…..
- Я зрозумів….
- Чи впоралися ми з поставленими на початку уроку завданнями7
- Де ми можемо використати набуті знання?
YIII. Домашнє завдання
Опрацювати § 11 №169, 170,173 с.72

про публікацію авторської розробки
Додати розробку
