Будова атома: ядро й електоронні оболонки. Cклад атомних ядер.
План-конспект уроку на тему «Будова атома: ядро й електоронні оболонки. Cклад атомних ядер» мета якого – вивчити питання будови атомів хімічних елементів та склад атомних ядер, розкрити зміст порядкового номера хімічного елемента, пояснити закономірність розміщення атомів хімічних елементів у Періодичній системі, підвести учнів до сучасного формулювання періодичного закону, формувати уявлення про матеріальну єдність світу й можливість його пізнання.
Відкритий урок для 8 класу на тему:
«Будова атома: ядро й електоронні оболонки.
Cклад атомних ядер»
Корчик Тетяна Василівна
учитель хімії
Ліщанської загальноосвітньої школи І-ІІІ ступенів
2016
Анотація: План-конспект уроку на тему «Будова атома: ядро й електоронні оболонки. Cклад атомних ядер» мета якого – вивчити питання будови атомів хімічних елементів та склад атомних ядер, розкрити зміст порядкового номера хімічного елемента, пояснити закономірність розміщення атомів хімічних елементів у Періодичній системі, підвести учнів до сучасного формулювання періодичного закону, формувати уявлення про матеріальну єдність світу й можливість його пізнання.
Тема уроку: Будова атома: ядро й електоронні оболонки. Cклад атомних ядер.
Мета уроку:
-
навчальний зміст:
- розглянути питання про будову атомів хімічних елементів;
- вивчити склад атомного ядра.
-
діяльність учителя:
- ознайомити учнів з будовою атомів хімічних елементів
- дати знання про склад атому: ядро, електрони; склад ядра – протони, нейтрони.
- розкрити зміст порядкового номера хімічного елемента у Періодичній системі.
- підвести учнів до сучасного формулювання Періодичного закону.
-
процеси особистісного розвитку:
- сформувати вміння характеризувати хімічні елементи за положенням у періодичній системі хімічних елементів.
- формувати уявлення про матеріальну єдність світу й можливість його пізнання.
-
навчальну діяльність учня:
- пояснювати закономірність розміщення атомів хімічних елементів у Періодичні системі хімічних елементів
- обчислювати кількість протонів, електронів та нейтронів у складі атому хімічного елемента.
Обладнання: підручник, таблиця «Періодична система елементів Д.І.Менделєєва», сигнальні картки (зеленого і червоного кольорів), опорна схема «Будова атома», Базові поняття та терміни:
атом, ядро, електрон, протон, нейтрон, нуклон, модель атома, порядковий номер.
Тип уроку: урок засвоєння нових знань.
Методи навчання: пояснювально-ілюстративний, проблемного викладу, метод «світлофору», «знайди помилку».
Структура уроку.
- Організаційний момент.
- Актуалізація опорних знань, уявлень та чуттєвого досвіду.
- Мотивація навчальної діяльності.
- Оголошення теми, мети та завдань уроку.
- Вивчення нового матеріалу.
- Осмислення нових знань і умінь.
- Закріплення, систематизація та узагальнення.
- Контрольно-коригувальний етап.
- Підбиття підсумків уроку.
- Інструктаж щодо виконання домашнього завдання.
ХІД УРОКУ
- Організаційний момент.
Привітання, перевірка готовності учнів до уроку, налаштування на робочий настрій.
- Актуалізація опорних знань, уявлень та чуттєвого досвіду.
Метод «світлофор» (самооцінка).
Підніміть картку зеленого кольору, якщо ви вважаєте, що твердження є правильним і картку червоного кольору якщо ви вважаєте, що твердження є неправильним.
- За оcнову класифікацїї хімічних елементів Д.І.Менделєєв взяв відносну атомну масу хімічних елементів.
- У Періодичній системі Д.І.Менделєєва хімічні елементи розміщені у порядку зменшення їх відносних атомних мас.
- Період – це горизонтальний ряд хімічних елементів, розміщених в порядку зростання їх відносної атомної маси, що розпочинається лужним металом і закінчується інертним газом.
- Періоди бувають великими, середніми і малими.
- Періоди, що складаються з одного ряду хімічних елементів називаються малими.
- Елементом ІІ періоду є Сульфур.
- Група – це вертикальний стовпчик, де містяться подібні елементи.
- До IV групи належить елемент Нітроген.
- Мотивація навчальної діяльності.
- Уявіть собі дамські рукавички, які носила вчена Марія Склодовська-Кюрі, щоб прикрити руки, безжалісно понівечені радієм, який вона досліджувала. (1911 рік)
- Відвідувачі Всесвітньої виставки в Брюсселі ціпеніли, коли дивились на рукавички, які вона носила. Ше в 1958 році – через півстоліття – вони відчували не запах парфумів, а «голос» того самого радію, якого безстрашно торкалися руки відважної жінки.
- Зверніть увагу на суперчність у періодичній системі Д.І.Менделєєва на три пари елементів: Телур – Іод (№52 – 53); Аргон – Калій (№18 – 19); Кобальт – Нікол (№27 – 28) розміщені не в порядку зростання їхніх атомних мас, а навпаки.
- Оголошення теми, мети та завдань уроку.
Проаналізувати історію відкриття будови атому, дослідити будову атома хімічних елементів, порівняти чим атоми хімічних елементів відрізняються та подібні між собою.
- Вивчення нового матеріалу.
І. ІСТОРІЯ ВІДКРИТТЯ.
Довгі роки хіміки звикали до того, що складні речовини складалися з елементів, а елементи – з атомів. Пізніше з’ясувалося що і прості речовини складаютья з атомів.
Періодичний закон і періодична система хімічних елементів вплинули на розвиток науки і техніки: вони послужили теоретичним фундаментом і спрямованого пошуку й відкриття 46 елементів зі 111 відомих на сьогодні, крім того поштовхом до дослідження будови атома. Атом вважався елементарною (неподільною) частинкою.
У 1896 році французький фізик А.Беккерель виявив, що матеріали, які містять уран засвічують у темряві фотопластинку. У 1903 році П’єр і Марія Склодовська-Кюрі одержали Нобелівську премію за відкриття радіоактивності. У 1911 році М.Склодовська-Кюрі була удостоєна Нобелівської премії за відкриття чистого радію.
Найбільших успіхів у вивченні атома досяг англійський учений Ернест Резерфорд. У 1909 році він провів свій знаменитий експеримент. Він дійшов висновку, що в центрі атома існує маленьке ядро, яке заряджене позитивно та містить усі протони та нейтрони і в ньому зосереджена практично вся маса атома. У той же час у зовнішніх шарах атома містяться негативно заряджені електрони, маса яких занадто мала.
Аналізуючи результати свого експерименту, Резерфорд запропонував «планетарну» модель будови атома, якою з невеликими змінами ми користуємося і досі.
Відповідно до цієї моделі в центрі ядра зосереджений весь позитивний заряд атома, яке оточене негативно зарядженими електронами. Електрони рухаються навколо ядра як планети навколо Сонця по певних орбітах. Це довели група вчених з Харківського фізико-технічного інституту та зробила перші в історії науки знімки атома.
Отже:
Атом – електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів.
ІІ. СКЛАД АТОМІВ.
Після встановлення складної будови атомів з’ясувалося, що і ядра атомів мають складну будову. Ядро атома складається із двох частинок – протонів і нейтронів. Протони мають позитивний заряд, а нейтрони заряду не мають. Тобто весь позитивний заряд зосереджений у ядрі атома і їх загальне число дорівнює заряду ядра. Маси протона і нейтрона приблизно дорівнюють 1 а.о.м.
Уявіть собі, що діаметр ядра в 100 000 разів менше діаметра атома.
Узагальнюючи:
Якщо до ядра атома входить 8 протонів, то заряд ядра його атома дорівнює +8. Атом – електронейтральна частинка, тому навколо цього атома має обертатися 8 негативно заряджених електронів.
Яка ж маса даного атома?
Маса кожного протона та нейтрона приблизно дорівнює 1а.о.м., а маса всіх електронів дорівнює 0. Отже маса атома дорівнюватиме 10 а.о.м.
Протони й нейтрони мають загальну назву – нуклони.
Загальне число протонів і нейтронів – нуклонне число.
Протонне число (порядковий номер елемента) дорівнює величині заряду його ядра.
Визначення складу атомного ядра.
p= порядковому номеру (+);
е= порядковому номеру (-);
n= різниця атомної маси та порядкового номера
N = A – Z
N кількість нейтронів
A нуклонне число (атомна маса)
Z протонне число (порядковий номер)
Приклад:
Fе + 26 Мg + 12
p= +26 p= +12
е= -26 -е= -12
n= 30 n= 12
У зв’язку з відкриттям будови атома було змінено і формулювання Періодичного закону:
«Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їх атомних ядер.»
- Закріплення, систематизація та узагальнення.
- Добери пару (асоціація):
- Протон - Масове число
- Нейтрон - Позитивний заряд
- Нуклон - Має негативний заряд
- Електрон - Ядро і електрони
- Порядковий
номер - Заряд ядра атома
- Атом - Не має заряду
- Контрольно-коригувальний етап.
Завдання 1 На дошці вішаю таблицю. Учням пропоную її заповнити по черзі. Результати продемонструвати та обговорити.
|
Символ елемента |
Назва |
Протонне число |
Нуклонне число |
Кількість е (-) |
Кількість р(+) |
Кількість n |
|
Р |
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
С |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
АІ |
|
|
|
|
|
|
|
К |
|
|
|
|
|
|
|
Li |
|
|
|
|
|
|
Завдання 2. Дайте характеристику будови атома елементів
а) № 13,
б) № 15 за їх положенням у періодичній системі.
Приклад. № 13. Al — 3 період, ІІІ група, головна підгрупа, p = 13, e = 15, вища валентність — ІІІ, вищий оксид — Al2O3, амфотерний гідроксид — Al(OH) або HAlO2.
Біля дошки один учень виконує аналогічне завдання для хімічного елемента з № 15.
Р — 3 період, V група, головна підгрупа, p = 15, e = 15, n = 31 -15 = 16, вища валентність — V, вищий оксид — P2О5, кислота — H3PO3.
Завдання 3 За даними формулами знайти хімічний елемент
- а 2 – (в – с) = е
а – кількість нейтронів в атомі Літію;
b – протонне число атома Фосфору;
c – загальна кількість електронів в атомі Карбону
e – порядковий номер елемент.
Відповідь: Нітроген
2) а + (в 2 – с) = е
a – протонне число атома Силіцію;
b– заряд ядра атома Бору;
c – загальна кількість електронів в атомі Оксигену;
e – порядковий номер елемента.
Відповідь: Галій.
- Підбиття підсумків уроку.
Виставлення оцінок, оголошення результатів уроку.
- Інструктаж щодо виконання домашнього завдання.
Диференціація завдання:
Опрацювати параграф
Виконати завдання :Роздаю дидактичні картки учням по варіантах
Заповніть таблиці.
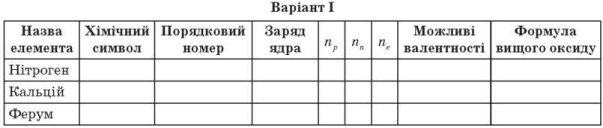
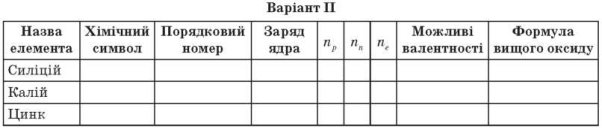
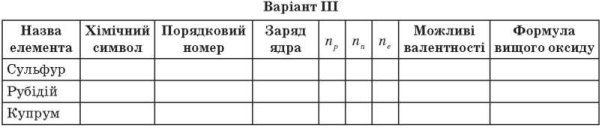
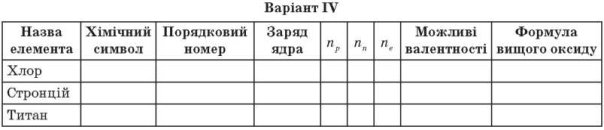
Література:
- І.В.Олійник, Л.Є.Кучер. «Уроки хімії», 9 клас: Посібник для вчителя – Тернопіль: Навчальна книга – Богдан, 2004. – 144с.
- П.П.Попель, Л.С.Крикля. Підручник для загальноосвітніх навчальних закладів, 8 клас – Київ: Видавничий центр «Академія», 2008. – 234 с.
- Н.І. Гусарук, Хімія. Робочий зошит. Класні, домашні, лабораторні досліди, - Харків, 2006.
- О.В.Григорович, О.В.Гостіннікова. Матеріали уроків – Харків: Вєста – «Ранок», 2008. – 192с.
- К.Люцис. – Москва: Русское енцеклопедическое товарищество, 2001. – 640с. ил.
- Буринська Н.М. Викладання хімії у 8-9 класах загальноосвітньої школи: Методичний посібник для вчителів. – Ірпінь: ВТФ «Перун», 2000. – 144с.
- Ткачов В.В. Хімія. Тренувальні тести. – Харків: Вид. група «Основа», 2008. – 208 с.
- Данильченко В.Є., Фрадіна Н.В. Хімія. 8-9 класи Навчальний посібник. – Харків.: Країна мрій, 2002. – 184с.
- Григорович О.В. Хімічні диктанти. 7-9 класи – Харків: Видавництво «Ранок», 2008, - 160с.
- Шаповалов С.А. Хімія. Довідник старшокласника та абітурієнта. – Харків: Торсинг Плюс, 2006. – 368с.
- Ярошенко О.Г. Хімія: підручник для 8 класу загальноосвітніх навчальних закладів. – Київ.: Освіта, 2008. – 208с.
- Григорович О.В. та ін. Хімія 8 клас: Розробки уроків.- Харків, «Ранок», 2008. – 304 с.
Тема «Алкоголь – проблема соціальна та економічна»
Мета: поглибити та систематизувати знання учнів про насичені одноатомні спирти; з’ясувати згубну дію алкоголю на організм людини; виховати негативне ставлення до вживання алкоголю; розвивати пам’ять, мислення; вчити аналізувати та порівнювати.
Тип уроку: узагальнююче комбіноване семінарське заняття.
Обладнання: таблиці, картки для самостійної роботи, ілюстрації.
План уроку
І Організація учнів.
II.Актуалізація опорних знань.
Клас поділити на дві команди.
„Спиртові перегони”
1.Кожна команда по черзі висловлює 1 речення, що стосується спиртів (думка закінчена, речення змістовне): визначення, властивості, застосування спиртів.
Спирти - оксигеновмісні сполуки.
Спирти-органічні речовини.
Гліцерин-трьохатомний спирт.
Етанол - наркотична речовина. Тощо.
2.” Впізнай мене”.(завдання на швидкість).
Очолює ряд насичених одноатомних спиртів (метанол).
Його використовують для пом’якшення шкіри рук, виготовлення мазей, в косметології(гліцерин).
Наркотична речовина, призводить до захворювання на алкоголізм(етанол).
Ароматичний спирт, кристалічна речовина з характерним запахом(фенол).
Утворює солі, які називають метилати (метанол).
Отруйна речовина, солі цього спирту називають феноляти(фенол).
Трьохатомний спирт, є сировиною для добування вибухових речовин(гліцерин).
Його використовують для добування етилену методом внутрішньо- молекулярної дегідратації(етанол).
III. Семінар на тему” Алкоголь-проблема соціальна та економічна”.
а) історія виготовлення спирту;
б) історія боротьби з пияцтвом;
в) шкідливий вплив алкоголю на організм людини;
г) біологічні основи алкоголізму;
д) алкоголь і потомство.
Хід заходу
Учитель. Ви вивчили тему „Спирти”, і знаєте, що це важливий продукт народного господарства. Етанол серед названих речовин є найбільш поширеним. Людина здавна вживає етиловий спирт для харчування. Часте вживання спирту призводить до тяжких змін в організмі людини. Тому наш урок ми проведемо у формі семінару „ Алкоголь - проблема соціальна і економічна”
Ви всі готувались до уроку, і сьогодні ви не просто учні, а вчені, лікарі, дослідники, біологи і повинні вирішити проблему, як запобігти пияцтву. (фрагмент відеофільму 5.15-6.05)
Учитель. Загляньмо у минуле й дізнаймося, коли ж людина почала виготовляти спирт.
Учений. Чистий спирт почали добувати у V-VII ст. араби й назвали його ”алькоголь”, що означає” одурманюючий”. Першу пляшку горілки виготовив араб 860 року. Перегонка вина для добування спирту різко посилила пияцтво. Певно саме це і стало приводом для заборони вживання спиртних напоїв, до якої вдався основоположник ісламу Магомет. Відтоді в мусульманських країнах алкоголь не вживають, а хто відступав від закону – жорстоко карали.
У Західній Європі за часів Середньовіччя також навчилися добувати міцні напої. За легендою, алхімік Валеніус, який добув спирт, заявив, що він знайшов чудесний еліксир, який старого робить молодим, стомленого – бадьорим, а зажуреного – веселим. Злу силу алкоголю розуміли багато людей. Мартін Лютер писав: „Кожна країна повинна мати свого диявола: наш німецький диявол – добра бочка вина.”
Поширення пияцтва на Русі пов’язане з політикою панівних класів. Костомаров, російський історик, довів, що в Стародавній Русі пили дуже мало. Лише на великі свята варили мед, брагу, пиво, міцність яких не перевищувала 5-10 градусів. У будні не вживали алкоголю зовсім, це було великим гріхом.
Учитель. Життя показало, що заборона продажу спиртних напоїв не зменшує пияцтва, а навіть провокує його. Отже, сухий закон – не вирішує цієї проблеми в країнах, бо традиції й звички мають велику силу.
Учень. Із сарказмом перелічує приводи для пияцтва англійський поет Р.Бернс:
Щоб випити є для цього приводи:
Хрестини, свято, зустріч, проводи.
Мороз, відлига, рік Новий,
Веселий настрій і сумний,
Розлуки, поминки, весілля,
Одужання і новосілля,
На службі успіх, новий чин,
І так пияцтво – без причин.
Протягом віків формувалися звичаї і ритуали пити „за ваше здоров’я”; хмільне стали вважати джерелом радості, щастя та бадьорості.
У віках міцно закріпилися традиції відмічати зі спиртними напоями будь-яке свято, весілля, день народження чи смерть людини, успіхи та невдачі в житті. Тобто проблема надмірного вживання алкоголю існує споконвіку.
Учитель. Боротьба із пияцтвом має давню історію. „Історик” зробить екскурс в минуле.
„Історик”. Боротьба з алкоголізмом така давня, як і самі спиртні напої. У Стародавній Греції пити нерозведене вино (міцність його не перевищувала 10 градусів) вважалося недостойним вільного громадянина. Правитель Спарти заборонив пити вино вищій знаті, але заохочував споювання рабів, щоб тримати їх у покорі.
У Афінах правитель Соломон запровадив „сухий закон”, за яким службових осіб карали за пияцтво: вперше великим штрафом, а повторно – стратою.
Давньоримський історик Пліній Старший писав, що перси та мідяни були переможені греками під керівництвом О. Македонського, бо в них було розвинуто пияцтво та інші пов’язані з цим пороки.
У 20-х роках нашого століття в США теж запровадили „сухий закон”, який забороняв виробництво та вживання спиртних напоїв. Цілковита заборона була приречена на провал, нелегальне виробництво алкоголю стало найприбутковішим бізнесом. 1993 року „сухий закон” скасували.
Учитель. Вживанню алкоголю сприяють і багато хибних думок про його цілющі властивості. Їх розвіє „лікар-нарколог”.
„Лікар-нарколог”. Напевно, ви не раз чули вислів: „ Вип’ємо – зігріємось”.
Побутує думка, нібито спирт добре зігріває організм. Недарма про вина часто кажуть, як про зігрівальні напої. Вважають, що спирт має лікувальну дію при деяких хворобах. Чи так це? Ні. Невеликі дози алкоголю справді збуджують апетит. Вважають також, що алкоголь підбадьорює, поліпшує настрій, самопочуття, що має неабияке значення для компанії молодих людей. Дехто переконаний, що алкоголь – висококалорійний продукт, який швидко забезпечує організм енергією в екстремальних умовах. А в пиві та виноградних винах є цілий набір вітамінів та ароматичних речовин. У медицині використовують спирт для дезинфекції, приготування ліків, але ніяк не для лікування хвороб.
Міркування на користь алкоголю – це досить поширені хибні думки. Збудження апетиту після чарки горілки чи сухого вина триває лише короткий час. Далі алкоголь тільки шкідливо впливає на органи травлення, бо спиртне паралізує участь у травленні печінки та підшлункової залози.
Бехтерєв писав, що пияцтво є віковим злом, яке глибоко пустило коріння в нашому побуті й породило цілу низку „ випивальних” звичаїв. І досі вважають, мовляв, однією з ознак чоловічої доблесті є вміння пити. Але так говорять п’яниці, адже в дійсності, коли знаходиш сили протистояти чарці – ти справжній мужчина. Ще Толстой писав, що людина п’є вино для того, щоб заглушити голос совісті.
Учитель. У багатьох людей виробилась пристрасть до алкоголю. Тому вчених цікавить, як саме впливає алкоголь на організм і які він викликає зміни. Звернімось до багатолітніх досліджень цієї проблеми, про результати яких нам розповість „біолог „
”Біолог”. Хвороблива пристрасть до алкоголю може виникнути у тварин будь якого виду, коли їх привчати пити вино. Тому вченим дуже зручно вивчати дані зміни на тваринах. Проводили досліди з пацюками та мишами. Спосіб споювання дуже простий: у воду для пиття щоденно додавали дедалі більші дози спирту. Через деякий час чисту воду тварини відмовлялися пити. Тварини поводять себе як справжні алкоголіки. Жахливо!
Вплив алкоголю на організм людини і його працездатність визначається не тільки кількістю випитого алкоголю, але й багатьма іншими факторами. Якщо алкоголь вживати на порожній шлунок, він швидше всмоктується, і людина швидше п’яніє. Швидше і сильніше діє алкоголь на людей під час хвороби, при втомі, а також у стані збудження. Ступінь сп’яніння залежить від індивідуальної сприйнятливості, віку, статі, маси тіла і ступеня звикання. Одна і та ж доза алкоголю у різних людей спричинюється до неоднакових порушень у перебігу фізіологічних і психічних процесів і по різному впливає на їх працездатність.
Учитель. Ми почули наукові дані, але варто було б почути думку фахівця, що безпосередньо має справу з проблемою алкоголізму. Отже, „невропатолог”.
„Невропатолог”. Алкоголь отруює клітини мозку, зменшує кількість кисню в них, заважає здійсненню нормального процесу обміну речовин. Діяльність кори великого мозку різко порушується.У деяких осіб зловживання алкоголем призводить до психічних розладів. Найчастіше трапляються біла гарячка, алкогольний галюциноз, алкогольне марення ревнощів, психоз. Алкоголь шкідливо впливає і на внутрішні органи.
Потрапляючи в людський організм, етанол дифундує крізь стінки шлунка і кишківника в кров, досягаючи печінки, проходить через неї і циркулює по всьому тілу, отруюючи організм.
При концентрації його 0,5г/л – помітних змін немає;
0,5-1,0г/л - сп’яніння не помічається, але нервові центри функціонують неправильно;
2г/л –втрачається контроль за поведінкою.
Важливо також знати час дії алкоголю на організм. Алкоголь всмоктується через 20-30 хвилин після вживання, але із збільшенням дози найбільший ступінь сп’яніння спостерігається через1-1,5 години. Перші прикмети сп’яніння з’являються після прийняття 0,5 мг на 1кг маси, тобто 30 г алкоголю для людини масою 60 кг. Після прийняття 80 г горілки чи 500 г пива алкоголь діє протягом доби. Якщо людина випила ввечері, зранку її не можна вважати тверезою.
Учитель. Чому людині, яка навіть не усвідомила цієї звички, так важко її перебороти? Про біологічні основи алкоголізму нам розкаже „біолог”.
„Біолог”. Потрапляючи в організм людини, алкоголь знищує нервову систему, органи травлення, серцево-судинну, статеву системи.
Давно відомо, що в осіб, які зловживають спиртним, розвиваються тяжкі захворювання печінки. Адже печінка очищає кров від отруйних речовин, що потрапили до організму, зокрема від алкоголю. Беручи участь у знешкодженні спирту, печінка сама зазнає його шкідливої дії. Алкоголь викликає запальну реакцію в клітинах печінки, вони зневоднюються, ущільнюються і гинуть. Відбувається часткова заміна цих клітин щільними сполучно-тканинними рубцями. Таким чином, алкогольний гепатит переходить у необоротне захворювання - цироз печінки.
Не залишається байдужою до отруйної дії спирту і серцево-судинна система.
Якщо невеликі дози алкоголю зумовлюють короткочасне підвищення артеріального тиску, іноді незначний біль у ділянці серця, то систематичне зловживання спиртним призводить до необоротних змін у судинній системі й м’язі серця, до грубих дефектів стінок судин. Такі зміни призводять до передчасного розвитку атеросклерозу й гіпертонічної хвороби, перебіг яких часто ускладнюється крововиливом у мозок та інфарктом міокарда.
Спиртні напої шкідливо діють на легені, нирки, ендокринні залози, знижують опірність організму до інфекцій. (навчальна таблиця).
Учитель. Алкоголь не тільки вбиває власне життя, але є загрозою для тих, хто поруч. Про це нам розповість” працівник органів правопорядку.”
„Працівник органів правопорядку”. Встановлено, що третина дорожньо - транспортних пригод стається з вини людей, які перебували в стані сп’яніння. Через це загинуло 37,7% загальної кількості потерпілих. Навіть малі дози алкоголю сповільнюють реакцію, підвищують ризик.
Однак найнебезпечнішим є неадекватне ставлення п’яної людини до свого стану, оскільки алкоголь гальмує центри кори головного мозку, які контролюють дії і вчинки. Вона переоцінює свої можливості і недооцінює складність виробничої ситуації. П’яний за кермом, верстатом чи на іншому робочому місці набагато небезпечніший, ніж хворий чи працівник у стані вираженої втоми. Твереза людина розуміє, що її можливості обмежені, і намагається бути особливо уважною і обережною.
Людина, яка зловживає алкоголем, дратівлива, емоційно нестійка, погано спить, швидко втомлюється. Об’єктивним показником дози алкоголю є вміст його в крові. При вмісті алкоголю в крові працівника 0,3-0,9% ймовірність виникнення небезпеки зростає в 7 разів, при 1,0-1,4% -у 31раз, при 1,5%- у 128 разів.
Небезпека вживання алкоголю навіть в малих дозах підтверджується тим, що після двох кружок пива кількість алкоголю в крові людини масою 75 кг становить 0,9%, після 0,5 л вина -1,2%, чарки горілки чи коньяку -1,1%. При вмісті алкоголю 1,6-2% водій не може оцінити і розрахувати швидкість, у нього порушується координація рухів, він не орієнтується в дорожній ситуації.
При надто великих дозах алкоголю в крові іноді спостерігається навіть секундна втрата свідомості, що може завершитися катастрофою.
Алкоголізм не дає людині можливості мати міцну життєву позицію, самоутвердтится. Він веде до паразитичного способу життя, до постійного пошуку грошей, до злочинів.
Учитель. Пияцтво запалює „зелене світло „ злочинності. Мовою фактів:
-у нетверезому стані скоєно 55% усіх крадіжок, 79% пограбувань, 96% убивств. Алкоголь підштовхує людину на злочин.
-смертність серед тих, хто систематично вживає спиртне вдвічі вища, ніж серед непитущих.
-більшість хворих на алкоголізм помирають у віці до 50 років
-самогубства серед таких осіб реєструються в 10 разів частіше, ніж серед населення загалом.
Треба покласти цьому край! Є над чим задуматись.
„Лікар-гінеколог”. Алкоголізм – тяжка хронічна хвороба. Вона розвивається на основі регулярного і тривалого вживання алкоголю й характеризується нестримним потягом до спиртного і деградацією особистості. Алкоголізм руйнує сім’ю, порушує суспільне життя людини.
Але найзгубніше алкоголь впливає на потомство. Ще на початку століття німецький лікар Крепелін писав, що коли пияцтво пошириться серед жінок, то нащадкам загрожує цілковита загибель. Почнемо з таких, як на вашу думку, менш шкідливих напоїв: пиво, вино, шампанське. Після частого вживання цих напоїв ваша дитина може народитися розумово відсталою, хворобливою. Такі діти часто хворіють на шизофренію, бувають недоумкуватими, народжуються глухонімими, з тяжкими розладами функцій залоз внутрішньої секреції тощо. А тепер поговоримо про тих, хто вживає кон’як, віскі, горілку. З’ясовано, що дія такого алкоголю на внутрішньо-утробний розвиток плоду призводить до недорозвинення плоду, окремих його частин, збільшує ризик виникнення нервово - психічних розладів, захворювання органів травлення.
Закони Давньої Греції та Риму забороняли молодим людям пити спиртне. На Русі вважалося поганою звичкою пити вино на власному весіллі.
Статистикою доведено, що алкоголізм генетично не передається
Учитель. На завершення нашого уроку хочу розповісти вам легенду, яка називається „Усе залежить від тебе”.
Колись давно, у давньому Китаї жив дуже розумний, але пихатий Мандарин (знатний вельможа). Увесь день його складався із примірок вишуканого вбрання та розмов із підданими про свій розум...Так минали дні за днями, роки за роками...Аж ось країною пішов поголос, що неподалік від кордону з’явився мудрець, розумніший за всіх на світі. Дуже розлютився на те Мандарин: хто може називати якогось там ченця найрозумнішим? Але свого обурення не виказав, а запросив мудреця до себе у палац. Сам же задумав обдурити його:” Я візьму у руки метелика, сховаю його за спиною і запитаю, що у мене в руках – живе чи мертве? І якщо чернець скаже, що живе – я розчавлю метелика, а якщо мертве – випущу його”.
І ось настав день зустрічі. У залі зібралося багато людей. Усім кортіло послухати словесний поєдинок найрозумніших людей у світі.
Мандарин сидів на високому троні, тримав за спиною метелика і чекав приходу ченця. Аж ось двері відчинилися і до зали ввійшов невеликий худорлявий чоловік. Він підійшов до Мандарина, привітався і сказав, що готовий відповісти на будь - яке його запитання. Мандарин мовив: „ Скажи-но мені, що я тримаю в руках – живе чи мертве?” Мудрець трохи подумав, усміхнувся і відповів:” Усе в твоїх руках”. Збентежений Мандарин випустив метелика з рук і той полетів на волю, радісно тріпочучи своїми яскравими крильцями.
Отже, лише від вас залежить, чи буде ваше життя довгим і щасливим.
Я бажаю вам щастя, добра і перш за все, здоров’я. Нехай нікому з вас не доведеться спіткнутись на шляху власного життя, хоч яким би тернистим він не був.
Пам’ятайте: Хворобу легше попередити, ніж вилікувати. Розумна людина завжди знайде, як цікаво провести вільний час і без спиртного.
10 заповідей здоров’я.
- Шануй своє тіло як найвеличніший вияв життя.
- Відмовся від усякої ненатуральної їжі та енергетичних напоїв.
- Підживлюй своє тіло природними живими продуктами.
- Присвяти свої роки безкорисливому служінню своєму здоров’ю.
- Відновлюй своє здоров’я правильним балансом діяльності і відпочинку.
- Очищуй свої клітини, тканини і кров свіжим повітрям і сонячним світлом.
- Відмовся від будь – якої їжі, коли твоєму розуму чи тілу недобре.
- Утримуй свої думки, слова й емоції чистими, спокійними і піднесеними.
- Постійно збагачуй свої знання законів природи, радій зі своєї праці.
- Підкорися законам природи.
Тема: Розв’язування задач. Обчислення за хімічними рівняннями кількості речовини, маси або об’єму за кількістю речовини, масою або об’ємом реагенту, що містять певну частку домішок.
Мета: повторити послідовність дій під час розв’язування розрахункових задач та навчити учнів розв’язувати задачі на обчислення за хімічними рівняннями кількості речовини, маси або об’єму за кількістю речовини, масою або об’ємом реагенту, що містять певну частку домішок; розвивати вміння застосовувати теоретичні знання при розв’язуванні хімічних задач та користуватися знаннями, набутими з інших предметів; виховувати свідоме ставлення до навчання, вміння організовувати власну навчальну діяльність.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, медіа презентація теми, диференційований роздатковий матеріал, «шпаргалка» для учнів.
Тип уроку: вивчення нового матеріалу.
Форми і методи роботи: розповідь учителя з елементами бесіди, колективне обговорення проблемного питання, індивідуальна робота, розв’язування задач, самостійна робота над диференційованими завданнями.
ХІД УРОКУ
І. Організаційний етап.
Привітання з класом. Перевірка готовності до уроку. Налаштування учнів на позитивний емоційний стан, побажання успіхів у роботі. Наприклад: «Нехай труднощі тебе не лякають – повір у себе!»
ІІ. Повідомлення теми і визначення основних цілей уроку. Мотивація навчання.
Вчитель звертає увагу учнів на епіграф уроку, просить учнів пояснити, як вони розуміють суть вислову
«ТЕОРІЯ БЕЗ ПРАКТИКИ МЕРТВА»
ІІІ. Вивчення нового матеріалу.
- Вступне слово вчителя. Хімікам добре відомо, що в результаті хімічних реакцій утворюється менша кількість продуктів, ніж розраховано за рівнянням реакції. Як ви думаєте, чому? Всі виказані учнями думки беруться до уваги. Завершуючи обговорення поставленої проблеми, вчитель зауважує, що для характеристики технологічних процесів використовується поняття Чи знаєте ви, що… для успішної роботи на уроці недостатньо лише вашої присутності в класі. Запам’ятайте поради вчителя, і тоді робота на уроці буде для вас легкою і зрозумілою.
- Уважно слухайте і намагайтеся зрозуміти вчителя.
- Задавайте питання, якщо ви чогось не зрозуміли.
- Скористайтесь можливістю попрацювати біля дошки.
- Спробуйте самостійно розв’язати задачу.
- Поступово підвищуйте рівень складності запропонованих задач.
- І ще раз наголошую: задавайте питання, якщо виникли труднощі. Це не контрольна робота, а урок формування знань!
- Вчитель пропонує учням пригадати послідовність дій при розв’язуванні розрахункових задач (дивись «Шпаргалки для учнів»).
- Першу задачу розв’язуємо разом з учителем.
- Наступну задачу вчитель пропонує розв’язати одному з учнів. при цьому контролює і, в разі потреби, коментує хід розв’язання.
- Учням пропонуються різнорівневі задачі для розв’язування самостійно. Кожен має сам визначити, яку задачу обрати. Тут головне як не занижувати, так і не перевищувати свої сили.
Починаємо!
V. Оцінювання роботи учнів на уроці.
Задачі на домішки
- Який об’єм сульфуру (ІV) оксиду утвориться після спалювання 400 кг сірки, що містить 5% домішок?
![]() Дано:
Дано:
m (S)з дом = 400 кг ω (S) = 100% - 5% = 95%
ω (дом.) = 5%
![]() m (S) = ω%(S) ∙ m (Sз дом.)
m (S) = ω%(S) ∙ m (Sз дом.)
V(SO2) - ? m (S) = 400∙ 0,95 = 380 кг
380 кг Х м3
S + O2 = SO2
32 кг 22,4 м3
380 ∙ 22,4
![]() Х = = 266 м3
Х = = 266 м3
32
Відповідь: V(SO2) = 266 м3
- Нагріли бертолетову сіль масою 25,725 г з масовою часткою домішок 0,05 до повного її розкладу. Який об’єм кисню виділиться?
![]() Дано:
Дано:
m (KClO3 )з дом = 25,725 г ω (KClO3) = 1- 0,05 = 0,95
ω (дом.) = 0,05
![]() m (KClO3) = ω%( KClO3) ∙ m (KClO3)з дом.
m (KClO3) = ω%( KClO3) ∙ m (KClO3)з дом.
V(O2) - ? m (KClO3) = 25,725 ∙ 0,95 = 24,4 г
24,4 г Х л
2KClO3 = 2KCl + 3O2
2∙122,5 г 3∙22,4 л
24,4 ∙ 22,4∙3
![]() Х = = 6,7 л
Х = = 6,7 л
2∙122,5
Відповідь: V(O2) = 6,7 л
- Залізний порошок масою 7 г з масовою часткою домішок 20% розчинили в надлишку сульфатної кислоти. Яка маса солі та об’єм газу утворилися?
![]() Дано:
Дано:
m (Fe )з дом = 7 г ω (Fe) = 100% - 20% = 80%
ω (дом.) = 20%
![]()
m (FeSO4) - ? m (Fe) = ω%( Fe) ∙ m (Fe)з дом.
V(H2) - ? m (Fe) = 7 ∙ 0,80 = 5,6 г
5,6 г y г Х л
Fe + H2SO4 = FeSO4 + H2
56 г 152 г 22,4 л
5,6 ∙ 22,4
![]() V(H2) = = 2,24 л
V(H2) = = 2,24 л
56
5,6∙152
![]() m (FeSO4) = = 15,2 г
m (FeSO4) = = 15,2 г
56
Відповідь: m (FeSO4) = 15,2 г, V(H2) = 2,24 л
- При обробці вапняку масою 30 г хлоридної кислотою, утворився вуглекислий газ об’ємом 5,6 л. Визначте масову частку не карбонатних домішок у вапняку.
![]() Дано:
Дано:
m (CaCO3)з дом = 30 г х г 5,6л
V (CO2) = 5,6 л CaCO3 + 2НCl = CaCl2 + CO2 + H2O
![]() 100 г 22,4 л
100 г 22,4 л
ω (дом) - ? 100∙5,6
![]() m (CaCO3) = = 25 г
m (CaCO3) = = 25 г
22,4
m (CaCO3)
![]() ω (CaCO3) =
ω (CaCO3) =
m (CaCO3)з дом
25
![]() ω (CaCO3) = = 0,8333 або 83,33%
ω (CaCO3) = = 0,8333 або 83,33%
30
ω (дом) = 100% - 83,33% = 16,67%
Відповідь: ω (дом) = 16,67%
- * Металічний натрій спалили в атмосфері хлору об’ємом 49,28 л (н.у.) з масовою часткою домішок 10%. Яка маса солі, якщо речовини прореагували повністю?
![]() Дано: V m V m V∙ M
Дано: V m V m V∙ M
![]()
![]()
![]()
![]()
![]() V (Сl2)з дом = 49,28 л υ = ; υ = ; = ; m =
V (Сl2)з дом = 49,28 л υ = ; υ = ; = ; m =
ω (дом.) = 10% Vm M Vm M Vm
![]()
m (NaCl) - ? 49,28 ∙ 71
![]() m (Cl2) = = 156,2 г
m (Cl2) = = 156,2 г
22,4
ω (Сl2) = 100% - 10% = 90%
m (Сl2) = ω%( Сl2) ∙ m (Сl2з дом.)
m (Сl2) = 156,2∙ 0,90 = 140,58 г
140,58 г Х г
Na + Cl2 = 2NaCl
71 г 58,5 ∙2 г
140,58 ∙ 58,5∙2
![]() Х = = 231,66 г
Х = = 231,66 г
71
Відповідь: m (NaCl) = 231,66 г
- Магній оксид масою 3,4 г з масовою часткою домішок 5% повністю розчинили в сульфатній кислоті. Яка маса солі утворилася?
![]() Дано:
Дано:
m (MgO )з дом = 3,4 г ω (MgO) = 100%- 5% = 95%
ω (дом.) = 5%
![]() m (MgO) = ω%( MgO) ∙ m (MgO)з дом.
m (MgO) = ω%( MgO) ∙ m (MgO)з дом.
m(MgSO4) - ? m (MgO) = 3,4 ∙ 0,95 = 3,23 г
3,23 г Х г
MgO + H2SO4= MgSO4 + H2O
40 г 120 г
3,23 ∙ 120
![]() Х = = 9,69 г
Х = = 9,69 г
40
Відповідь: m(MgSO4) = 9,69 г
- Яка маса вапняку (СаСО3), що містить 5% некарбонатних домішок, необхідні для одержання негашеного вапна масою 112 г?
![]() Дано:
Дано:
ω (дом) = 5% х г 112 г
m (CaO) = 112 г CaCO3 = CaО + CO2
![]() 100 г 56 г
100 г 56 г
m (CaCO3)з дом - ? 100∙112
![]() m (CaCO3) = = 200 г
m (CaCO3) = = 200 г
56
m (CaCO3)
![]() m (CaCO3)з дом=
m (CaCO3)з дом=
ω (CaCO3)
ω (CaCO3) = 100% - 85%= 95%
200
![]() m (CaCO3)з дом. = = 210,5 г
m (CaCO3)з дом. = = 210,5 г
0,95
Відповідь: m (CaCO3)з дом = 210,5 г
- Чому дорівнює маса негорючих домішок у вугіллі, якщо при спалюванні його зразка масою 26 кг утворилося 86 кг вуглекислого газу?
![]() Дано:
Дано:
m (C)з дом = 26 кг х кг 86 кг
m (CO2) = 86 кг C + O2 = CO2
![]() 12 кг 44 кг
12 кг 44 кг
ω (дом) - ? 12∙86
![]() m (C) = = 23,5к г
m (C) = = 23,5к г
44
m (C)
![]() ω (C) =
ω (C) =
m (C)з дом
23,5
![]() ω (CaCO3) = = 0,9020 або 90,2%
ω (CaCO3) = = 0,9020 або 90,2%
26
ω (дом) = 100% - 90,2 = 9,8%
Відповідь: ω (дом) = 9,8%
- При згоранні технічної сірки масою 10 г виділився газ, який пропустили крізь розчин гідроксиду натрію, в якому маса NaOH 24 г. Визначити масову частку сірки в технічному препараті.
![]() m (S)з дом = 10 кг
m (S)з дом = 10 кг
m(NaOH) = 24 г y г 0,3 моль
![]() S + O2 = SO2
S + O2 = SO2
ω (S) - ? 32 г 1 моль
х моль 24 г
SO2 + 2NaOH = Na2SO3 + H2O
1 моль 40∙2 г
υ (SO2) = 24/80 = 0,3 моль
m (S) = 32 ∙ 0,3 = 9,6 г
m (S) = ω(S) ∙ m (Sз дом.)
m (S)
![]() ω(S) =
ω(S) =
m (S)з дом
9,6
![]() ω(S) = = 0,96 або 96%
ω(S) = = 0,96 або 96%
10
Відповідь: ω (S) = 96%
VІ. Домашнє завдання.
Виконати завдання подані на дидактичних картках в робочих зошитах
VІІ. Підведення підсумків уроку (фронтальна бесіда).
- Що нового ви дізналися на уроці?
- Чи досягли поставленої мети?
- Задачу якого рівня складності ви обрали для розв’язування вдома?
Тема: Застосування неметалів та їхніх сполук. Поняття про адсорбцію. Принцип дії вогнегасників. Кругообіг неметалічних елементів у природі. Парниковий ефект
Цілі уроку: узагальнити й систематизувати знання учнів про неметалічні елементи та їхні сполуки; розширити знання учнів про неметали; ознайомити учнів з поняттям «адсорбція» на прикладі активованого вугілля, показати його застосування; розвивати екологічну грамотність учнів на прикладі явища парникового ефекту; підготувати учнів до контрольної роботи з теми «Неметалічні елементи та їхні сполуки».
Тип уроку: узагальнення й систематизації знань, умінь і навичок.
Форми роботи: семінар, робота в групах, самостійна робота.
Обладнання: періодична система хімічних елементів, таблиця розчинності; картки-завдання, матеріали для підготовки відповідей.
ХІД УРОКУ
- Організація класу
- Перевірка домашнього завдання, мотивація навчальної діяльності
Кругообіг неметалічних елементів у природі Вступне слово вчителя
III. Використання знань, умінь і навичок для виконання тренувальних вправ
Учні об’єднуються в п’ять-десять груп, кожна з яких отримує картку-завдання із запитаннями для підготовки відповідей під керівництвом учителя безпосередньо на уроці. (Доцільно організувати цю роботу попередньо як домашнє завдання до уроку.)
Під час роботи вчитель проводить консультації й допомагає підготувати правильну відповідь.
Групові завдання
- Дайте характеристику хімічного елемента.
- Охарактеризуйте фізичні й хімічні властивості простої речовини, утвореної елементом.
- Наведіть приклади використання простої речовини й найбільш використовуваних сполук хімічного елемента.
- Опишіть кругообіг неметалу в природі.
- Складіть схему перетворень за участі сполук хімічного елемента та складіть рівняння хімічних реакцій.
*6. Розв’яжіть задачі.
Задачі для груп
Група 1. Нітроген
Обчисліть масову частку виходу амоніаку відносно теоретичного, якщо відомо, що в результаті проходження через колону синтезу азоту масою 2,32•103 кг одержали амоніак масою 2,58•103 кг.
Група 2. Сульфур
Апаратник печі випалу за добу подав у піч колчедан, що містить ферум дисульфід Гей2 масою 2,4•105 м3. Який об’єм сульфур (ІУ) оксиду при цьому утвориться (н. у.)?
Група 3. Фосфор
За зміну оператор установки виробництва подвійного суперфосфату подав у реактор 6,287•104 кг кальцій фосфату, а також водний розчин ортофосфатної кислоти масою 1,235•105 кг із масовою часткою кислоти 70 %. Обчисліть масу кальцій дигідрогенфосфату, що утворився.
Група 4. Карбон
Обчисліть об’єм карбон(ІІ) оксиду за н. у., що утвориться в газогенераторі з вугілля масою 1 т, якщо масова частка Карбону у вугіллі становить 92 %, а виробничі втрати продукту реакції дорівнюють 10 % .
Група 5. Силіцій
Обчисліть масу кварцового піску, кальцинованої соди й вапняку, необхідних для одержання скла для шибок масою 2,4•104 кг, якщо вихід продукту реакції становить 90 % від теоретично можливого.
Групи виконують завдання й після завершення роботи доповідають про результати.
- Підбиття підсумків уроку
- Підбиття вчителем підсумків уроку, зупинка на питаннях екології
- Адсорбція
Адсорбція — це поглинання газів або розчинених речовин з розчину поверхнею твердого тіла або рідини. Адсорбція є одним із видів сорбції. Адсорбція відбувається під впливом молекулярних сил поверхневого шару адсорбенту. У деяких випадках молекули адсорбату (речовини, яка поглинається) взаємодіють з молекулами адсорбенту й утворюють з ними поверхневі хімічні сполуки (хемосорбція). За постійної температури фізична адсорбція посилюється внаслідок підвищення тиску або концентрації розчину. Процес, зворотний адсорбції, називається десорбцією.
Адсорбенти — високодисперсні природні або штучні матеріали з великою площею поверхні, на якій відбувається адсорбція речовин з газів або рідин, що стикаються з нею. Для очищення повітря й води від шкідливих речовин на очисних спорудженнях широко використовується метод адсорбції. Найбільш широко використовувані адсорбенти: активоване вугілля, силікагелі, алюмосилікагелі, оксиди й гідроксиди деяких металів, губчасті метали, природні мінерали.
Учитель підбиває остаточні підсумки уроку, оцінює роботу груп.
- Домашнє завдання
Повторити властивості неметалічних елементів та їхніх сполук, підготуватися до самостійної роботи з теми «Неметали та їхні сполуки».
«Погоджено» «Затверджено»
Заступник директора Директор школи
з навчальної роботи Мікульський М.Ф.
Якубовська Н.О.
Календарне планування
з біології для 11 класу
Клубівської ЗОШ І – ІІІ ст
на 2015-2016 н.р.
ІІ семестр
Вчитель: Корчик Т.В.
«Погоджено» «Затверджено»
Заступник директора Директор школи
з навчальної роботи Лисюк М.А.
Вербицька Н.О.
Календарне планування
з хімії для 7-11 класу
Михлянської ЗОШ І – ІІІ ст
на 2015-2016 н.р.
ІІ семестр
Вчитель: Корчик Т.В.
«Погоджено» «Затверджено»
Заступник директора Директор школи
з навчальної роботи Мікульський М.Ф.
Якубовська Н.О.
Календарне планування
з природознавства для 4 класу
Клубівської ЗОШ І – ІІІ ст
на 2015-2016 н.р.
ІІ семестр
Вчитель: Корчик Т.В.
«Погоджено» «Затверджено»
Заступник директора Директор школи
з навчальної роботи Колоднюк Б. В.
Москалюк C.Л.
Календарне планування
з хімії для 7-11 класу
Ліщанської ЗОШ І – ІІІ ст.
на 2015-2016 н.р.
ІІ семестр
Вчитель: Корчик Т.В.


про публікацію авторської розробки
Додати розробку
