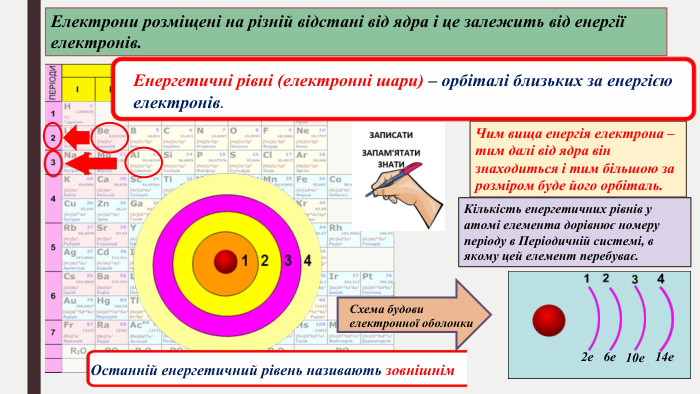
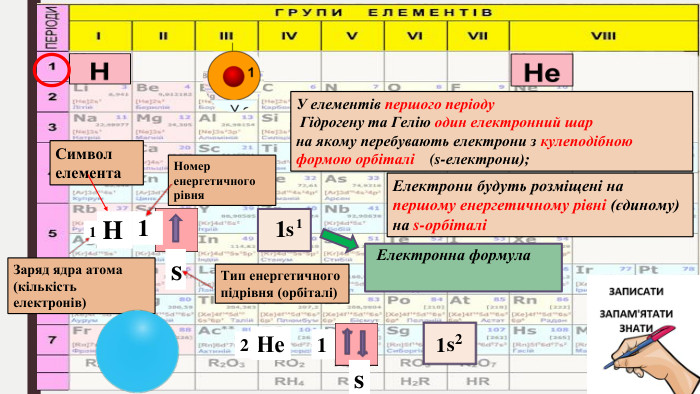
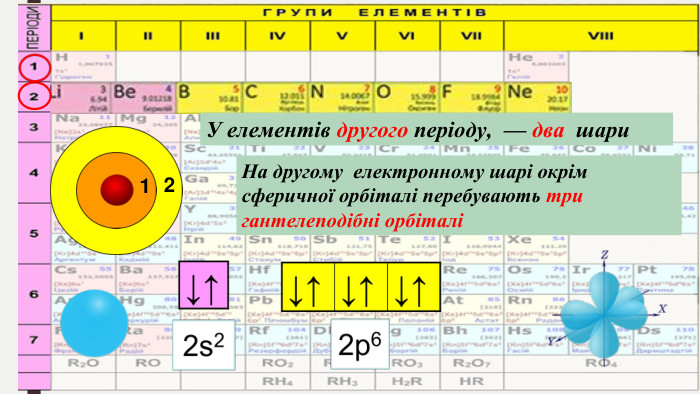
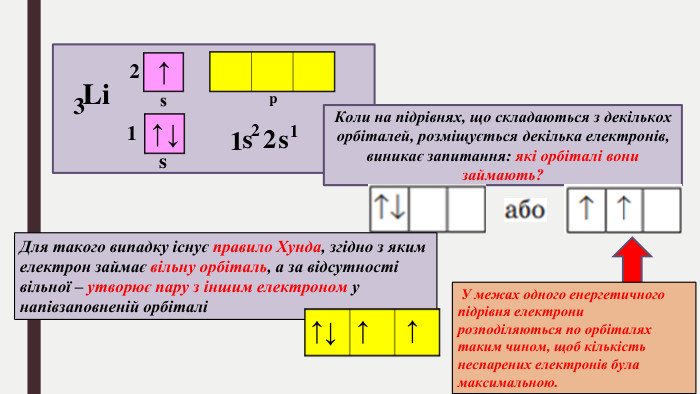
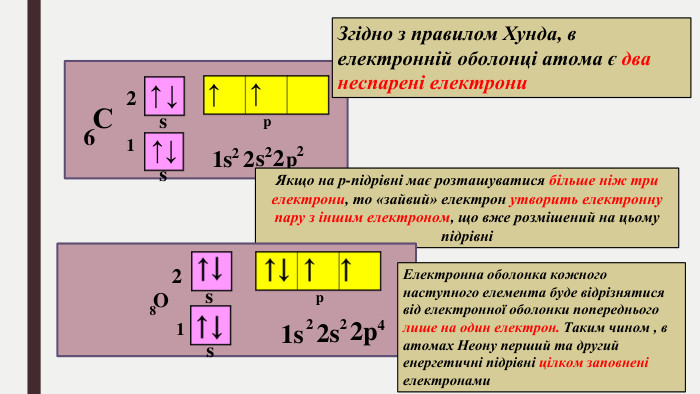
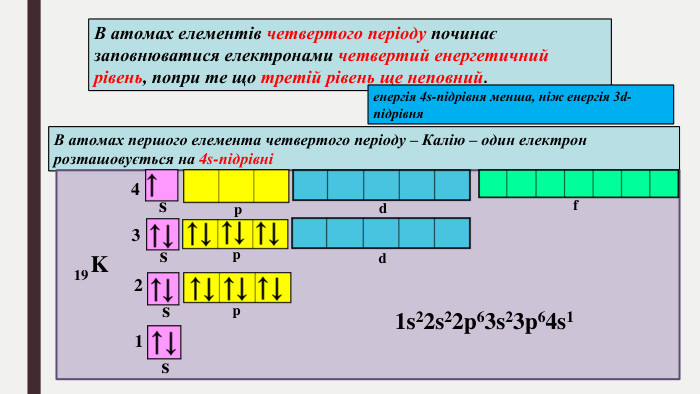
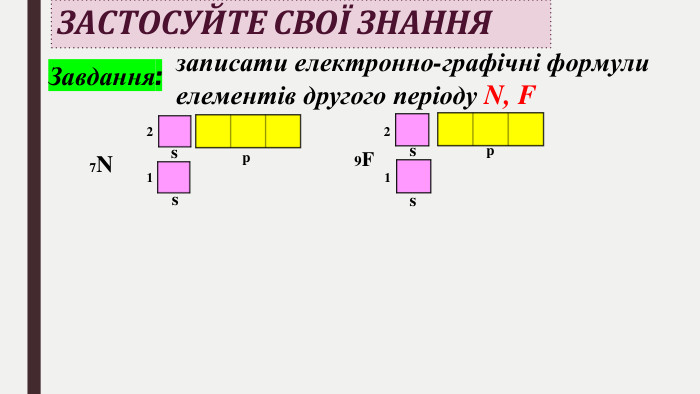
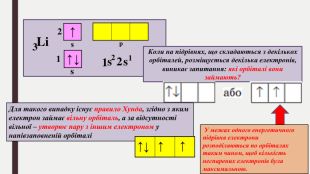
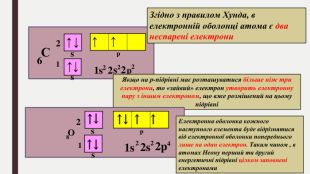
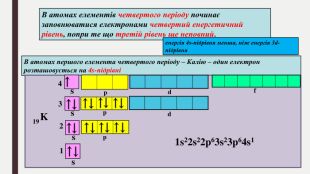
БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ № 1-20
Про матеріал
Презентація до уроку: "БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ № 1-20" Містить вправи, завдання для закріплення знань.
Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку