Будова матома як хімічного обєкта, (Протони, Нейтрони, Електронні брбіталі)
Тема уроку: Будова атома.
Мета уроку через:
-навчальний зміст:
oрозглянути питання про будову атомів хімічних елементів;
oвивчити склад атомного ядра.
-діяльність учителя:
oознайомити учнів з будовою атомів хімічних елементів
oдати знанння про склад атому: ядро, електрони; склад ядра – протони, нейтрони.
oрозкрити зміст порядкового номера хімічного елемента у Періодичній системі.
oпідвести учнів до сучасного формулювання Періодичного закону.
-процеси особистісного розвитку:
oсформувати вміння характеризувати хімічні елементи за положенням у періодичній системі хімічних елекментів.
oформувати уявлення про матеріальну єдність світу й можливість його пізнання.
-навчальну діяльність учня:
oпояснювати закономірність розміщення атомів хімічних елементів у Періодичні системі хімічних елементів
oобчислювати кількість протонів, електронів та нейтронів у складі атому хімічного елемента.
Тема уроку: Будова атома.
Мета уроку через:
-
навчальний зміст:
- розглянути питання про будову атомів хімічних елементів;
- вивчити склад атомного ядра.
-
діяльність учителя:
- ознайомити учнів з будовою атомів хімічних елементів
- дати знанння про склад атому: ядро, електрони; склад ядра – протони, нейтрони.
- розкрити зміст порядкового номера хімічного елемента у Періодичній системі.
- підвести учнів до сучасного формулювання Періодичного закону.
-
процеси особистісного розвитку:
- сформувати вміння характеризувати хімічні елементи за положенням у періодичній системі хімічних елекментів.
- формувати уявлення про матеріальну єдність світу й можливість його пізнання.
-
навчальну діяльність учня:
- пояснювати закономірність розміщення атомів хімічних елементів у Періодичні системі хімічних елементів
- обчислювати кількість протонів, електронів та нейтронів у складі атому хімічного елемента.
Обладнання:
підручник, таблиця «Періодична система елементів Д.І.Менделєєва», сигнальні картки (зеленого і червоного кольорів), опорна схема «Будова атома», комп’ютер, проектор, мультимедійна дошка.
Базові поняття та терміни:
атом, ядро, електрон, протон, нейтрон, нуклон, модель атома, порядковий номер.
Тип уроку: урок засвоєння нових знань.
Методи навчання: пояснювально-ілюстративний, проблемного викладу, метод «світлофору», «знайди помилку».
Структура уроку.
- Організаційний момент.
- Підготовка до сприйняття матеріалу (актуалізація опорних знань, уявлень та чуттєвого досвіду).
- Мотивація навчальної діяльності.
- Оголошення теми, мети та завдань уроку.
- Вивчення нового матеріалу.
- Осмислення нових знань і умінь.
- Закріплення, систематизація та узагальнення.
- Контрольно-коригувальний етап.
- Підбиття підсумків уроку.
- Інструктаж щодо виконання домашнього завдання.
ХІД УРОКУ.
- Організаційний момент.
Привітання, перевірка готовності учнів до уроку, налаштування на робочий настрій.
- Вивчення нового матеріалу.
І. ІСТОРІЯ ВІДКРИТТЯ.
Довгі роки хіміки звикали до того, що складні речовини складалися з елементів, а елементи – з атомів. Пізніше з’ясувалося що і прості речовини складаютья з атомів.
Демонстрація слайдів
Періодичний закон і періодична система хімічних елементів вплинули на розвиток науки і техніки: вони послужили теоретичним фундаментом і спрямованого пошуку й відкриття 46 елементів зі 111 відомих на сьогодні, крім того поштовхом до дослідження будови атома. Атом вважався елементарною (неподільною) частинкою.
Демонстрація слайдів
У 1896 році французький фізик А.Беккерель виявив, що матеріали, які містять уран засвічують у темряві фотопластинку. У 1903 році П’єр і Марія Склодовська-Кюрі одержали Нобелівську премію за відкриття радіоактивності. У 1911 році М.Склодовська-Кюрі була удостоєна Нобелівської премії за відкриття чистого радію.
Демонстрація слайдів
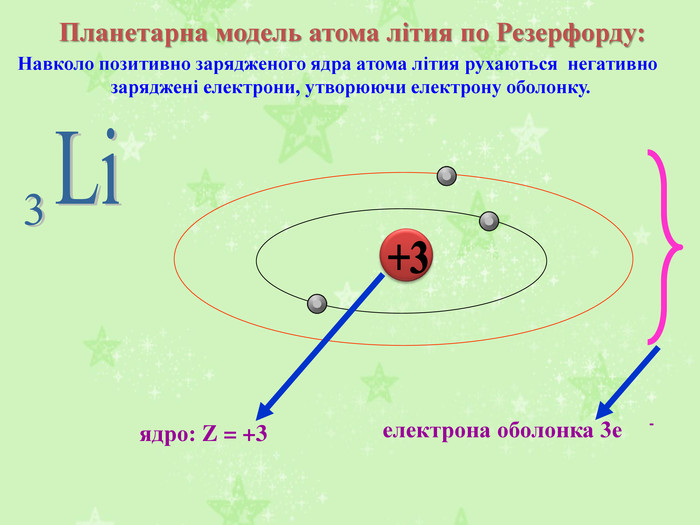
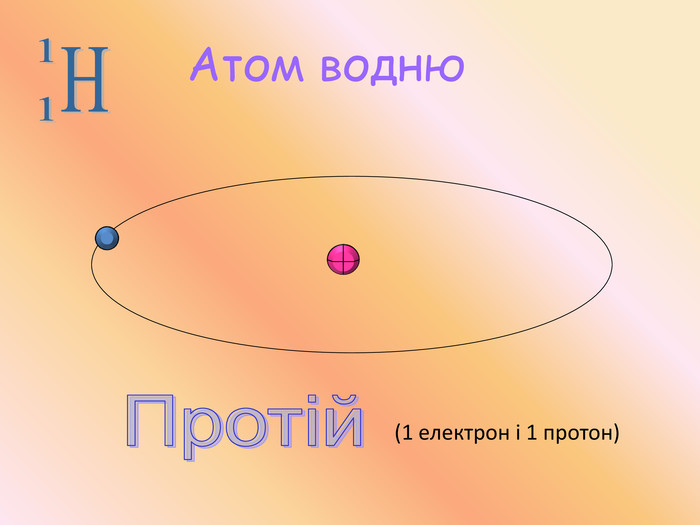
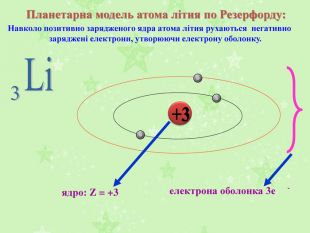
Найбільших успіхів у вивченні атома досяг англійський учений Ернест Резерфорд. У 1909 році він провів свій знаменитий експеримент. Він дійшов висновку, що в центрі атома існує маленьке ядро, яке заряджене позитивно та містить усі протони та нейтрони і в ньому зосереджена практично вся маса атома. У той же час у зовнішніх шарах атома містяться негативно заряджені електрони, маса яких занадто мала.
Аналізуючи результати свого експерименту, Резерфорд запропонував «планетарну» модель будови атома, якою з невеликими змінами ми користуємося і досі.
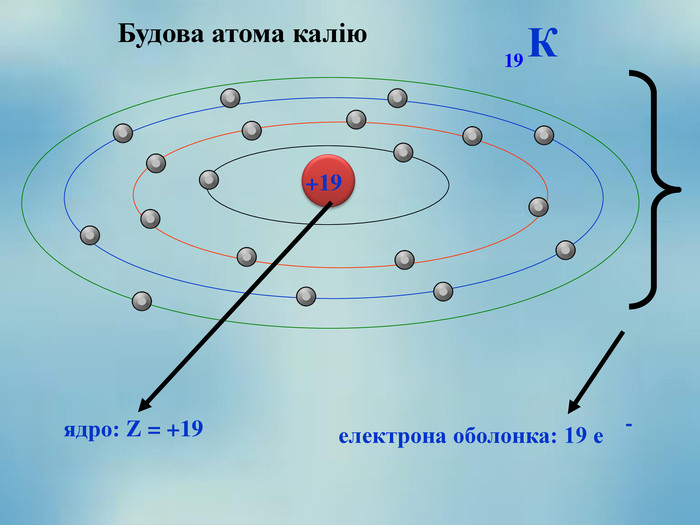
Відповідно до цієї моделі в центрі ядра зосереджений весь позитивний заряд атома, яке оточене негативно зарядженими електронами. Електрони рухаютья навколо ядра як планети навколо Сонця по певних орбітах. Це довели група вчених з Харківського фізико-технічного інституту та зробила перші в історії науки знімки атома.
Демонстрація слайдів
Отже:
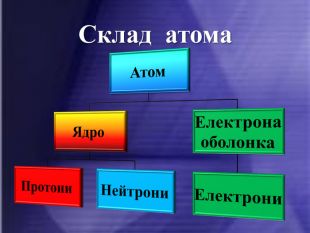
Атом – електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів.
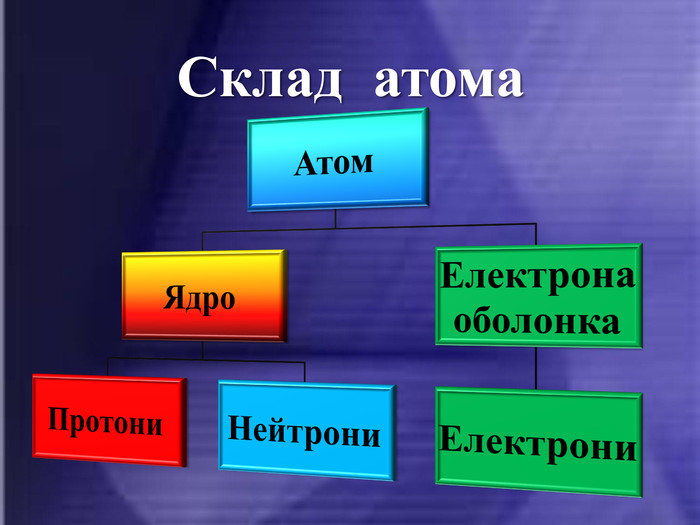
ІІ. СКЛАД АТОМІВ.
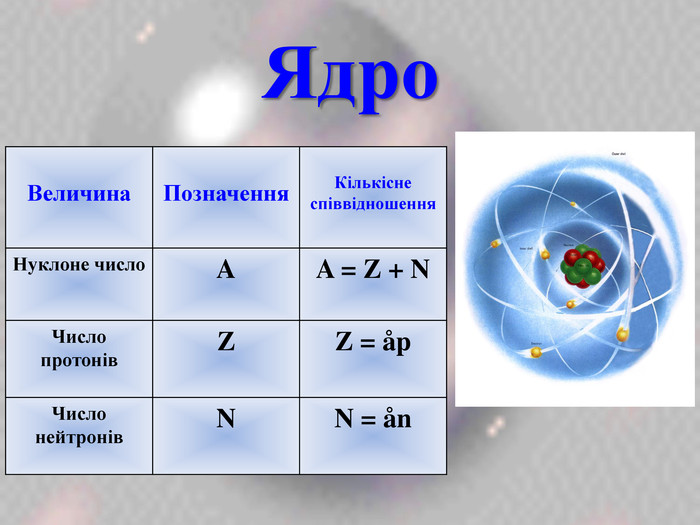
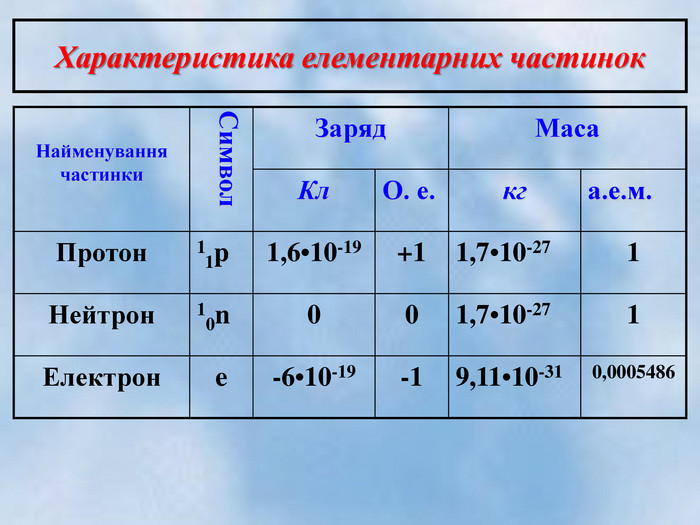
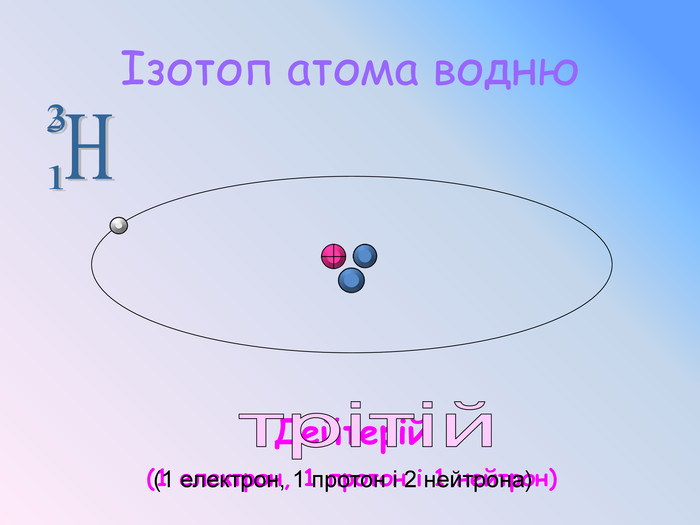
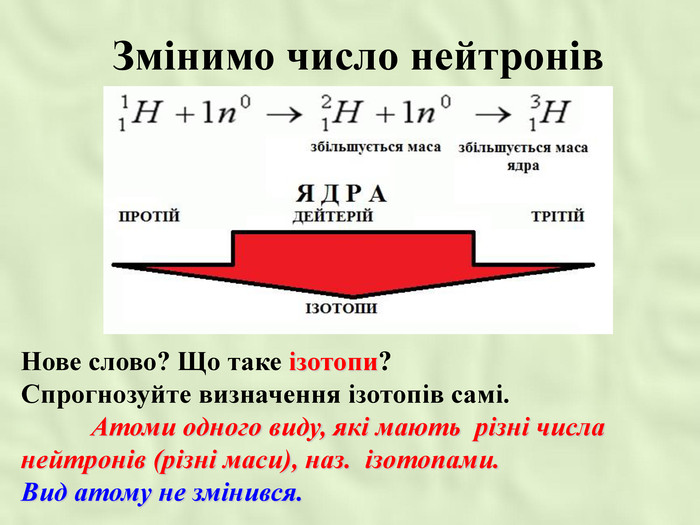
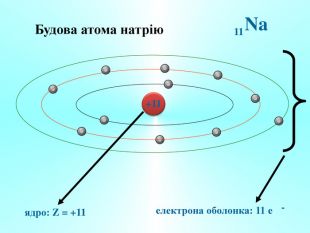
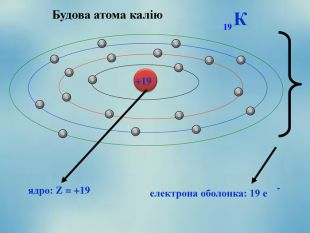
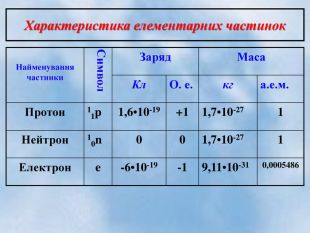
Після встановлення складної будови атомів з’ясувалося, що і ядра атомів мають складну будову. Ядро атома складається із двох частинок – протонів і нейтронів. Протони мають позитивний заряд, а нейтрони заряду не мають. Тобто весь позитивний заряд зосереджений у ядрі атома і їх загальне число дорівнює заряду ядра. Маси протона і нейтрона приблизно дорівнюють 1 а.о.м.
Демонстрація слайдів
Уявіть собі, що діаметр ядра в 100 000 разів менше діаметра атома.
Узагальнюючи:
Демонстрація слайдів
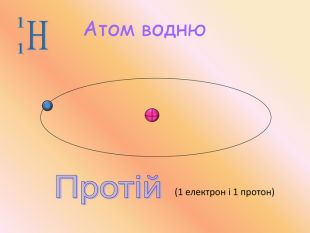
Якщо до ядра атома входить 8 протонів, то заряд ядра його атома дорівнює +8. Атом – електронейтральна частинка, тому навколо цього атома має обертатися 8 негативно заряджених електронів.
Яка ж маса даного атома?
Маса кожного протона та нейтрона приблизно дорівнює 1а.о.м., а маса всіх електронів дорівнює 0. Отже маса атома дорівнюватиме 10 а.о.м.
Або в спрощеному вигляді це можна позначити наступним чином:


![]()
![]() 8 16О
8 16О
Узагальнюючи:
Демонстрація слайдів
![]()
![]() АТОМ
АТОМ
ядро електорони
![]()
 -1е
-1е
заряд - -1
протони нейтрони
+1 1р 0 1n
заряд - +1 заряд – 0
маса – 1 маса – 1
nu = Ar
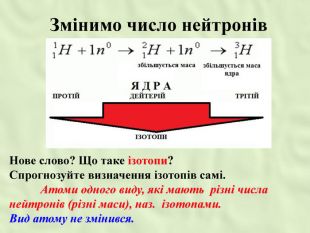
(n = nu – p)
Тобто, найважливіша характеристика хімічного елемента – це заряд його ядра.
У зв’язку з відкриттям будови атома було змінено і формулювання Періодичного закону:
«Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їх атомних ядер.»
- Осмислення нових знань і умінь.
Демонстрація слайдів
- Планетарну модель будови атома запропонував … (англійський вчений Ернест Резерфорд)
- Атом це …(електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів)
- Частинки з яких складається ядро атома називаються… (протонами та нейтронами. Загальна назва – нуклони.)
- Маси протна і нейтрона приблизно дорівнюють (в а.о.м.) … (1 а.о.м.)
- Загальне число протонів в ядрі атома елемента дорівнює його … (заряду або порядковому номеру)
- Розрахувати кількість нейтронів можна за формулою… (n = nu – p)
- Закріплення, систематизація та узагальнення.
- Добери пару (асоціація):
Демонстрація слайдів
- Протон - Масове число
- Нейтрон - Позитивний заряд
- Нуклон - Має негативний заряд
- Електрон - Ядро і електрони
- Порядковий
номер - Заряд ядра атома
- Атом - Не має заряду
- Контрольно-коригувальний етап.
Демонстрація слайдів
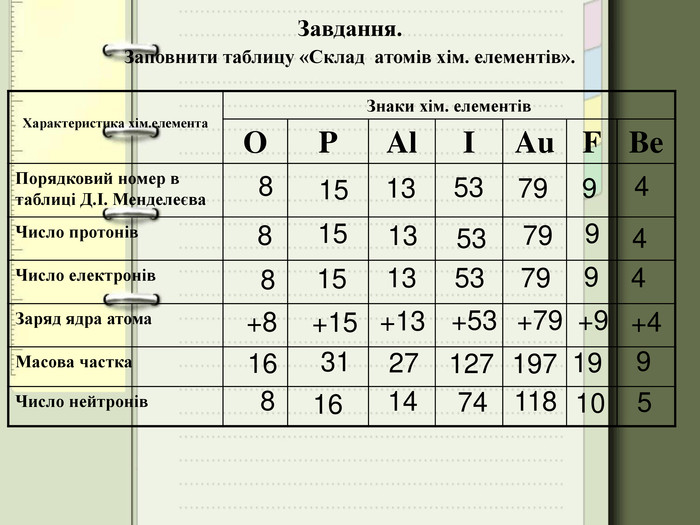
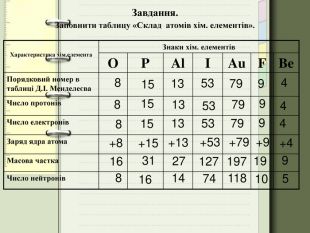
Заповніть вільні клітинки у таблиці:
|
ЕЛЕМЕНТ |
ЧИСЛО |
НУКЛОННЕ ЧИСЛО |
||||
|
Назва |
символ |
Порядковий номер |
Протонів |
електронів |
Нейтронів |
Атомна маса |
|
Флуор |
|
|
|
|
10 |
|
|
|
S |
|
|
|
|
32 |
|
|
|
15 |
|
|
16 |
|
- Підбиття підсумків уроку.
Виставлення оцінок, оголошення результатів уроку.
- Інструктаж щодо виконання домашнього завдання.
Диференціація завдання:
Опрацювати §23,
№ 200-202 усно,
№ 203 за варіантами (перший рядок – перший ряд учнів, другий – другий і т.д.)
№210 (за вибором учнів.)


про публікацію авторської розробки
Додати розробку