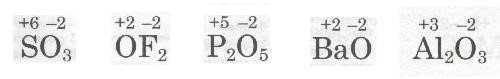Хімія. Календарно-тематичне та поурочне планування. 8 клас.
Наведені матеріали за змістом і структурою повністю відповідають програмі для загальноосвітніх навчальних закладів Хімія 7-9 класи, затвердженої Міністерством освіти і науки, молоді та спорту України, наказ Міністерства освіти і науки, молоді та спорту України від 06.06 2012 р. № 664 «Про затвердження навчальних програм для загальноосвітніх навчальних закладів ІІ ступеня»
Посібник містить орієнтовне календарно-тематичне і поурочне планування, критерії оцінювання навчальних досягнень.
Наведено зразки самостійних та контрольних робіт.
Посібник призначений для вчителів хімії.
Новосельська Наталія Віталіївна
Мельник Тетяна Юріївна
Орієнтовне календарне і поурочне планування Хімія 8 клас
Зміст
1. Анотація 3
2. Вступ 4
3. Орієнтовне календарне планування Хімія 8 клас 8
4. Орієнтовне поурочне планування Хімія 8 клас 35
5. Бібліографія 231
Анотація
Наведені матеріали за змістом і структурою повністю відповідають програмі для загальноосвітніх навчальних закладів Хімія 7-9 класи, затвердженої Міністерством освіти і науки, молоді та спорту України, наказ Міністерства освіти і науки, молоді та спорту України від 06.06 2012 р. № 664 «Про затвердження навчальних програм для загальноосвітніх навчальних закладів ІІ ступеня»
Посібник містить орієнтовне календарно-тематичне і поурочне планування, критерії оцінювання навчальних досягнень.
Наведено зразки самостійних та контрольних робіт. Посібник призначений для вчителів хімії.
Вступ
За новим державним стандартом метанавчання хімії полягає у формуванні засобами навчального предмета ключових компетентностей учнів, необхідних для соціалізації, творчої самореалізації особистості, розуміння природничо-наукової картини світу, вироблення екологічного стилю мислення і поведінки та виховання громадянина демократичного суспільства.
Вивчення хімії спрямоване на виконання таких освітніх, розвивальних і виховних завдань:
1. розвиток особистості учня, його природних задатків, інтелекту, пам'яті, здатності до самоосвіти;
2. формування наукового світогляду учня на основі засвоєння системи знань про речовини та їхні перетворення, основні хімічні закони й теорії, методи наукового пізнання в хімії;
3. формування життєвої і соціальної компетентностей учня, його екологічної культури, навичок безпечного поводження з речовинами у побуті та на виробництві;
4. розкриття ролі хімії у розвитку суспільного господарства та забезпеченні добробуту людини.
У 8 класі змінено логіку викладення навчального матеріалу порівняно з попередньою програмою. На початок винесено теоретичний матеріал про періодичний закон, будову атома, хімічний зв’язок і будову речовин. Вивчення будови атома дає змогу пояснити причину явища періодичності зміни властивостей хімічних елементів і їхніх сполук, розкрити на вищому теоретичному рівні поняття валентності елементів у хімічних сполуках, з’ясувати електронну природу ковалентного та йонного хімічного зв’язків, розглянути поняття про ступінь окиснення та ознайомити з правилами його визначення у сполуках. Така послідовність має сприяти більш усвідомленому складанню учнями хімічних формул сполук, прогнозуванню їхніх властивостей.
У наступній темі «Кількість речовини. Розрахунки за хімічними формулами» формується поняття про кількість речовини та одиницю її вимірювання – моль. Учні вчаться обчислювати молярну масу, молярний об’єм газів, відносну густину газів. Абстрактні поняття про атоми і молекули набувають реальних кількісних характеристик. Засвоєння знань з теми допоможе учням зрозуміти кількісні відношення між речовинами у хімічних реакціях (добирання коефіцієнтів) і полегшити кількісні розрахунки за хімічними рівняннями.
Далі вивчається тема «Основні класи неорганічних сполук», яка має переважно фактологічний характер.
За такої послідовності тем вивчення неорганічних речовин нині набуває теоретичного підґрунтя, яке становлять періодичний закон, будова речовин, кількісні відношення в хімії. Хімічний склад і властивості речовин логічно пов’язуються з розміщенням хімічних елементів у періодичній системі, а в практичній частині програми є змога поступово перейти від простих до складніших хімічних реакцій і розрахункових задач.
Перелік вимог зорієнтує вчителя на досягнення мети навчання з кожної теми програми, полегшить планування цілей і завдань уроків, дасть змогу виробити адекватні методичні підходи до проведення навчальних занять, поточного й тематичного оцінювання.
Критерії оцінювання навчальних досягнень учнів із хімії
При оцінюванні рівня навчальних досягнень з хімії враховується:
• рівень засвоєння теоретичних знань;
• оволодіння хімічною мовою як засобом відображення знань про речовини і хімічні явища;
• сформованість експериментальних умінь, необхідних для виконання хімічних дослідів, передбачених навчальною програмою; здатність учнів застосовувати набуті знання на практиці; уміння розв'язувати розрахункові задачі.
За відмінностями між обсягом і глибиною досягнутих результатів, ступенем самостійності у виконанні завдань, здатністю використовувати знання у нових ситуаціях виокремлено рівні навчальних досягнень учнів, що оцінюються за 12-бальною шкалою.
Кожний наступний рівень вбирає в себе вимоги до попереднього, а також додає нові характеристики.
Визначальними в оцінюванні рівня навчальних досягнень учнів є особистісні результати пізнавальної діяльності, у яких відображаються загальнопредметні компетентності, набуті учнями в процесі навчання хімії.
Критерії оцінювання навчальних досягнень учнів
|
Рівні навчальних досягнень учнів |
Бали |
Критерії оцінювання навчальних досягнень учнів |
|
Початковий І |
1 |
Учень (учениця) розпізнає деякі хімічні об’єкти (хімічні символи, формули, явища, посуд тощо) і називає їх (на побутовому рівні); знає правила безпеки під час проведення практичних робіт.
|
|
2 |
Учень (учениця) описує деякі хімічні об'єкти за певними ознаками; знає призначення лабораторного обладнання. |
|
|
3 |
Учень (учениця) має фрагментарні уявлення з предмета вивчення і може відтворити окремі його частини; під керівництвом учителя виконує найпростіші хімічні досліди. |
|
|
Середній ІІ
|
4 |
Учень (учениця) знає окремі факти, що стосуються хімічних сполук і явищ; складає прості прилади для проведення дослідів і виконує їх під керівництвом учителя; складає з допомогою вчителя скорочену умову задачі. |
|
5 |
Учень (учениця) з допомогою вчителя відтворює окремі частини навчального матеріалу, дає визначення основних понять; самостійно виконує деякі хімічні досліди, описує хід їх виконання, дотримується порядку на робочому місці; самостійно складає і записує скорочену умову задачі. |
|
|
6 |
Учень (учениця) відтворює навчальний матеріал з допомогою вчителя; описує окремі спостереження за перебігом хімічних дослідів; робить обчислення за готовою формулою. |
|
|
Достатній ІІІ
|
7 |
Учень (учениця) самостійно відтворює значну частину навчального матеріалу; з допомогою вчителя порівнює хімічні об'єкти, описує спостереження за перебігом хімічних дослідів; наводить рівняння реакцій за умовою задачі. |
|
8 |
Учень (учениця) самостійно відтворює фактичний і теоретичний навчальний матеріал, порівнює і класифікує хімічні об'єкти; самостійно виконує всі хімічні досліди згідно з інструкцією; робить обчислення за рівнянням реакції. |
|
|
9 |
Учень (учениця) виявляє розуміння основоположних |
|
|
|
|
хімічних теорій і фактів, наводить приклади на підтвердження цього; робить окремі висновки з хімічних дослідів; з допомогою вчителя розв'язує задачі. |
|
Високий ІV |
10 |
Учень (учениця) володіє навчальним матеріалом ізастосовує знання у стандартних ситуаціях, уміє аналізувати, узагальнювати й систематизувати надану інформацію, робити висновки; робить висновки з практичної роботи; самостійно наводить і використовує необхідні формули для розв'язування задач. |
|
|
11 |
Учень (учениця) володіє засвоєними знаннями і використовує їх у нестандартних ситуаціях, установлює зв'язки між явищами: самостійно знаходить і використовує інформацію згідно з поставленим завданням; виконує хімічний експеримент, раціонально використовуючи обладнання і реактиви; самостійно розв'язує задачі, формулює відповіді. |
|
|
12 |
Учень (учениця) має системні знання з предмета, аргументовано використовує їх, у тому числі у проблемних ситуаціях; аналізує додаткову інформацію; самостійно оцінює явища, пов'язані з речовинами та їх перетвореннями; робить обгрунтовані висновки з хімічного експерименту; розв'язує експериментальні задачі за власним планом; самостійно аналізує та розв'язує задачі раціональним способом. |
Орієнтовне тематичне планування
Хімія 8 клас
(Усього 70 годин, 2 год на тиждень, із них 10 год — резервних)
Програма для загальноосвітніх навчальних закладів
Хімія7-9 класи
Затверджено Міністерством освіти і науки, молоді та спорту України наказ Міністерства освіти і науки, молоді та спорту України
від 06.06 2012 р. № 664
«Про затвердження навчальних програм для загальноосвітніх навчальних закладів ІІ ступеня»
|
Номер уроку |
Дата |
Тема уроку |
Дидактична мета уроку |
Демонстрації та лабораторні досліди |
|
|
Повторення найважливіших питань курсу хімії 7 класу (2 год)
|
|||
|
1 |
|
Основні поняття хімії. |
Повторити хімічні поняття, розглянуті під час вивчення хімії в7 класі: «речовина», «атом», «молекула», «йон», «хімічний елемент», «відносна атомна й молекулярна маси», «прості та складні речовини», «хімічна формула», «фізичні й хімічні явища», «хімічні рівняння». Повторити вивчені відомості про прості речовини на прикладі кисню. Удосконалювати навички складання хімічних формул і рівнянь.Згадати розчин і його |
|
|
|
|
|
компоненти: розчинник, розчинена речовина, кількісний склад розчину.
|
|
|
2 |
|
Діагностична контрольна робота.
|
Оцінити рівні навчальних досягнень учнів, їх розвитку та вихованості; сформованості універсальних та інтегрованих прийомів навчальної діяльності; оволодіння спеціальними знаннями, уміннями та навичками; самостійність і творчу активність учнів;інформацію про типове та індивідуальне в навчальній підготовленості кожного учня окремо та учнів класу в цілому. |
|
|
Тема 1. Періодичний закон і періодична система хімічних елементів. Будова атома (15 год) |
||||
|
3 |
|
Короткі історичні відомості про спроби класифікації хімічних елементів. Поняття про лужні, інертні елементи, галогени.
|
Повторити та систематизувати знання учнів про хімічний елеметнти; пояснити причину необхідності класифікації хімічних елементів; дати поняття про природні групи хімічних елементів; розповісти про властивості хімічних елементів, які складають групу лужних металів і |
Демонстрації:
Взаємодія лужних металів з водою |
|
|
|
|
групу галогенів; повторити вже відомі учням властивості простих речовин (металів і неметалів), підвести до розуміння подібності властивостей деяких елементів. |
|
|
4 |
|
Періодичний закон. Періодична система – графічне відображення періодичного закону |
Повторити і систематизувати знання учнів про природні групи хімічних елементів; дати формулювання періодичного закону; ознайомити із структурою періодичної системи; дати поняття про те, що періодичний закон є класичним прикладом наукового підходу до пізнання навколишнього світу. |
Демонстрації: Періодична система хімічних елементів Д. І. Менделєєва (довга і коротка форми).
|
|
5 |
|
Поняття про періоди і групи
|
Повторити і систематизувати знання учнів про періодичність зміни властивостей хімічних елементів; дати понятитя про структуру переідичної системи, періоди і групи; виявити зв’язок між положенням елемета у періодичній системі та його властивостями; обговорити з учнями відкриття періодичного закону, підвести до глибшого осмислення явища періодичності; дати поняття про структиурні одиниці періодичної системи. |
Демонстрації: Періодична система хімічних елементів Д. І. Менделєєва (довга і коротка форми).
|
|
6 |
|
Будова атома. Склад атомних |
Продовжити знайомство з періодичною системою |
Демонстрації: Моделі атомів. |
|
|
|
ядер (протони і нейтрони). Протонне число. Нуклонне число. |
хімічних елементів Д. І. Менделєєва. На основі знань про будову атома розкрити фізичний зміст порядкового номера елемента. Розширити знання учнів про радіоактивність і будову атома, підвести учнів до сучасного формулювання періодичного закону. Формувати вміння характеризувати хімічні елементи за положенням у періодичній системі хімічних елементів, розраховувати кількість протонів, нейтронів і електронів у атомі. Сформувати уявлення про матеріальну єдність світу й можливості його пізнання. |
Форми електронних орбіталей. |
|
7 |
|
Нуклід. Ізотопи. Сучасне формулювання періодичного закону.
|
Розширити знання про періодичний закон і періодичну систему хімічних елементів Д. І. Менделєєва. Сформувати поняття про ізотопи (стабільні й нестабільні). Дати сучасне формулювання періодичного закону. Дати уточнене визначення поняття «хімічний елемент» виходячи зі знань періодичного закону — фундаментального закону природи. |
|
|
8 |
|
Семінарське заняття з теми: Періодичний закон і |
Систематизувати отримані знання з теми «Періодичний закон і періодична система |
|
|
|
|
періодична система елементів Д.І.Менделєєва |
елементів Д.І.Менделєєва»; підвищити рівень засвоєння матеріалу учнями.
|
|
|
9 |
|
Стан електронів у атомі. Електронні орбіталі. Енергетичні рівні та підрівні. |
Розглянути хвильовий характер руху електрона;ввести поняття «орбіталь», енергетичний рівень» і «енергетичний підрівень»; показати учням двоїсту природу електрона, утворення орбіталей під час руху електронів навколо ядра. |
Демонстрації: Моделі атомів. Форми електронних орбіталей. |
|
10 |
|
Будова електронних оболонок атомів хімічних елементів 1-3 періодів. |
Розвивати навички складання електронних формул, схем розподілу електронів по квантових комірках для елементів І—IIIперіодів. Продовжити формування вмінь і навичок учнів визначати електронну будову атома за його положенням у періодичній системі та положення хімічних елементів у періодичній системі за електронними формулами атома. Формувати уявлення учнів про завершений і незавершений енергетичний рівень, заповнену, вільну квантову комірку. |
|
|
11 |
|
Залежність властивостей елементів від періодичної зміни |
Розглянути поняття «атомний радіус», «електронегативність»; устоновити залежність між цими |
Демонстрації: Періодична система хімічних елементів Д. І. Менделєєва |
|
|
|
електронних структур атомів. Поняття про радіус атома, електронегатив ність.
|
характеристиками елемента та його положенням у періодичній системі; пояснити періодичне повторення властивостей хімічних елементів. |
(довга і коротка форми).
|
|
12 |
|
Взаємозв'язок між положенням елементів у періодичній системі та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном і Оксигеном. |
Розширити знання про взаємозв'язок між положенням хімічних елементів у періодичній системі, будовою їхніх атомів та їх фізичними й хімічними властивостями. Показати залежність між положенням хімічного елемента в періодичній системі хімічних елементів і складом, будовою і властивостями простих речовин, утворених цими елементами, складом, будовою і властивостями сполук цих елементів з Гідрогеном і Оксигеном. |
|
|
13 |
|
Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома.
|
Закріпити знання учнів про будову атома. Формувати вміння й навички характеризувати елементи за положенням хімічних елементів у періодичній системі й будовою атома. |
|
|
14 |
|
Характеристика хімічних елементів малих періодів |
Закріпити вміння й навички характеризувати елементи за положенням хімічних |
|
|
|
|
за їх місцем у періодичній системі та будовою атома. |
елементів у періодичній системі й будовою атома. |
|
|
15 |
|
Значення періодичного закону. |
Розкрити роль періодичного закону як фундаментального закону природи, доказу єдності матеріального світу, показати його значення для розвитку природничих дисциплін, у тому числі хімії. Ознайомитися з життям і діяльністю російського вченого-хіміка Д. І. Менделєєва |
|
|
16 |
|
Контрольна робота з теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома»
|
Узагальнити й систематизувати знання учнів з теми «Періодичний закон і періодична система хімічних елементів Д. і. Менделєєва. Будова атома». Визначити рівень навчальних досягнень учнів з теми «Періодичний закон і періодична система хімічних елементів Д. 1. Менделєєва. Будова атома» |
|
|
17 |
|
Життя і діяльність Д.І.Менделєєва |
Ознайомитися з життям і діяльністю російського вченого-хіміка Д. І. Менделєєва |
|
|
Тема 2. Хімічний зв’язокі будова речовини (9 +2 год) |
||||
|
|
||||
|
18 |
|
Природа хімічного зв’язку. Електронегативн ість елементів. |
Ознайомити учнів із причинами виникнення хімічного зв'язку між атомами в процесі утворення простих і складних речовин, типами хімічного зв'язку. Розкрити зміст поняття «електронегативність» та його застосування для визначення типу хімічного зв'язку. Поглибити знання про періодичний закон і будову атома на прикладі утворення хімічного зв'язку між атомами різних хімічних елементів. |
|
|
19 |
|
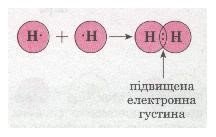
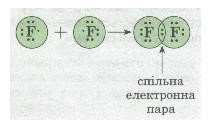
Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок. Електронні формули молекул. |
Ознайомити учнів із принципами утворення ковалентного неполярного й полярного зв'язку. Сформувати навички складання електронних формул речовин. |
|
|
20 |
|
Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний |
Закріпити знання учнів про принципи утворення ковалентного неполярного й полярного зв'язку. Продовжити формувати навички складання |
|
|
|
|
зв’язок. Електронні формули молекул. |
електронних формул речовин. Розвивати навички написання електронних формул речовин, уміння визначати вид хімічних зв'язків у молекулах за будовою атомів, що утворюють цю молекулу. |
|
|
21 |
|
Йони. Йонний зв’язок, його утворення. |
Розширити знання учнів про будову атомів металів і неметалів на прикладі утворення йонів. Ознайомити учнів з механізмом утворення йонного зв'язку. Розвивати навички складання електронних формул. |
|
|
22 |
|
Йонний зв’язок, його утворення. |
Продовжити розвивати навички складання електронних формул. |
|
|
23 |
|
Ступінь окиснення. |
Дати уявлення про ступінь окиснення, розділити поняття «валентність» і «ступінь окиснення». Сформувати навички визначення ступеня окиснення в сполуках за формулою, а також за будовою атомів, які утворюють ці сполуки. |
|
|
24 |
|
Визначення ступеня окиснення елемента за |
Розвивати навички визначення ступеня окиснення в сполуках за формулою, а також за |
|
|
|
|
хімічною формулою сполуки.
|
будовою атомів, які утворюють ці сполуки. Сформувати навички складання хімічних формул за відомими ступенями окиснення атомів. |
|
|
25 |
|
Складання формули сполуки за відомими ступенями окиснення елементів.
|
Закріпити навички складання хімічних формул за відомими ступенями окиснення атомів, визначення ступенів окиснення Розширити уявлення про хімічні реакції на прикладі хімічних реакцій зі зміною ступеня окиснення атомів. Показати єдність двох процесів — окиснення й відновлення — як властивість атомів віддавати або приєднувати електрони. |
|
|
26 |
|
Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґраток. |
Показати взаємозв'язок між будовою речовин та їх фізичними властивостями на основі знань про типи хімічних зв'язків у неорганічних речовинах. Ознайомити учнів з типами кристалічних ґраток (атомними, молекулярними, йонними, металевими). Сформувати вміння |
Лабораторні досліди: 1. Ознайомлен ня з властивостя ми речовин з різними типами кристалічни х ґраток. Демонстрації: 4. Моделі кристалічних ґраток різних |
|
|
|
|
характеризувати фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв'язку. |
типів. 5. Речовини з різними типами кристалічних ґраток. 6. Фізичні властивості речовин із різними типами кристалічних ґраток.
|
|
27 |
|
Семінарське заняття «Хімічний зв’язок і будова речовини». |
Узагальнити й систематизувати знання учнів про види хімічного зв'язку й типи кристалічних ґраток з огляду на будову атома. Продовжити формування елементів наукового світогляду учнів, багатогранності та єдності будови речовини, взаємозв'язку явищ у природі. Розвивати вміння й навички учнів застосовувати набуті знань для розв'язання задач. Підготувати учнів до тематичного оцінювання з теми «Хімічний зв'язок і будова речовини». |
|
|
28 |
|
Контрольна робота з теми «Хімічний зв’язок і |
Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на |
|
|
|
|
будова речовини». |
практиці.
|
|
|
Тема 3. Кількість речовини. Розрахунки за хімічними формулами (9 +2 год) |
||||
|
29 |
|
Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро.
|
Сформувати уявлення учнів про хімічне поняття «кількість речовини». Показати сутність фізичної величини «кількість речовини». Ознайомити з одиницею вимірювання кількості речовини. Увести поняття «моль», «стала Авогадро». |
|
|
30 |
|
Обчислення числа атомів (молекул) у певній кількості речовини. |
Формувати вміння і практичні навички хімічних обчислень з використанням понять «кількість речовини», «моль» і «стала Авогадро».
|
|
|
31 |
|
Молярна маса.
|
Увести поняття «молярна маса». Ознайомити з одиницею вимірювання молярної маси речовини. Показати фізичний зміст молярної маси речовини. Пояснити взаємозв'язок між кількістю речовини, масою і молярною масою. |
|
|
|
|
|
|
|
|
32 |
|
Обчислення за хімічними формулами молярної маси, маси й кількості речовини.
|
Поглибити уявлення учнів про молярну масу речовини. Навчити використовувати набуті знання для розрахунків за хімічними формулами молярної маси, маси й кількості речовини.
|
|
|
33 |
|
Закон Авогадро. Молярний об’єм газів.
|
Ознайомити учнів з поняттям «молярний об'єм». Розкрити особливості використання поняття «молярний об'єм» для газоподібних речовин. Навчити учнів виконувати розрахунки об'єму газу за нормальних умов.
|
|
|
34 |
|
Відносна густина газів. |
Розкрити зміст поняття «відносна густина газів». Навчити здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною. Показати практичне значення цих розрахунків. |
|
|
35 |
|
Обчислення з використанням відносної густини газів. |
Поглибити уявлення учнів про поняття «відносна густина газів». Навчити здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною. |
|
|
36 |
|
Розрахунки за хімічними формулами
|
Систематизувати знання про кількість речовини, молярну масу, молярний об'єм. Удосконалювати навички обчислень за хімічними формулами. Підготувати учнів до тематичного оцінювання з теми «Кількість речовини. Розрахунки за хімічними формулами». |
|
|
37 |
|
Розрахунки за хімічними формулами
|
Систематизувати знання про кількість речовини, молярну масу, молярний об'єм. Удосконалювати навички обчислень за хімічними формулами. |
|
|
38 |
|
Семінарське заняття«Кількіс ть речовини. Розрахунки за хімічними формулами» |
Узагальнити й систематизувати знання з теми. Підготувати учнів до тематичного оцінювання з теми «Кількість речовини. Розрахунки за хімічними формулами». |
|
|
39 |
|
Контрольна |
Перевірити рівень |
|
|
|
|
робота з теми «Кількість речовини. Розрахунки за хімічними формулами». |
знань і вмінь здійснювати розрахунки з використанням понять «кількість речовини», «молярна маса», «молярний об'єм», «відносна густина газу». Виявити рівень навчальних досягнень учнів з теми «Кількість речовини. Розрахунки за хімічними формулами». |
|
|
Тема 4. Основні класи неорганічних сполук (25 + 6 год) |
||||
|
40 |
|
Основні класи неорганічних сполук.
|
Сформувати уявлення про загальну класифікацію неорганічних речовин на підставі отриманих раніше знань про прості та складні речовини. |
|
|
41 |
|
Оксиди, їх склад і назви. Класифікація оксидів.
|
Розширити знання про класифікацію неорганічних речовин на прикладі оксидів та їх класифікацію за складом. Ознайомити із сучасною науковою українською номенклатурою оксидів. Формувати навички використання номенклатури на прикладі назв оксидів. Розвивати навички учнів зі складання формул бінарних сполук на прикладі складання формул оксидів. |
Демонстрації: 7. Зразки оксидів.
|
|
42 |
|
Кислоти, їх склад і назви. Класифікація кислот.
|
Розширити знання про класифікацію неорганічних речовин на прикладі кислот. Ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот. |
Демонстрації: 9. Зразки кислот.
|
|
43 |
|
Солі (середні), їх склад і назви.
|
Розширити знання про класифікацію неорганічних речовин і номенклатуру неорганічних речовин на прикладі солей. Навчити називати солі, складати їхні формули за валентністю, розпізнавати серед інших класів неорганічних сполук. Розвивати вміння й навички складання формул за валентністю на прикладі солей, виконувати розрахунки. |
Демонстрації: 16. Зразки солей
|
|
44 |
|
Основи, їх склад і назви. Класифікація основ.
|
Розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ. Розвивати вміння й навички складання формул неорганічних сполук за валентністю на прикладі основ, складання назв речовин за сучасною українською номенклатурою, розпізнавання класів неорганічних речовин. |
Демонстрації: 11. Зразки основ |
|
45 |
|
Фізичні й хімічні властивості оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
|
Ознайомити учнів з фізичними й хімічними властивостями оксидів. Дати поняття індикаторів, пояснити значення їх використання для визначення кислот і основ. Розвивати логічне мислення учнів на прикладі порівняння взаємодії кислотних і основних оксидів з водою, кислотами, лугами, іншими оксидами. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів. |
Демонстрації: 8. Взаємодія кислотних і основних оксидів із водою.
|
|
46 |
|
Оксиди в природі. Використання оксидів.
|
Поглибити знання про класи неорганічних сполук на прикладі фізичних і хімічних властивостей оксидів. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів, навички виконання розрахунків за хімічними формулами. Ознайомити учнів з поширенням оксидів у природі, показати зв'язок між властивостями та сферами використанням оксидів. Дати поняття індикаторів, пояснити |
|
|
|
|
|
значення їх використання для визначення середовища. |
|
|
47 |
|
Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
|
Закріпити знання про хімічні властивості оксидів. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів. Розвивати вміння й навички виконання розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. |
|
|
48 |
|
Фізичні й хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами,основ ами й солями. Поняття про ряд активності металів.
|
Ознайомити учнів з фізичними й хімічними властивостями кислот. Розширити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот, їх узаємодіїз металами, основними оксидами, основами й солями. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот. |
Демонстрації: 10. Хімічні властивості кислот. Лабораторні досліди: 6. Дія водних розчинів кислот на індикатори.
|
|
49 |
|
Реакції заміщення й обміну. Правила безпеки під час роботи з кислотами. Використання кислот. |
Закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти. Поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот. |
Лабораторні досліди: 7. Взаємодія хлоридної кислоти з металами. |
|
|
|
|
Розвивати навички експериментальної роботи з кислотами, повторити правила техніки безпеки під час роботи з кислотами. Ознайомити учнів зі сферами використання кислот. |
|
|
50 |
|
Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
|
Закріпити знання про хімічні властивості оксидів і кислот. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів, кислот. Розвивати вміння й навички виконання розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. Підготувати учнів до проміжного оцінювання з теми «Властивості оксидів, кислот». |
|
|
51 |
|
Контрольна робота з теми «Класи неорганічних сполук. Фізичні й хімічні властивості оксидів, кислот». (проміжне оцінювання)
|
Узагальнити й систематизувати знання учнів про класифікацію неорганічних сполук, фізичні та хімічні властивості оксидів і кислот. Визначити рівень навчальних досягнень учнів з цієї теми. |
|
|
|
|
|
|
|
|
52 |
|
Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.
|
Ознайомити учнів з фізичними властивостями основ, закріпити знання про класифікацію основ на розчинні й нерозчинні. Розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі основ, показати дію лугів на індикатори. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ. |
Демонстрації: 12. Хімічні властивості основ. Лабораторні досліди: 2. Дія водних розчинів лугів на індикатори.
|
|
53 |
|
Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання.
|
Закріпити знання учнів про хімічні властивості основ. Розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ. |
Лабораторні досліди: 3. Взаємодія лугів із кислотами в розчині. 4. Взаємодія нерозчинних основ із кислотами. 5. Термічне розкладання нерозчинних основ.
|
|
54 |
|
Поняття про амфотерні основи.
|
Розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і |
Демонстрації: 14. Доведення амфотерності цинк |
|
|
|
|
основ. Розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук. Формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ. |
гідроксиду.
|
|
55 |
|
Правила безпеки під час роботи з лугами. Використання основ.
|
Закріпити й поглибити знання про хімічні властивості класів неорганічних сполук на прикладі властивостей основ. Розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ, здійснення розрахунків за хімічними рівняннями. Повторити правила техніки безпеки під час роботи з лугами. Ознайомити учнів зі сферами використання основ. |
|
|
56 |
|
Фізичні й хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
|
Розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі властивостей середніх солей. Розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей. |
Демонстрації: 15. Таблиця розчинності кислот, основ та солей. 16. Зразки солей. 17. Хімічні властивості солей. |
|
|
|
|
|
|
|
57 |
|
Поширення солей у природі та їх практичне значення.
|
Систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей. Показати поширення солей у природі, їх практичне значення. |
Лабораторні досліди: 8. Взаємодія металів із солями у водному розчині. 9. Взаємодія солей з лугами у водному розчині. 10. Реакція обміну між солями в розчині. Домашній експеримент: 1. Взаємодія яєчної шкаралупи з оцтом.
|
|
58 |
|
Практична робота № 1. Дослідження властивостей основних класів неорганічних сполук.
|
Продовжити формування навичок роботи з хімічними речовинами й лабораторним устаткуванням. Перевірити знання техніки безпеки під час роботи в кабінеті хімії. Поглибити знання про хімічні властивості оксидів, кислот, основ і солей. |
|
|
|
|
|
Визначити рівень засвоєння знань про хімічні властивості класів неорганічних сполук. |
|
|
59 |
|
Семінарське заняття з теми «Основні класи неорганічних сполук». |
Узагальнити й систематизувати знання учнів про властивості класів неорганічних сполук, їх генетичний зв'язок. Визначити рівень навчальних досягнень з теми.
|
|
|
60 |
|
Генетичний зв'язок між класами неорганічних сполук.
|
Розкрити взаємозв'язок явищ у природі на прикладі взаємоперетворень одних класів речовин на інші. Узагальнити знання про неорганічні речовини та їх властивості. Розвивати вміння порівнювати склад і властивості речовин, класифікувати речовини й реакції, встановлювати генетичний зв'язок між класами неорганічних сполук. |
Домашній експеримент: 2. Дія на сік буряка оцту, лимонного соку, розчину харчової соди, мильного розчину. |
|
61 |
|
Генетичний зв'язок між класами неорганічних сполук.
|
Розкрити взаємозв'язок явищ у природі на прикладі взаємоперетворень одних класів речовин на інші. Узагальнити знання про неорганічні речовини та їх властивості. Розвивати вміння порівнювати склад і властивості |
|
|
|
|
|
речовин, класифікувати речовини й реакції, встановлювати генетичний зв'язок між класами неорганічних сполук. |
|
|
62 |
|
Загальні способи одержання оксидів, основ, кислот, солей. |
Ознайомити учнів із загальними способами одержання оксидів, основ, кислот, солей. Розвивати навички роботи з навчальною літературою. На прикладі одержання різних класів неорганічних сполук показати взаємозв'язок між будовою, штастивостями та способами одержання цих речовин. |
|
|
63 |
|
Загальні способи одержання оксидів, основ, кислот, солей. |
Розвивати вміння й навички учнів складати рівняння на прикладі одержання оксидів, основ, кислот, солей. Систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей, показати їх узаємозв'язок з генетичним зв'язком класів неорганічних сполук. |
Демонстрації: 13 Добування хлоридної кислоти і досліди з нею.
18. Взаємодія кальцій оксиду з водою, дослідження добутого розчину індикатором, пропускання вуглекислого газу крізь |
|
|
|
|
|
розчин. 19. Спалювання фосфору, розчинення добутого фосфор(V) оксиду у воді, дослідження розчину індикатором і нейтралізація лугом.
|
|
64 |
|
Значення експериментального методу в хімії. |
Розвивати навички й уміння розв'язання експериментальних задач, використання знання про властивості речовин різних класів неорганічних сполук для визначення цих речовин. Показати значення експерименту в хімічних дослідженнях, повторити правила техніки безпеки. |
Лабораторні досліди: 11. Розв’язування експерименталь них задач.
|
|
65 |
|
Практична робота № 2. Розв'язання експерименталь них задач. |
Перевірити знання правил техніки безпеки; навички роботи з лабораторним устаткуванням, хімічними реактивами, навички проведення хімічного експерименту. Перевірити навички практичного використання знань про фізичні й хімічні |
|
|
|
|
|
властивості речовин різних класів неорганічних сполук. |
|
|
66 |
|
Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. |
Розвивати вміння й навички розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. Повторити хімічні властивості класів неорганічних сполук, генетичний зв'язок між ними. Підготувати учнів до тематичного оцінювання. |
|
|
67 |
|
Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. |
Розвивати вміння й навички розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. Повторити хімічні властивості класів неорганічних сполук, генетичний зв'язок між ними. Підготувати учнів до тематичного оцінювання. |
|
|
68 |
|
Семінарське заняття з теми: «Основні класи неорганічних сполук». |
Узагальнити, систематизувати та скоригувати знання учнів з теми «Основні класи неорганічних сполук». З'ясувати рівень засвоєння знань, умінь і навичок про класи неорганічних сполук на прикладі оксидів, основ, кислот і солей, їх фізичних і хімічних властивостей, способи одержання, рівень розуміння |
|
|
|
|
|
основних понять, уміння використовувати їх на практиці. |
|
|
69 |
|
Контрольна роботаз теми «Основні класи неорганічних сполук». |
Узагальнити й систематизувати знання учнів з теми «Основні класи неорганічних сполук». Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці. |
|
|
70 |
|
Підсумковий урок. Аналіз контрольної роботи й коригування знань учнів. |
Узагальнити знання, уміння й навички, набуті під час вивчення теми «Класи неорганічних сполук». Скоригувати виявлені недоліки й прогалини в знаннях учнів з теми; проаналізувати рівень навчальних досягнень учнів з теми. |
|
Орієнтовне поурочне планування Хімія 8 клас
Урок 1
Тема: Основні поняття хімії.
Мета:Повторити хімічні поняття, розглянуті під час вивчення хімії в 7 класі: «речовина», «атом», «молекула», «йон», «хімічний елемент», «відносна атомна й молекулярна маси», «прості та складні речовини», «хімічна формула», «фізичні й хімічні явища», «хімічні рівняння». Повторити вивчені відомості про прості речовини на прикладі кисню. Удосконалювати навички складання хімічних формул і рівнянь. Згадати розчин і його компоненти: розчинник, розчинена речовина, кількісний склад розчину.
Основні поняття:«речовина», «атом», «молекула», «йон», «хімічний елемент», «відносна атомна й молекулярна маси», «прості та складні речовини», «хімічна формула», «фізичні й хімічні явища», «хімічні рівняння», « розчин», «розчинник», «розчинена речовина», « масова частка розчиненої речовини».
Формування компетентностей:Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку:узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви:періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І. Повідомлення теми, цілей і завдань уроку.
ІІ. Актуалізація і корекція опорних знань.
Назвіть і перелічіть основні хімічні поняття, розглянуті під час вивчення хімії у 7 класі.
ІІІ. Повторення і узагальнення понять, їх систематизація.
.Виберіть одну правильну відповідь
1.Вкажіть назву явища, що відбувається з зміною агрегатного стану та формиречовини:
А географічне; Б біологічне; В хімічне; Г фізичне
2.Вкажіть назву числа перед формулою, що показує кількість частинок:
А індекс; Б валентність; В заряд; Г коефіцієнт
3.Вкажіть назву найменшої частинки речовини, що зберігає її хімічні властивості:
А атом; Б йон; В молекула; Г катіон
4.Вкажіть частинки, що входять до складу складних речовин: А молекули різних елементів; В сукупність катіонів;
Б атоми різних елементів; Г молекули речовин
5. Виберіть ряд , в якому перелічені тільки назви речовин .
А) залізо , гума , срібло , вода; Б) м’яч, іграшка, гума, шина; В) вода , лід , ванна,пара;
6. Суміші бувають:
А) однорідні та неоднорідні; Б)однорідні та чисті ; В) неоднорідні та рідкі;
7. Усі речовини за складом поділяються на такі:
|
А однорідні та неоднорідні |
Б прості та складні |
В органічні та прості |
Г неорганічні та складні |
Виберіть кілька правильних відповідей 8.Випишіть з переліку елементи-неметали:
А Li; Б P; В Fe; Г As; Д Zn
9.Випишіть формули сполук у яких атоми металів мають валентність II:
А СaF2; Б MnO2; В CO; Г Zn3P2
10. Запропонуйте способи розділення сумішей:
а) розчин крейди у воді;
б) деревного вугілля та порошку заліза.
11. Визначити валентність атомів елемента у сполуках з Оксигеном: СаО, АІ2О3 СО2, Н2О, N2O3, SO3.
12. Який атом легший – Карбону чи Титану? У скільки разів? 13. Урівняйте рівняння хімічних реакцій:
Ag + Cl → AgCl Al +HCl →AlCl3 +H2
Cu + HgCl2 → CuCl2 + Hg Ag2O →Ag +O2
H2O + Cl2 →HCl + O2 Na +H2O →NaOH +H2
Al +O2 →Al2O3 Al +S →Al2S3
KMnO4 →K2MnO4 +MnO2 +O2 NaNO3 →NaNO2 +O2
14. Скласти рівняння реакцій ,за допомогою яких можна здійснити такі перетворення:
![]() SO2
SO2
H2O2→O2
Fe3O4
15. Яка маса солі міститься в 100 г розчину з масовою часткою розчиненої речовини 10 % ?
ІVПідсумки уроку;повідомлення домашнього завдання.
Повторити основні хімічні поняття.
Складіть рівняння горіння вугілля, фосфору, гідроген сульфіду.
У розчині масою 250 г міститься цукор масою 50 г.Обчисліть масову частку цукру в даному розчині.
Урок 2
Тема:Діагностична контрольна робота.
Мета:Оцінити рівні навчальних досягнень учнів, їх розвитку та вихованості; сформованості універсальних та інтегрованих прийомів навчальної діяльності; оволодіння спеціальними знаннями, уміннями та навичками; самостійність і творчу активність учнів;інформацію про типове та індивідуальне в навчальній підготовленості кожного учня окремо та учнів класу в цілому.
Формування компетентностей:Загальнопредметна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку : контроль та коригування знань, уміньі навичок.
Обладнання : картки – завдання.
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
8 кл. Діагностичний тест Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть назву явища, що відбувається з зміною агрегатного стану та форми речовини:
А географічне; Б біологічне; В хімічне; Г фізичне
2 Вкажіть назву числа перед формулою, що показує кількість частинок:
А індекс; Б валентність; В заряд; Г коефіцієнт
3 Вкажіть назву найменшої частинки речовини, що зберігає її хімічні властивості:
А атом; Б йон; В молекула; Г катіон
4 Вкажіть частинки, що входять до складу складних речовин: А молекули різних елементів; В сукупність катіонів;
Б атоми різних елементів; Г молекули речовин 5 Вкажіть відносну молекулярну масу кисню:
А 16; Б 8; В 32; Г 15
6 Вкажіть схему обчислення відносної молекулярної маси Fe3O4:
А 56 + 16; Б 3 + 55 + 4 + 16; В 3 · 56 + 4 · 16; Г 56 · 3 + 16
7 Вкажіть значення коефіцієнтів у рівнянні К + О2 = К2О:
А 2, 1, 1; Б 1, 1, 2; В 4, 1, 2; Г 4, 2, 2
Виберіть кілька правильних відповідей
8 Випишіть з переліку елементи-неметали:
А Li; Б P; В Fe; Г As; Д Zn
9 Випишіть формули сполук у яких атоми металів мають валентність II:
А СaF2; Б MnO2; В CO; Г Zn3P2
10 Встановіть відповідність між поширенням у природі і хімічним елементом:
Поширення у природі Хімічний елемент
|
1 |
|
|
2 |
|
|
3 |
|
1 найпоширеніший елемент космосу; А N; 2 найпоширеніший у земній корі; Б H; 3 найпоширеніший в атмосфері Землі; В O;
Г Al
11 Закінчіть рівняння реакції:
А H2O2→ Б Zn + O2 →
12 Обчисліть відносну молекулярну масу Ca(OH)2.
13 Обчисліть масову частку Оксигену у Ca(OH)2.
14 Виведіть формулу речовини, що містить 30,43% Нітрогену та 69,57% Оксигену.
8 кл. Діагностичний тест. Варіант № 2
Виберіть одну правильну відповідь
1 Вкажіть назву явища, що відбувається з зміною складу, будови речовини:
А біологічне; Б хімічне; В фізичне; Г географічне
2 Вкажіть як позначається фізична величина, що визначається відношенням маси молекули до 1/12 маси атома Карбону:
А Mr; Б m; В Ar; Г A
3 Вкажіть назву зарядженої частинки, що утворюється внаслідок приєднання або втрати електроніватомом (групою атомів):
А молекула; Б йон; В атом; Г катіон
4 Вкажіть як називається умовне позначення хімічної реакції:
А хімічний символ; Б хімічне рівняння; В хімічна формула 5 Вкажіть відносну атомну масу Натрію:
А 22; Б 11; В 10; Г 23
6 Вкажіть схему обчислення відносної молекулярної маси Fe2O3:
А 2 + 55 + 3 + 16; Б 3 · 56 + 2 · 16; В 2 · 56 + 3 · 16; Г 56 + 16 7 Вкажіть значення коефіцієнтів у рівнянні Р + О2 = Р2О3:
А 4, 3, 1; Б 2, 1, 2; В 4, 1, 2; Г 4, 3, 2
Виберіть кілька правильних відповідей
8 Випишіть з переліку формули простих речовин:
А Lі; Б H2SO3; В Cl2; Г H2О; Д HJ
9 Випишіть формули сполук у яких атоми металів мають валентність I:
А F2O; Б K2O; В CsJ; Г AuCl3
10 Встановіть відповідність між поширенням у природі і хімічним елементом:
Поширення у природі Хімічний елемент
|
1 |
|
|
2 |
|
|
3 |
|
1 найпоширеніший в атмосфері Землі; А Al;
2 найпоширеніший елемент космосу; Б O; 3 найпоширеніший у гідросфері; В H;
Г N
11 Закінчіть рівняння реакцій та урівняйте:
А P + O2 → Б CH4 + O2 →
12 Обчисліть відносну молекулярну масу Na2CO3.
13 Обчисліть масову частку Оксигену у Na2CO3.
14 Виведіть формулу речовини, що містить 38,71% Магнію та 61,29% Флуору.
Урок 3
Тема:Короткі історичні відомості про спроби класифікації хімічних елементів. Поняття про лужні, інертні елементи, галогени.
Мета: Повторити та систематизувати знання учнів про хімічний елеметнти; пояснити причину необхідності класифікації хімічних елементів; дати поняття про природні групи хімічних елементів; розповісти про властивості хімічних елементів, які складають групу лужних металів і групу галогенів; повторити вже відомі учням властивості простих речовин (металів і неметалів), підвести до розуміння подібності властивостей деяких елементів.
Основні поняття: Хімічний елемент, проста речовина, складна речовина, періодичний закон, періодична система, будова речовини.
Обладнання і реактиви: Періодична система хімічних елементів Д.І.Менделєєва (короткий та довгий варіанти); тадлиця розчинності; зразки лужних і лужноземельних металів; чашка Петрі, вода, розчин фенолфталеїну.
Формування компетентностей: Загальнопредметна, самоосвіти, саморозвитку.
Тип уроку:Урок вивчення нового матеріалу.
Хід уроку
І Організаційний етап ІІ. Актуалізація опорних знань Бесіда.
1) Що таке «хімічний елемент» ?(Певний тип атомів) 2) Яка різниця між поняттям «хімічний елемент» і «проста речовина»? (Проста речовина – форма існування хімічного елемента.)
3) На які групи за властивостями поділяються хімічні елементи» (Метали та неметали.)
4) Які фізичні властивості характерні для металів? (Добре проводять електричний струм і тепло, більшість з них пластичні, багато металів мають сірий або сріблястосірий колір, металічний блиск.)
5) Які метали забарвлені у червоний та жовтий кольори? (золото, мідь).
6) Які фізичні властивості характерні для неметалів? ( Погано проводять електричний струм та тепло, крихкі, забарвлені у різні кольори.)
7) Наведіть приклади металів різних за кольором. (Сірка – жовта, графіт – чорний, хлор – жовтозелений газ , фтор – зелений газ.) 8) Яка будова характерна для металів і неметалів? (Всі метали мають немолекулярну будову, тоді як неметали можуть мати як молекулярну так і немолекулярну.)
9) Чи існує різка межа між металами і неметалами? (Різкої межі не існує. Деякі неметали проводять електричний струм (Графіт), мають металічний блиск (Йод) , а метали дуже крихкі (Стибій).
ІІІСприймання і усвідомлення учнями нового навчального матеріалу
1. Необхідність класифікації хімічних елементів.
Розповідь учителя
Становлення атомно-молекулярної теорії на межі ХVІІІ – ХІХ століть призводить до відкриття чсельних хімічних елементів. Лише у першому десятилітті ХІХ століття дуло відкрито близько 14 хімічних елементів. Рекордсменом серед відкривачів став англійський хімік Гемфрі Деві, який протягом одного року використовуючи новий метод, електроліз добув 6 нових простих речовин (натрій., калій, магній, кальцій, сторнцій, барій).
Бесіда
1) Які речовини називають простими?
2) Як за складом відрізняються прості речовини від складних?
Розповідь учителя
На початку 1830 року число відомих хімічних елементів сягнуло 55, а до 70-х років ХІХ століття було відомо понад 60 хімічних елементів.. І у хімії, як і у іншших природничих науках, по мірі накопичення фактів, виникла необхідність їхньої класифікації. Перша спроба класифікації заключалася у поділі всіх елементів на дві групи – метали і неметали.
Бесіда
На чому базувався такий розподіл елементів на групи?
2. Відкриття природних груп хімічних елементів
Далі були відкриті природні групи хімічних елементів, всередені яких спостерігався взаємозв’язок між елементами.
Завдання
Для демонстрації подібності деяких хімічних елементів за хімічними властивостями пропонуються такі завдання.
1) Напишіть рівняння реакції натрію та калію з водою. Назвіть продукти реакцій.
2) Яку валентність виявляють ці метали у сполуках?
Розповідь учителя
Подібність мають не лише Натрій Na і КалійK, а також ЛітійLi, РубідійRb,
ЦезійCs і ФранційFr . Так як ці метали розчиняючись у воді утворюють луги (розчинні і воді основи). Вонидістали назву лужних металів. Лужні метали одновалентні та мають подібні за складом і властивостями сполуки.
Робота з таблицею.
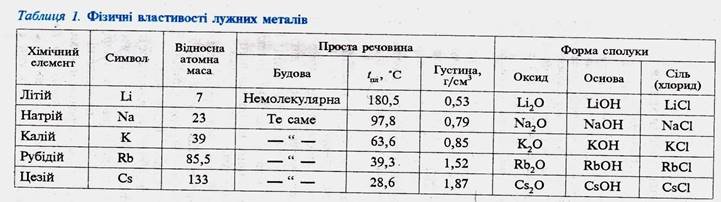
Учні вивчають таблицю у якій розглянуті властивості лужних металів.
Демонстрація
Особливості взаємодії лужних металів з водою.
У кристалізатор наповнений водою, додати невелику кількість розчину фенолфталеїну. Потім поміщаємо по невеликому шматочку різних лужних та лужноземельних металів. Під час проведення досліду звертаємо увагу учнів на умови зберігання цих металів і заходи безпеки під час роботи з ними.
Під час обговорення досліду порівнюємо активність взаємодії різних металів з водою. Окремо лужних, окремо лужноземельних.
Розповідь учителя
Відомі й інші природні групи хімічних елементів, подібних за властивостями наприклад ФлуорF, ХлорCL, БромBr, ІодI.. Їм властива леткість і висока хімічна активність. Вони взаємодіють з воднем з утворенням газоподібних сполук, воді розчини яких є кислотами. Усі вони одновалентні.
Розповідь учителя
Елементи цієї природної групи називають галогенами. Крім лужних металів і галогенів відомі також інші природні групи., наприклад група інертних елементів, що у увигляді простих речовин дістала назву благородних газів. Це Гелій Не, Неон Ne, АргонAr, КриптонKr, Kсенон Xe.
Бесіда
Чому гази VІІІ групи називають інертними (благородними)
3. Спроби класифікації хімічних елементів
Розповідь учителя
Існування великої кількості елементів, різпорідних за своїми властивостями, вимагало їхнього впорядкування й систематизації. Багато вчених намагалися знайти закономірності у списку елементів.
Англійський вчений Джон Ньюландс помітив, що при розміщенні елементів у порядку зростання атомних мас хімічні властивості восьмого елемента подібні до властивостей першого. Цій закономірності він дав назву «правило октав».
І Деберейнер (Німеччина) склав елементи у тріади. До тріад входили подібні елементи, при цьому атомна маса середнього елемента була середнім арифметичним атомних мас двох інших елементів.
А Шанкуртуа (Франція) розмістив елементи у порядку зростання їхніх атомних мас по спіралі, описаній навколо циліндра.
У 1864 році німецький хімік Лотар Мейєр опублікувіав таблицю з 27 хімічних елементів. Він розмістив їх в порядку зростання атомних мас, згрупувавши за валентністю, і отримав шість груп подібних елементів.
Про те вони не змогли створитии єдиної періодичної системи всіх елементів, оскільки у відкритих ними закономірностях багато відомих на той час хімічних елементів не мали свогого місця. Та й ніяких серйозних висновків із своїх спостережень ученим також зробити не вдалося, хоча вони і здогадувалися, що чисельні співвідношення між атомними масами елементів є проявом якогось загального закону. Цей закон був відкритий великим російським хіміком Дмитром Івановичем Менделєєвим 1869 року.
І V. Закріплення знань
Тестування
Проводиться тест «Група лужних металів». Учитель читає твердження. Учні відповідають «так» чи «ні».
1. До групи лужних металів належить такі елементи: Літій, Рубідій, Цезій, Нарій, Кальцій.
2. Натрій і Калій мають металічний блиск.
3. Натрій і Калій енергійно реагують з водою за звичайних умов.
4. У сполуках Натрій і Калій двовалентні.
5. Нарій гідроксид та калій гідроксид нерозчинні у воді.
6. Метали натрій і калій м’які, легко ріжуться ножем.
7. Натрій і калій тугоплавкі.
8. Лужні метали погано проводять електричний струм і тепло.
9. Усі лужні метали мають однакову густину, а також однакові значення температур плавлення та кипіння.
10. Оксиди лужних металів мають основні властивості.
11. Для лужних металів є характерною молекулярна будова.
12. Розчини гідроксидів натрію і калію змінюють забарвлення індикаторів.
VПідсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 4
Тема:Періодичний закон. Періодична система – графічне відображення періодичного закону.
Мета:Повторити і систематизувати знання учнів про природні групи хімічних елементів; дати формулювання періодичного закону; ознайомити із структурою періодичної системи; дати поняття про те, що періодичний закон є класичним прикладом наукового підходу до пізнання навколишнього світу.
Основні поняття: Періодичність, періодичний закон, періодична система, хімічний елемент, відносна атомна маса.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Тип уроку:урок засвоєння нових знань
Хід уроку І Організаційний момент.
ІІ Актуалізація опорних знань
Бесіда
1)Чому виникла необхідність класифікації хімічних елементів?
2) Хто здійснив перші спроби класифікації хімічних елементів?
3) Які елементи входять до групи лужних металів?
4) Які спільні властивості характерні для лужних металів?
5) Які хімічні елементи входять до групи галогенів?
6) Які спільні ознаки цих елементів?
7) Які природні групи хімічних елементів вам відомі?
8) Назвіть учених, що намагалися систематизувати хімічні елементи?
ІІІ Сприймання і усвідомлення учнями нового навчального матеріалу 1. Історія відкриття періодичного закону
Вчених, які намагалися запропонувати свою класифікацію хімічних елементів , до Д.І. Менделєєва, було багато.Менделєєв поважав їхні намагання, проте він відзначав основний недолік: всі вони порівнювали властивості елементів, і жоден – величини їх атомних мас.
Відкриття Д.І.Менделєєва періодичного закону прийнято датувати 1березням 1869 року. Цього дня Менделєєв завершив роботу над таблицею «Дослідження системи елементів заснованої на їхній атомній вазі та хімічній подібності». Ця таблиця була лише прообразом періодичної системи, оскільки в ній не було поділу на періоди.
Початок створення періодичної системи Менделєєвим пов'язаний із його роботою над виданням «Основ хімії» з міркуваннями про те, в якій послідовності викладати відомості про окремі хімічні елементи.
Періодичний закон був відкритий не в один день, відкриттю передував довгий період роздумів та пошуків.
Момент відкриття періодичного закону описаний у спогадах А.А.Іностранцева.
Менделєєв три дні і три ночі, не лягаючи спати працював, намагаючись сформулювати результати своєї уявної конструкції в таблицю, але його спроби були невдалими. Нарешті вкрай стомлений Менделєєв ліг спати і одразу ж заснува. «Бачу у сні таблицю, де елементи розставлені, як треба. Прокинувся, негайно записав на клаптику паперу, - лише згодом стало потрібним водному місці виправлення». З цих спогадів Іностранцева і виникла версія про те, що Менделєєв зробив своє відкриття уві сні.Але це легенда, одного разу на запитання, як він відкрив періодичну систему, учений відповів: «Я над нею, може бути, двадцять років думав, а ви думаєте: сидів і раптом ... готове ».
Насправді одне з найбільших відкритів у хімії було зроблене вченим після тривалої й виснажливої праці. Проте справжнє визнання генія Менделєєва стало приходити тоді, коли один за одним почали виявлятися передбачені нам елементи.
2. Періодичний закон Д.І.Менделєєва (1869 рік)
Розповідь учителя
Дмитро Іванович Менделєєв у 1869 році сформулював періодичний закон у вигляді таких положень:
• Елементи, розташовані за величиною атомної маси, представляють виразну періодичність властивостей.
• Треба чекати відкриття ще багатьох невідомих елементів з атомною масою 65-75 і подібних, до Алюмінію і Силіцію.
• Величину атомної маси елемента, знаючи його аналогії, іноді можна виправити.
• Деякі аналоги елементів відкриються за величиною маси їхніх атомів.
Використовуючи ці положення, Менделєєв склав свій варіант періодичної системи елементів, який є графічним відображенням періодичного закону. У найпершій таблиці всі елементи до Кальцію включно такі, які і у сучасних таблицях(за винятком благородних газів). Якщо виходити з принципу збільшення атомної маси, то наступним після Кальцію повинні бути Ванадій (Аr = 51), Хром (Аr = 52), Титан ((Аr = 52). (Дані атомних мас 1869 р). Однак Менделєєв після Кальцію поставив знак питання, а наступним помістив Титан,змінивши його атомну масу з 52 на 50. Невідомому елементу була прописана атомна маса 45, що є середнім арифметичних атомних мас Кальцію та Титану. Далі між Цинком та Арсеном, він залишив місце для відразу для двох, ще невідкритих елементів. Окрім цього він помістив Телур перед Йодом, хоча останній мав меншу атомну масу. При такому розташування всі горизонтальні ряди в таблиці містили тільки подібні елементи й чітко виявлялася періодичність змін їхніх властивостей. Протягом останніх двох років вчений вдосконалив систему елементів. 1871 році вийшло перше видання підручника Менделєєва «Основи хімії», в якому періодична система була наведена у сучасному вигляді. Саме тоді з'явилося формулювання періодичного закону: «Фізичні і хімічні властивості елементів, які виявляються у властивостях простих і складних тіл, передувають у періодичній залежності від їхньої атомної маси».
3. Тріумф періодичного закону
Розповідь учителя
Менделєєв не тільки передбачив існування нових хімічних елементів, але й описав їх властивості. 1871 року в журналі Російського хімічного товариства з'явилася стаття вченого, де були докладно описані властивості трьох невідомих хімічних елементів, які автор назвав екабором, («ека» на санскриті означає «одне й те саме»), еакаалюмінієм і екасиліцієм. Згідно із Менделєєви, хімічні властивості нових хімічних елементів і формули їхніх основних сполук повинні бути такі самі, як ї в їхніх аналогів. Протягом наступних 15 років передбачення вченого блискуче підтвердилося.
Бесіда
Як ви важаєте чому періодичний закон є класичним прикладом наукового підходу до пізнання навколишнього світу?
ІVЗакріплення знань
1) Запишіть символи елементів другого періоду в порядку зростання їхніх відносних атомних мас, укажіть формули сполук цих елементів з Оксигеном і Гідрогеном, формули гідроксидів.
2) Напишіть формули оксидів і гідроксидів Магнію, НІтрогену, Алюмінію, Натрію і Карбону.
3) Знайдіть у періодичній системі елементи з порядковим номером №11 і №13. Запишіть формули їх оксидів.
Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).Підготувати повідомлення про відкриття екабору, екаалюмінію та екасиліцію.
Урок 5
Тема:Поняття про періоди і групи
Мета:Повторити і систематизувати знання учнів про періодичність зміни властивостей хімічних елементів; дати понятитя про структуру переідичної системи, періоди і групи; виявити зв’язок між положенням елемета у періодичній системі та його властивостями; обговорити з учнями відкриття періодичного закону, підвести до глибшого осмислення явища періодичності; дати поняття про структурні одиниці періодичної системи.
Основні поняття: порядковий номер, період, група, підгрупа, періодична система.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Хід уроку
І Організаційний момент
ІІ Актуалізація опорних знань учнів.
1) Хто і коли відкрив періодичний закон? Сформулюйте його.
2) Яку характеристику хімічних елементів обрав Д.І.Менделєєв за основу систематизації?
3) Який зміст поняття «періодичність»
4) Що є графічним відображенням періодичного закону?
5) Існування яких хімічних елементів передбачив Менделєєв
Повідомлення учнів про відкриття екабору, екаалюмінію та екасиліцію
ІІІСприймання і усвідомлення учнями нового навчального матеріалу
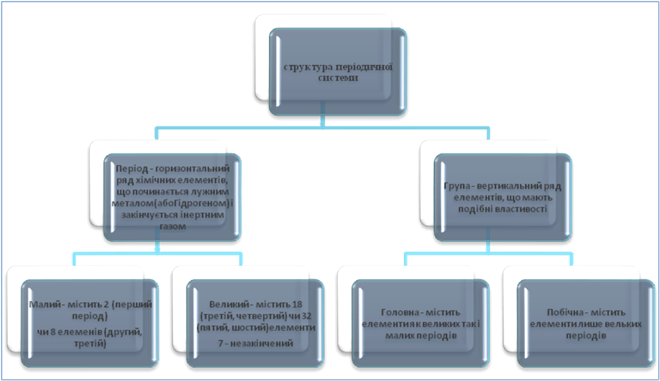
1. Структура періодичної системи:порядковий номер хімічного елемента, періодита групи
Розповідь учителя
Кожен хімічний елемент займає своє місце у періодичній системі. Всі елементи пронумеровані в послідовному порядку. Ці номери називаються порядковими. Період – це горизонтальний ряд хімічних елементів, що починається лужними металом і закінчується інертним газом. Період в якому міститься 2 чи 8 хімічних елементів називається малим. Хімічні елементи в ньому розміщені водному ряду. Період, що містить 18 чи 32 хімічних елементів називається великим. У ньому елементи розміщені у два ряди.
Група – вертикальний стовпчик хімічних елементів. Групи діляться надві підгрупи: головну та побічну.
Існує два види періодичної системи короткоперіодний, який широко використовується у нашій країні та довгоперіодний якому віддають перевагу в західних країнах.
У короткоперіодному варіанті періодична система складається з семи періодівта восьми груп.Довгий час сьомий період важався незавершеним, але за останніми даними американські, російські та японські вчені відкрили елементи, що завершують сьомий період.
Робота зі схемою
Під час вивчення структури можна скористатися наступною схемою.
2. Основні закономірності зміни властивостей хімічних елементів періодичної системи
Робота з таблицєю
Розглядаючи основні закономірності зміни властивостей елементів періодичної системи, вчитель може зобразити періодичність зміни властивостей елементів у вигляді таблиці
Закономірність зміни властивостей хімічних елементів
|
Властивості |
Закономірні зміни |
|
|
У головних підгрупах |
У періодах |
|
|
Металічні |
Посилюютьсмя |
Посилюється |
|
Неметалічні |
Посилюється |
Посилюється |
|
Вища валентність за Оксигеном |
Постійна |
Збільшується
|
|
Валентність у летких сполуках з Гідрогеном |
Постійна |
Збільшується
|
ІV Осмислення, узагальнення і систематизація знань
Хімічний диктант. Структура періодичної системи
1. Періодичністю називають…
2. Горизонтальний ряд елементів, що починається лужним металом і закінчується інертним газом - це…
3. Вкажіть кількість малих періодів у ПС.
4. Елементи з порядковими номерами 26-28 називають…
5. Нітроген знаходиться у … групі
6. Алюміній знаходиться у … періоді
7. Відносна атомна маса Фосфору…
8. 12 хімічний елемент періодичної…
9. Вкажіть елементи побічної підгрупи IV групи.
10. Запишіть положення атома Нітрогену у ПС Завдання
1. Хімічний елемент знаходиться у 4 періоді. Він утворює оксид, масова частка Оксигену в якому становить 21,19%. Визначте цей елемент.(Станум)
2. Елемен п’ятої групи утворює водеву сполуку, масова частка Гідрогену вякій становить 2,74%. Визначте цей елемент (Хлор) V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 6
Тема:Будова атома. Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число.
Мета:Продовжити знайомство з періодичною системою хімічних елементів Д. І. Менделєєва. На основі знань про будову атома розкрити фізичний зміст порядкового номера елемента. Розширити знання учнів про радіоактивність і будову атома; сформувати вміння визначати кількість протонів і нейтронів у атомі. Дати сучасне формулювання періодичного закону.
Основні поняття: Радіоактивність, електрон, атом, молекула, заряд ядра атома, порядковий номер, протон, нейтрон, протонне та нуклонні числа.
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Обладнання:Періодична система хімічних елементів, моделі атомів.
Хід уроку
І Організаційний етап
ІІ Актуалізація опорних знань учнів.
• Що таке період ? Які бувають періоди?
• Що таке група ? Які бувають групи?
• Що таке хімічний елемент
• Як змінюються металічні властивості у групі? Періоді?
• Як змінюються неметалічні властивості у групі? Періоді?
ІІІ Сприймання і усвідомлення учнями нового навчального матеріалу 1. Встановлення складної будови атома
Розповідь вчителя про досліди М Фарадея . Відкриття А.Беккерелем явища радіоактивності. Основні відмінності будови атома Бора і Резерфорда.
2. Протонно-нейтрона теорія будови атома
Розповідь учителя
У 1932 році радянські вчені Д.Д.Іваненко та Є.М.Гапон запропонували протонно-нейтронну теорію будови атома. Протони та нейтрони дістали загальну назву – нуклони.
Бесіда
1) Відповідно до протонно-нейтроннї теорії, з яких частинок складається атомне ядро?
2) Яку інформацію про атом дає порядковий номер?
3) Які елементарні частинку у ядрі атома обумовлюють його заряд?
4) Де зосереджена основна маса атома?
3. Фізичний зміст порядкового номера елемента
Розповідь вчителя
Фізичне значення порядкового номера полягає в тому, що порядковий номер хімічного елемента дорівнює заряду ядра його атома, тобто числу протонів. Бесіда
Якщо атом електронейтральний, то яку додаткову інформацію дає порядковий номер? ( кількість електронів у атомі дорівнює порядковому номеру хімічного елемента, так як атом електронейтральний)
4. Сучасне формулювання періодичного закону
Розповідь вчителя
Знання фізичного змісту періодичного закону дає можливість поновому розглянути періодичний закон і періодичну систему. На основі сучасних уявлень про будову атома періодичний закон формулюють так :«Властивості хімічних елементів та їх сполук перебувають у періодичній залежності від величини заряду ядра атома елемента»
ІV Осмислення, узагальнення і систематизація знань
1) Атомна маса хімічного елемента дорівнює 181, в електронній оболонці атома міститься 73 електрони. Вказати число протонів і нейтронів у ядрі.
2) Порядковий номер атома 80. Вказати його атомну масу, число електронів та нейтронів.
V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 7 Тема:Нуклід. Ізотопи. Сучасне формулювання періодичного закону.
Мета:Розширити знання про періодичний закон і періодичну систему хімічних елементів Д. І. Менделєєва. Сформувати поняття про ізотопи (стабільні й нестабільні). Дати уточнене визначення поняття «хімічний елемент» виходячи зі знань періодичного закону — фундаментального закону природи.
Основні поняття: протон, нейтрон, електрон, ядро, атом, нуклон, нуклід, ізотоп,атомна маса.
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: компетентність продуктивної праці, саморозвитку та самоосвіти, соціальна та комунікативна.
Обладнання і реактиви: перодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Організаційний етап.
ІІ Актуалізація опорних знань учнів.
• У чому полягає фізичний зміст періодичного закону?
• Сформулюйте періодичний закон Д.І.Менделєєва?
• Чим відрізняється сучасне формулювання закону від формулювання запропонованого Д.І.Менделєєвим?
• Визначити заряд ядра та число електронів атомів елементів з порядковим номером 7, 15, 35.
Індивідуальні завдання.
Під час бесіди троє учнів виконують індивідуальні завдання біля дошки за картками
Картка 1
Молярна маса вищого оксиду елемента другої групи дорівнює 56. Встановіть елемент.
Картка 2
Визначити елемент, в атомі якого знаходиться 12 електронів. Знайдіть у періодичній системі цей елемент і запишіть формулу його вищого оксиду. Розрахуйте його молекулярну масу.
Картка 3
Серед зазначених елементів третього періоду знайдіть елемент, який виявляє однакові значення валентності в сполуках з Гідрогеном та у вищому оксиді:
а) Сульфур; б) Силіцій;
в) Хлор; г) Фосфор.
Розрахуйте відносні молекулярні маси вищого оксиду і сполуки цього елемента з Гідрогеном.
ІІІ Мотивація навчальної діяльності учнів.
Як ви важаєте чому атомні маси хімічних елементів дробові числа?
ІV Сприймання і усвідомлення учнями нового навчального матеріалу
1. Поняття про нукліди і зотопи
Розповідь учителя
Різні види атомів мають загальну назву – нукліди. Нукліди характеризують трьома фундаментальними параметрами: А – нуклонне число, Z – заряд ядра, що дорівнює числу протонів (порядковому номеру), N - число нейтронів у ядрі. Ці параметри пов’язані міжз собою співвідношенням: А = Z+N
У позначені нуклідів порядковий номер (протонне число) пишуть унизу ліворуч від символо нукліда, а нуклонне число – угорі ліворуч. Нукліди з однаковим Z, але різнимиА і N, називають ізотопами.
Завдання
Розрахувати кількість протонів і нейтронів у ядрах атомів різних нуклідів:, 2040Ca , 2043Ca , 1122Na ,1124Na ,1939K ,1941K .
Бесіда
Як ви важаєте, чи однакові фізичні та хімічні властивості ізотопів хімічного елемент?
Розповідь вчителя
Зазвичай ізотопи хімічних елементів не мають окремих назв. Винятком є ізотопи Гідрогену. Їх позначають окримими символами і вони мають особисті назви. (Вчитель записує на дошці ізотопи Гідрогену.Дає їм назви і разом з учнями розбирають їхню будову.)
Нукліди бувають стійкимим і нестійкими. Відомо близько 300 стійких і більше 1400 радіоактивних (нестійки) нуклідів. Більшість природних нуклідів складається із суміші двох і більше числа стабільних нуклідів. У різних нуклідів атомна маса виражається цілим числом. Однак при визначені атомної маси експериментальним методом використовується природна суміш ізотопів, яка складається з різних нуклідів, тому експериментальне значення атомної маси є середнім арифметичним атомних мас різних нуклідів з урахуванням їхніх масових часток у природній суміші.
З усіх елементів найбільше число стабільних нуклідів має Станум (10 ізотопів). Радіоактивні нукліди поділяються на природні і штучні. А ті у свою чергу самодовільно розпадаються, випромінюючи ά- чи β- частинки, дотих пір поки не утворяться стабільні нукліди.
Відкриття ізотопв дало змогу поглибити знання про хімічний елемент. Виходячи з цього: «Хімічний елемент – вид атомів з однаковим протонним числом (зарядом ядра)»
ІV Осмислення, узагальнення і систематизація знань
Завдання 1. Назвіть елемент за такими даними: чотиривалентний, масова частка Оксигену у оксиді дорівнює 36,78%.
Завдання 2. Один із галогенів утворює сполуку з Гідрогеном, яка містить 5% Гідрогену. Відомий оскид цього галогену, якиймістить 29,63% Оксигену. Який це галоген?
Завдання 3.Скілький нейтронів містить ядро атома елемента з порядковим номером № 33, №53, №48
V Домашнє завдання
Вивчити §. Виконати вправу (с. підручника).
Урок 8
Тема:Семінарське заняття з теми «Періодичний закон і періодична система елементів Д.І.Менделєєва».
Мета:Систематизувати отримані знання з теми
«Періодичний закон і періодична система елементів Д.І.Менделєєва»; підвищити рівень засвоєння матеріалу учнями.
Основні поняття: Хімічний елемент, проста речовина,складна речовина, періодичний закон, періодична система, радіоактивність, електрон, порядковий номер елемента, нейтрон, електрон, протон, нуклон, нуклід, ізотоп.
Обладнання і реактиви: Періодична система хімічних елементів Д.І.Менделєєва Формування компетентностей: загальнопредметна, саморозвитку і самоосвіти.
Тип уроку:урок корекції і контролю знань.
Хід уроку
Рекомендації для проведення семінару
Для проведення семінару готуємо заздалегідь бланк з таблицею оцінювання, куди записуємо прізвища учнів, присутніх на семінарі.
Підсумкова таблиця оцінювання (зразок)

І Організаційний етап
ІІ Перший етап семінарського заняття
Бесіда
Теми для бесіди
1. Спроби класифікації хімічних елементів.
2. Поняття про природні групи хімічних елементів.
3. Група лужних металів.
4. Група галогенів.
5. Структура періодичної системи.
6. Фізичний зміст періодичного закону. Радіоактивність.
7. Будова атома. Фізичний зміст порядкового номера.
8. Склад атомного ядра. Протонно-нейтронна теорія.
9. Нукліди. Ізотопи. Стабільні та радіоактивні нукліди.
ІІІ Другий етап семінарського заняття
Самостійна робота
І рівень
1) До складу головної підгруп восьмої групи періодичної системи входять елементи які називаються:
а) галогени; б) лужні метали; в) інертн гази.
2) Перша ядерна реакція була здійснена:
а) Резерфордом; б) Бором; в) Бекерелем
3) Порядковий номер хімічного елемента дорівнює числу: а) електронів; б) протонів; в) нейтронів. 4)Нуклони – загальна назва:
а) нейтронів і електронів; б) протонів і нейтронів;
в) електронів і протонів ІІ рівень
1) У якого елемента сильніше виражені металічні властивості у Магнію чи Кальцію. Відповідь поясніть.
2) Визначте кількість елементарних частинок в атомах Калію, Сульфуру і Купруму.
3) Випишіть, використовуючи періодичну систему, формули відомих вам сполук Гідрогену, що являють собою гази легші за повітря. Молекулярна маса повітря 29.
4) Один із передбачених Менделєєвим елементів, що належить до четвертого періоду, утворює оксид, у якому масова частка Оксигену 30,47%. Визначте цей елемент.
VІІ Підсумки уроку й повідомлення домашнього завдання.
Повторити §. Виконати вправу (с. підручника).
Урок 9
Тема:Стан електронів у атомі. Електронні орбіталі. Енергетичні рівні та підрівні.
Мета: Розглянути хвильовий характер руху електрона; ввести поняття «орбіталь», енергетичний рівень» і «енергетичний підрівень»; показати учням двоїсту природу електрона, утворення орбіталей під час руху електронів навколо ядра. Охарактеризувати квантові числа.
Обладнання та реактиви:Періодична система , рисунки з зображеннямs,p,d- орбіталей.
Основні поняття: електрон, орбіталь, спін, енергетичний рівень, електронна оболонка, квантові числа.
Формування компетентностей: саморозвитку та самоосвіти, соціальна та комунікативна.
Тип уроку:вивчення нового матеріалу.
Рекомендації з проведення уроку: програмою не передбачено вивчення квантових чисел, проте автори цього посібника рекомендують розглянути квантові числа для кращого засвоєння теми «Будова електронної оболонки атомів».
Хід уроку
І Організаційний момент
ІІ Актуалізація опорних знань
Самостійна робота 10 хв.( приклади завдання для самостійної роботи) Визначити положення елемента у періодичній системі, та вказати будову атома
|
Варіант № 1 5В, 6C, 21Sc |
Варіант № 2 4Be, 12Mg, 28Ni |
Варіант № 3 13Al, 14Si, 24Cr |
|
Варіант № 4 8O, 16S, 38Sr |
Варіант № 5 10Ne, 11Na, 41Nb |
Варіант № 6 15P, 7N, 35Br |
ІІІ Сприймання і усвідомлення учнями нового навчального матеріалу
1. Розходження в поводжені частинок мікросвіту та макросвіту.
Хвильова природа руху електронів. Розповідь вчителя.
2. Поняття «Орбіталь» Розповідь вчителя
На основі законів хвильової фізики і квантової механіки можна розрахувати імовірність перебування електрона в будь-якій точці простору. Якщо розглянути атом Гідрогену, виявляється, що електрон з максимальною імовірністю (95%) знаходится у невеликому кулястому шарі навколо ядра. Впевно ми неможемо визначити місце розташування електрона у певний момент часу, але ми можемо вказати місце простору в якому перебування електрона наймовірніше. Рухаючись у атомі, електрон займає тривимірну ділянку простору біля ядра,що називається атомною орбітаою. Виходячи зі сказаного – ділянка простору навколо ядра, в якій перебування електрона найімовірніше, називається орбіталлю.Чітко визначити межі орбіталі неможливо, вони розпливчасті. Електрон заповнює простір навколо ядра у формі хвилі, яку можна уявити як «електронну хмару». Густина електронної хмари різна у різних місцях. У тих місцях,куди електрон потрапляє найчастіше, утворюється зона найбільшої електронної густини. У міру віддалення від ядра густина швидко зменшується й стає такою малою, що нею можна знехтувати.
3. Форми орбіталей
Учні знайомляться з формами s- і р- орбіталей.
Розповідь учителя
Орбіталі бувають різної форми. Не можна вважати, що орбіталі мають яку-небудь поверхню. Орбіталі – це не матеріальні об’єкти, які можна торкнутися руками, а тільки ділянки простору, в межах яких перебуває електрон.
4. Квантові числа
У квантовій механіці положення електрона в електронній оболонці характеризується кількома числами, що називаються квантовими числами.
Робота з таблицею
Для онайомлення з квантовими числами можна використати наступнісхеми
ІVУзагальнення і систематизація знань. Тестування
1. р-орбіталі мають форму
a) кулі;
б) гантелі;
в) еліпса.
2. Енергію орбіта лі визначає
a) головне квантове число;
б) орбітальне квантове число;
в) магнітне квантове число.
3. Сукупність орбіта лей з одним і тим самим значенням nназивають:
а) енергетичний рівень;
б) енергетичний підрівень;
в) енергетична під оболонка. Бесіда
1. Що називають атомною орбіталлю? Як пов’язана кожна атомна орбіталь з поняттям електронної хмари?
2. Які квантові числа визначають розмір, форму та орієнтацію електронної хмари?
3. Яке квантове число має однакове значення для електронів однго електронного шару?
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 10
Тема:Будова електронних оболонок атомів хімічних елементів 1-3 періодів. Електронні та графічні електронні формули атомів. Основний і збуджений стани атома.
Мета:.Розширити уявлення учнів про будову атомів. Навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів І—III періодів. Сформувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі. Формувати уявлення учнів про єдність природи матеріального світу
Основні поняття: електрон, орбіталь, енергетичний рівень, енергетична оболонка, електронний шар
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
ІОрганізаційний момент
ІІ Актуалізація і корекція опорних знань.
Фронтальне опитування Дайте визначення періоду. Які бувають періоди?
• Що таке група. На які підгрупи поділяється кожна група?
• Чому стан електрона в атомі не можна описати, опираючись на уявлення класичної механіки?
• Дайте визначення поняття «орбіталь», «енергетичний рівень», «енергетичний підрівень», «спін».
• Яку форму мають s і р-орбіталі?
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Правила заповнення електронних орбіталей
Розповідь вчителя
Оскільки підчас хімічних реакцій ядра атомів не змінюються, то хімічні властивості речовини зумовлені тільки будовою електронних оболонок атомів. Тому дуже важливо знати будову електронних оболонок атомів і на основі цього визначати властивості елементів.Стан кожного електрона можна описати набором з чотирьох квантових чисел, але для пояснення будови електронних оболонок атомів потрібно знати чотири основних положення:
1. принцип Паулі;
2. принцип найменшої енергії;
3. правило Хунда;
4. правило Клечковського.
Розглянемо будову електронних оболонок перших елементів і на їхньому прикладі обговоримо ці правила. Першою розглянему будову оболонки атома Гідрогену
Колективне обговорення
1. Скільки електронів знаходиться в електронній оболонці атома Гідрогену?
2. У якому періоді знаходиться Гідроген?
3. Скільки енергетичних рівнів є в електронній оболонці атома Гідрогену?
4. Скільки підрівнів знаходиться на першому рівні? Як позначається цей підрівень?
5. Зі скількох орбіталей складаєтся s- підрівень
Розповідь вчителя
На кожному енергетичному рівні може перебувати суворо визначена кількість електронів. Максимальна кількість електронів на кожному енергетичному рівні обчислюється за формулою N=2n2.(принцип Паулі). Найбільш стійкому стану електрона в атомі відповідає мінімальна енергія. Спочатку заповнюються рівні з найменшим значенням енергії. (принцип найменшої енергії)
Сумарне спінове число електронів певного підрівня повинно бути максимальним (правило Хунда).
Енергетичні підрівні заповнюються за збільшенням суми n+L(правило Клечковського)
Послідовність заповнення орбіталей електронами:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1s |
2s 2p |
3s 3p |
4s 3d 4 p |
5s 4d 5p |
6s 4f 5d 6p |
7s 5f 6d 7p |
VУзагальнення і систематизація знань.
1. Напишіть електронні конфігурації елементів: P, S, Zn, Se.
2. В якій послідовності заповнюються атомні орбіталі до утворення електронної оболонки атома Аргону? 3. В атомі якого елемента знаходиться 4 електронних шари і 6 електронів на зовнішньому енергетичному рівні?
4. Зобразити схему будови електронної оболонки атомів Na, CL, AL, N.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 11
Тема:Залежність властивостей елементів від періодичної зміни електронних структур атомів. Поняття про радіус атома, електронегативність.
Мета:Розглянути поняття «атомний радіус», «електронегативність»; установити залежність між цими характеристиками елемента та його положенням у періодичній системі; пояснити періодичне повторення властивостей хімічних елементів.
Основні поняття:атомний радіус, електронегатиність, періодичність.
Тип уроку:урок засвоєння нових знань.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Організаційний момент
ІІ Актуалізація і корекція опорних знань. Фронтальне опитування
1. Скільки енергетичних рівнів, мають атоми елементів з порядковим номерами: 13,27,35?
2. Атомуякогоелементавідповідаєкожназнаведенихформул:
1s22s22p63s23p2 , 1s22s22p63s23p5 , 1s22s22p63s23p64s1 , 1s22s22p63s23p63d14s2.
3. Встановіть відповідність між положенням елемента в періодичній системі та будовою атома:
|
|
|
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Сприймання й усвідомлення учнями фактичного матеріалу. 1. Атомний радіус. Залежність радіуса атома від положення у періодичній системі Розповідь вчителя
З попереднього урока, нам уже відомо, що у періодах по мірі зростання порядкового номера змінюється структура зовнішнього енергетичного рівня. Саме з цим пов’язана зміна властивостей елементів. Розглянемо деякі з них.
Радіус атома характеризує міжатомну відстань.
Бесіда
Як ви гадаєте, яке визначення можна дати для поняття радіус атома?
Розповідь вчителя
Атомний радіус дорівнює половині відстані між ядром атома і останнім енергетичним рівнем. У періодах радіус атома як правило зменшується, що пояснюється збільшенням електронів на зовнішньому енергетичному рівні. А у групах навпаки,радіус атома збільшується, тому, що збільшується кількість енергетичних рівнів. Зрозуміло, чим більший радіус атома, тим далі валентні електрони перебувають від ядра і тим слабше зв'язок з ядром, отже ці атоми легше віддають свої валентні електрони. Така структура характерна для елементів-металів.
2. Електронегативність. Зміна значення електронегативності у періодах і групах.
Розповідь вчителя
Відносна легкість відривання електронів від атома є основною характеристикою металічних елементів. Атоми металів легко віддають електони зовнішнього енергетичного рівня (валентні) і не можуть приєднувати їх для завершення свого зовнішнього енергетичного рівня. Тому говорячи про електронегативність ми говоримо, що вона характерна для неметалічних елементів. Отже,електронегативність – здатність атомів приєднувати спільну електронну пару. Чим більше значення електронегативності елемента, тим яскравіше у нього виявляються неметалічні властивості. Як приклад давайте розглянемо значення електронегативності для елементів другого періоду (за шкалою Полінга)
|
Li |
Be |
B |
C |
N |
O |
F |
|
0,98 |
1,57 |
2,09 |
2,55 |
3,04 |
3,44 |
3,98 |
А тепер розглянемо значення ектронегативності для елементів першої групи головної підгрупи
|
H |
Li |
Na |
K |
Rb |
Cs |
|
2,20 |
0,98 |
0,93 |
0,82 |
0,82 |
0,79 |
Як бачимо у періодах електронегативність елементів збільшується, а у підгрупах зі зростанням порядкового номера навпаки зменшується.
VУзагальнення і систематизація знань.
Робота з таблицею
Учні разом з учителем заповнюють і аналізують таблицю
Закономірність зміни властивостей елементів у періодичній системі
|
Властивості |
Зміна властивостей зі збільшенням порядкового номера |
||
|
Період |
Головні підгрупи |
Побічні підгрупи |
|
|
Металічні властивості |
|
|
|
|
Неметалічні властивості |
|
|
|
|
Радіус атома |
|
|
|
|
Електронегативність |
|
|
|
Завдання
1) В якого з атомів радіус атома найбільший : Mg, Si, S, Cl?
2) Який з елементів виявляє найбільшу електронегативність: N, Br, F, O?
3) В якого елемента - Кальцію чи Барію - зв'язок валентного електрона з ядром сильніший? Поясніть чому.
VІ Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 12
Тема: Взаємозв'язок між положенням елементів у періодичній системі та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном і Оксигеном
Мета: Розширити знання про взаємозв'язок між положенням хімічних елементів у періодичній системі, будовою їхніх атомів та їх фізичними й хімічними властивостями. Показати залежність між положенням хімічного елемента в періодичній системі хімічних елементів і складом, будовою і властивостями простих речовин, утворених цими елементами, складом, будовою і властивостями сполук цих елементів з Гідрогеном і Оксигеном.
Основні поняття: періодичність, атом, металічні елементи, неметалічні елементи, оксиди.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти, продуктивної творчості.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Організаційний етап.
ІІ Актуалізація і корекція опорних знань.
1. Що таке радіус атома? Як він змінюється у групі, періоді?
2. Що таке електронегативність?
3. Як змінюється електронегативність зі зростанням порядкового номера у групі, періоді?
Хімічний диктант
1. Назвіть елемент ІІ періоду, що має на зовнішньому енергетичному рівні три електрони.
2. Назвіть елемент ІІ групи у якого останнім заповненим електронами енергетичний рівень – третій.
3. Назвіть елемент, у якого на четвертому енергетичному рівні знаходиться один електрон.
4. Назвіть елемент, у якого на другому енергетичному рівні знаходиться три електрони
5. Назвіть елемент другого періоду, що має завершений зовнішній енергетичний рівень
6. Назвіть елемент головної підгрупи ІІІ групи, що має три енергетичних рівні.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІV Сприймання й усвідомлення учнями фактичного матеріалу.
1.Зміна металічних і неметалічних властивостей елементів.
Металічний або неметалічний характер елемента залежить від електронної будови його атома. Для прикладу розглянемо елементи другої групи. Зверніть увагу як закономірно змінюється конфігурація їх атомів.
Li Be B C N O F Ne
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
В атомах від Літію до Бору на зовнішньому енергетичному рівні кількість електронів від 1 до 3. Радіус атома зменшується. Отже зв'язок електроннів на зовнішньому енергетичному рівні з ядром поступово посилюється. А це означає, що здатність віддавати електрони (металічні властивості) поступово послаблюються від Літію до Бору. Неметалічні властивості ж навпаки посилюються від Карбону до Нітрогену і Оксигену. Найяскравіше вони варажені у Флору – галогену. Це пояснюється зменшенням радіуса атома через збільшення електронів на зовнішньому енергетичному рівні. А це означає, що неметалічні властивості посилюються.Завершується другий період Неоном, який повторює головним чином властивості Гелію. Тому під час переходу до наступного періоду властивості елементів різко змінюються, і 3 період починається лужними металом Натрієм, який має схожі властивості з Літієм.
2.Зміна властивостей сполук елементів з Гідрогеном та Оксигеном Робота з підручником.
VУзагальнення і систематизація знань
Тренувальні вправи ( робота в парах)
Завданн 1. Складіть формули вищих оксидів, сполук з Гідрогеном для таких елементів : Натрій, Фосфор, Бор, Хлор. Для оксидів розрахуйте масові частки Оксигену. Завдання 2. Порівняйте металічні та неметалічні властивості в парах елементів
1. Натрій і Рубідій;
2. Сульфур та Телур.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 13
Тема:Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома.
Мета:Закріпити знання учнів про будову атома. Формувати вміння й навички характеризувати елементи за положенням хімічних елементів у періодичній системі й будовою атома.
Основні поняття:хімічний елемент, атом, ядро, електрон, протон, енергетичний рівень.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти, Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: Періодична система хімічних елементів Д.І.Менделєєва; таблиця відносних електронегативностей.
Хід уроку
І Організаційнй момент.
ІІ Актуалізація і корекція опорних знань. Бесіда
1. Розкрийте фізичну суть порядкового номера хімічного елемента, номера групи, періоду.
2. Як змінюються властивості елементів у періодах і групах? Наведіть приклади.
ІІІ Повідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. План характеристики елемента за його положенням в періодичній системі та будовою атома
Для складання характеристики хімічного елементиа за положенням у періодичній системі та будовою атома доцільно використовувати наступний план
План характеристики елемента за його положенням у періодичній системі:
І. Назва елемента, його символ, атомна маса
ІІ. Положення у періодичній системі
1. порядковий номер;
2. номер періоду;
3. номер групи; підгрупа.
ІІІ. Будова атома:
1. заряд ядра;
2. кількість електронів, протонів, нейтронів;
3. електронна формула, коміркова структура зовнішнього шару;
4. кількість електронних рівнів;
5. кількість електронів на зовнішньому енергетичному рівні, скільки електронів не вистачає до завершення.
ІV. Метал чи неметал властивості простої речовини: взаємодія металів і неметалів з киснем
V. Вищий оксид
Формула, характер оксиду (основний, кислотний), взаємодія з водою. VI. Сполука з Гідрогеном
Для металів: метали головних підгруп утворюють гідриди, нелеткі сполуки,метали побічних підгруп не утворюють.
Для неметалів: неметали V, VІ груп утворюють леткі сполуки; VI.І. Порівняльна характеристика властивостей з елементами в підгрупі.
VI.ІІ. Порівняльна характеристика властивостей з елементами в періоді.
VОсмислення зв'язків і залежностей між елементами вивченого матеріалу Розповідь учителя
Виходячи із запропонованого плану, можна розглянути властивості s-, p- і d- елементів.
VІУзагальнення і систематизація знань.
Завдання
Охарактеризувати за положенням в періодичній системі та будовою атома хімічні елементи з порядковим номером 11 та 15.
VІІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 14
Тема:Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома.
Мета:Закріпити вміння й навички характеризувати елементи за положенням хімічних елементів у періодичній системі й будовою атома.
Основні поняття: хімічна формула,індекс, коефіцієнт, якісний і кількісний склад речовини.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань, умінь і навичок.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І. Організаційний момент
ІІПеревірка домашнього завдання.
1. Двоє учнів біля дошки виконують завдання. Дати характеристику за положенням у періодичній системі Сульфуру, Кальцію .
2. Назвіть чотири елементи, в яких неметалічні властивості краще виражені ніж у Брому?
3. Назвіть три метали активніші за Алюміній?
4. Складіть формули води з атомів ізотопів Гідрогену й Оксисену.
Розташуйте їх у порядку збільшення молекулярної маси..
ІІІ Використання знань, умінь і навичок для виконання тренувальних вправ.
Учні об’єднуються в групи і одержують аналогічні завдання.
1. Розвʼязати задачу за запропонованими даними.
2. Дати характеристику елемента за положенням у періодичній системі.
3. Напишіть електронну формулу йона, утвореного цим атомом.
Приклади задач для груп учнів
1. Назвіть елемент, вищий оксид якого відповідає формулі Е2О7 , утворює з Гідрогеном газоподібну сполуку, в якій масова частка Гідрогену дорівнює 2,73 %.
2. Назвіть елемент, вищий оксид якого Е2О5 , утворює з Гідрогеном сполуку, масова частка Гідрогену в якій становить 17,6 % .
3. Масова частка Оксигену в оксиді елемента становить 60%. Визначте цей елемент, якщо відомо, що він утворює з Гідрогеном сполуку ЕН2..
4. Визначте відносну атомну масу елемента ІV групи, у вищому оксиді якого масова частка Оксигену становить 21,19 %.
5. Визначте відносну атомну масу елемента ІІ групи, у хлориді якого масова частка Хлору становить 74,73 %.
Групи виконують завдання, після закінчення роботи учні зачитують і наводять на дошці результати, які за необхідності доповнюються і виправляються.
ІVПідсумки уроку
Учитель підбиває підсумки уроку, оцінює роботу груп.
V.Домашнє завдання
Повторити §. Виконати вправу (с. підручника).
Урок 15
Тема:Значення періодичного закону.
Мета: Розкрити роль періодичного закону як фундаментального закону природи, доказу єдності матеріального світу, показати його значення для розвитку природничих дисциплін, у тому числі хімії.
Основні поняття: Періодичний закон, періодична система
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,.
Тип уроку:урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
ІОрганізаційний момент
ІІ Актуалізація і корекція опорних знань.
Індивідуальні завдання (виконуються біля дошки)
Два учні дають характеристику елемента за положенням у періодичній системі та будовою атома (на розсуд вчителя)
Бесіда
1. Ким і коли був відкритий періодичний закон?
2. Чим відрізняється сучасне формулювання періодичного закону від формулювання запропонованого Менделєєвим?
3. Що є графічним вираженням періодичного закону?
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Практичне значення періодичного закону. Розповідь учителя
Розкриваючи перше питання, необхідно розповісти про виправлення відносних атомних мас деяких елементів, про передбачення елементів, про уточнення положення елементів у зв’язку з виправленням відносних атомних мас.
Бесіда
Які хімічні елементи з передбачуваними властивостями були передвіщені
Д.І.Менделєєвим
Розповідь учителя про відкриття Скандію, Галію і Германію. Синтез Технецію, Прометію,Астату і Францію. Після чого всі вільні місця у природному ряду були заповненні, що стало тріумфом періодичного закону.
2. Значення періодичного закону для розвитку науки
Розповідь вчителя
Ще за часів Менделєєва висловлювалось припущення прозвʼязок між деякими фізичними явищами (електричних, магнітних, оптичних) з будовою атома. Відкриття періодичного закону дало могутній поштовх розвитку робіт із вивчення будови атома.В результаті чого був відкритий взаємозв’язок будови атома із періодичною зміною їхніх властивостей. Таким чином, вчення про періодичність хімічних елементів набуло теоретичного обґрунтування.
3. Значення періодичного закону на сучасному етапі розвитку науки.
Розкриваючи ці питання можна розповісти про відкриття інертних газів та інших нових елементів про добування нових сполук, хімічних елементів (ядерна фізика), про місцезнаходження корисних копалин (геохімія, геологія).Періодична система елементів Д.І.Менделєєва належить до найважливіших інструментаріїв хімічної освіти.
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 16
Тема:Контрольна робота з теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома».
Мета:Узагальнити й систематизувати знання учнів з теми «Періодичний закон і періодична система хімічних елементів Д. і. Менделєєва. Будова атома». Визначити рівень навчальних досягнень учнів з теми «Періодичний закон і періодична система хімічних елементів Д. 1. Менделєєва. Будова атома».
Основні поняття: Періодичний закон, хімічний елемент, період, група, порядковий номер, електронна формула.
Формування компетентностей: Загальнопредметна, комунікативна, інформаційна., саморозвитку та самоосвіти,продуктивної творчості.
Тип уроку:урок узагальнення і систематизації знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Організаційний момент
ІІ Письмова контрольна робота
Учитель розподіляє варіанти, робить настанови, щодо виконання контрольної роботи.
Пропонуємо зміст одного варіанту контрольної роботи
Періодичний закон і періодична система. Будова атома
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 клас. Періодичний закон і періодична система. Будова атома |
1 – 16 |
0,5 |
40хв. |
|
17 - 18 |
1 |
||
|
19 |
2 |
8 кл. ПЗ і ПС. Будова атома Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть від чого перебувають у періодичній залежності властивості елементів та їх сполук відповідно до сучасних уявлень про будову атома:
А атомних ваг; В заряду ядра;
Б кількості нейтронів; Г порядкового номеру;
2 Вкажіть як називається простір навколо ядра в якому найімовірніше перебуває електрон:
А атом; Б ядро; В радіус; Г орбіталь
3 Вкажіть чому дорівнює кількість електронів у атомі:
А номеру групи; Вномеру періоду;
Бкількості протонів; Гкількості нейтронів
4 Вкажіть форму орбіталі s-електронів:
А кільце; Б гантель; В метелик; Г сфера
5 Вкажіть частинку із зарядом +1 та масою 1:
А протон; Б електрон; В нейтрон; Г катіон
6 Вкажіть загальну формулу вищого оксиду для елемента I групи:
А R2O3; Б RO2; В R2O; Г RO4
7 Вкажіть за кількістю яких частинок розрізняються ізотопи:
А нейтронів; Б електронів; В аніонів; Г протонів
8 Вкажіть кількість валентних електронів у атома Кальцію:
А 4; Б 2; В 3; Г 1
9 Вкажіть кількість енергетичних рівнів у атома елемента з порядковим номером 28:
А 4; Б 5; В 3; Г2
10 Вкажіть елемент, що утворює летку водневу сполуку типу НЕ:
А Li; Б Br; В As; Г S
Виберіть кілька правильних відповідей
11 Випишіть порядкові номери елементів, що належать до одного періоду:
А 52; Б 38; В 34; Г 55
12 Вкажіть елементи побічних підгруп:
А 24; Б 19; В 32; Г 47
13 Випишіть групу елементів, що мають однакову кількість електронів на зовнішньому енергетичному рівні:
А 24, 8, 37; Б 88, 38, 20; В 51, 83, 15; Г 53, 17, 9
14 Запишіть елементи в порядку зростання металічних властивостей:
А P; Б Na; В Cl; Г Al
15 Встановіть відповідність між електронними формулами та елементами:
Електронна формула елемента Хімічний елемент
|
1 |
|
|
2 |
|
|
3 |
|
1. 1s22s22p63s23p64s23d104p6; А S;
2. 1s22s22p63s23p4; Б Kr;
3. 1s22s22p63s23p64s23d2; В F;
Г Ti
16 Запишіть нуклід для Стронцію
17 Поясніть у якого елемента більш виражені металічні властивості:
А 34; Б 56
18 Запишіть положення Мангану у ПС 19 Визначте елемент, що знаходиться в головній підгрупі V групи. Відносна молекулярна маса його вищого оксиду дорівнює 230. Запишіть електронну формулу даного елемента.
А також бланк картки відповідей
Картка відповідей ПЗ і ПС. Будова атома
|
П.І. ____________________ Варіант № __ Клас ________ Дата ____________
16 _______________________________ ___ 17
|
П.І. ____________________ Варіант № __ Клас ________ Дата ____________
16 _______________________________ ___ 17
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
VІІПідсумки уроку;повідомлення домашнього завдання.
Підготувати повідомлення про життя і діяльність Д.І.Менделєєва
Урок 17
Тема: Життя і діяльність Д.І.Менделєєва
Мета:Ознайомитися з життям і діяльністю російського вченого-хіміка Д.І. Менделєєва.
Тип уроку:узагальнення і систематизація знань.
Формування компетентностей: Соціальної, продуктивної творчості.
І Організаційний етап
ІІ Аналіз контрольної роботи
Робота з класом з пояснення типових помилок, індивідуальною роботою над помилкаи.
Семінар «Життя і діяльність Д.І.Менделєєва
На дошці написаний девіз уроку
«Розмова й слова потрібні, але вони лише початок… Уся суть життя у справах!»Д. І. Менделєєв
1. Вступне слово вчителя
1 березня 2017 року виповниться 148 років від дня відкриття
Д.І.Менделеєєвим періодичного закону. Відкриттю передувала важка та напружена праця на протязі 15 років, та на подальше його поглиблення пішло ще 25 років.
Попередники Менделєєва зробили багато для підготовки вікриття періодичного закону. Але жоден з них не наважився на підставі побаченої періодичності передбачити нові хімічні елементи. Для них періодичність була лише способом класифікації, вони не побачили в ній фундаментального закону природи. Пусть зимний день с метелями Не навевает грусть. Таблицу Менделеева
Я знаю наизусть.
Зачем ее я выучил?
Могу сказать зачем.
В ней стройность и величие Любимейших поэм!
Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного.
В ней пробужденье дерева,
И вешних льдинок хруст…
Таблицу Менделеева Я знаю наизусть!
2. Виступ учнів про життя і діяльність Менделєєва
3. Заключне слово вчителя
Цей закон і тепер через багато років, залишається одним із найважливіших законів хімії. Він об’єднує всі явища, що відбуваються у природі, підтверджує загальні закони розвитку природи:
• закон переходу кількості у якість;
• закон єдності й боротьби протилежностей;
• закон заперечення запереченя
Завершуємо урок словами Д. І. Менделєєва:
«Періодичному закону майбутнє не загрожує руйнуванням, а тільки надбудову і розвиток обіцяє».
ІІІ. Домашнє завдання
Урок 18
Тема:Природа хімічного зв’язку. Електронегативність елементів.
Мета:Ознайомити учнів із причинами виникнення хімічного зв'язку між атомами в процесі утворення простих і складних речовин, типами хімічного зв'язку. Розкрити зміст поняття «електронегативність» та його застосування для визначення типу хімічного зв'язку. Поглибити знання про періодичний закон і будову атома на прикладі утворення хімічного зв'язку між атомами різних хімічних елементів.
Основні поняття: хімічний звʼязок, електронегативність.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва
Хід уроку
І Актуалізація і корекція опорних знань.
1. Назвітьхімічніелементи періодичної системи, що мають завершений зовнішній енергетичний рівень.
2. Наведіть приклади хімічних елементів з незавершеним зовнішнім енергетичним рівнем.
3. За якими властивостями відрізняються елементиіз завершеним і незавершеним зовнішнім енергетичним рівнем?
4. Наведіть приклади елементів-металів.
5. Наведіть приклади елементів-неметалів.
6. Чим відрізняється будова зовнішнього енергетичного рівня в елементів металів і неметалів?
7. Наведіть приклади s-елементів, p-елементів, d-елементів, f-елементів.
ІІ Мотивування учіння.
У природі рідко коли можна зустріти атоми у вільному стані. Найчастіше вони утворюють велику кількість сполук з іншими атомами. Причина стійкості молекул полягає в тому, що між сполученими атомами в молекулі виникає хімічний зв'язок, в утворенні якого головну роль відіграють електрони зовнішнього рівня.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Однозначно встановлено, що будь-який хімічний зв’язок має електричну природу. Це означає, що при його утворенні найбільш суттєву роль відіграють сили взаємодії між електричними зарядами, носіями яких є негативно заряджені електрони й позитивно заряджені ядра атомів. Суть взаємодії полягає у відштовхуванні одноіменно заряджених частинок (ядроядро, електрон-електрон) і притяганні різноіменно заряджених (ядроелектрон).
Зрозуміло, що система буде стійкою, якщо сили притягання переважають над силами відштовхування
Основна причина утворення зв'язку між атомами — їх прагнення утворити стійку електронну конфігурацію зовнішнього енергетичного рівня. Таким рівнем можна вважати восьми-електронний завершенийрівень ns2np6, наприклад у інертних елементів. Завершений рівень характеризується високою міцністю і стійкістю. У процесі хімічної взаємодії атоми прагнуть перетворити зовнішній енергетичний рівень так, щоб він став завершеним.
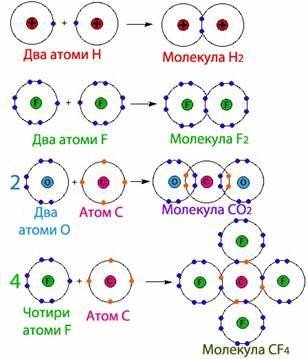
У процесі утворення хімічного зв'язку атоми перебудовують зовнішній енергетичний рівень. При цьому атоми можуть віддавати або приєднувати (частково чи повністю) електрони зовнішнього енергетичного рівня. Учення про будову атомів пояснює механізм утворення молекул простих і складних речовин, а також природу хімічного зв'язку. Кількісно здатність притягувати електрони зовнішнього енергетичного рівня інших атомів вимірюється поняттям електронегативності.
• Який елемент має найбільшу електронегативність?
• Який елемент має найменшу електронегативність?
• В яких елементів — металів чи неметалів — електронегативність менша?
За допомогою таблиці електронегативностей розглянемо можливі схеми перетворення зовнішнього енергетичного рівня в металів і неметалів.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Побудуємо електронну формулу Натрію. Це метал, може лише віддавати електрони.
![]() +11)2)8)1 1s2
2s2 2p6 3s1
+11)2)8)1 1s2
2s2 2p6 3s1
Охарактеризуємо зовнішній рівень атома Натрію: незавершений, один неспарений електрон. Атом Натрію легко може віддати один електрон, при цьому змінюється електронна формула:
![]() +11)2)8 1s2
2s2 2p6
+11)2)8 1s2
2s2 2p6
Зовнішній енергетичний рівень перетворюється на завершений (як в атома Неону, але атом стає зарядженою частинкою — позитивним йоном).
Аналогічно розглядаємо схеми будови атома Магнію та йона Магнію.
![]()
![]() +12)2)8 1s2 2s2
2p6
+12)2)8 1s2 2s2
2p6
У йона Магнію зовнішній рівень завершений, як в атома Неону. Розглянемо атом Флуору. Це найсильніший неметал, має найвищу електронегативність, може лише приєднувати електрони.
![]() +9)2)71s2
2s2 2p5
+9)2)71s2
2s2 2p5
Незавершений сьомий електронний зовнішній рівень Флуору перетворюється на завершений, як в атома Неону.
![]() +9)2)81s2
2s2 2p6
+9)2)81s2
2s2 2p6
Пропонуємо учням самостійно записати будову атома й електронні формули атома та йона Оксигену.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 19
Тема:Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок. Електронні формули молекул.
Мета:Ознайомити учнів із принципами утворення ковалентного неполярного й полярного зв'язку. Сформувати навички складання електронних формул речовин.
Основні поняття: хімічний звʼязок, електронегативність, ковалентний полярний і ковалентний неполярний звʼязок.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
•У чому причина утворення хімічного зв'язку між атомами?
•Чому атоми різних елементів утримуються один біля одного?
•Чому можливе утворення хімічного зв'язку і між атомами однакових, і між атомами різних хімічних елементів?
ІІ Мотивування учіння.
Після відкриття електрона проводилося багато спроб розробити електронну теорію хімічного зв’язку. Найбільш вдалими стали роботи Льюїса (1916р.), який запропонував розглядати утворення зв’язку як наслідок виникнення спільних для двох атомів електронних пар (рис. 1). Для цього кожний атом надає однакову кількість електронів і намагається оточити себе октетом або дублетом електронів, характерним для зовнішньої електронної конфігурації інертних газів. Графічно за методом Льюїса утворення ковалентних зв’язків за рахунок неспарених електронів подають за допомогою точок, які позначають зовнішні електрони атома (рис. 2).
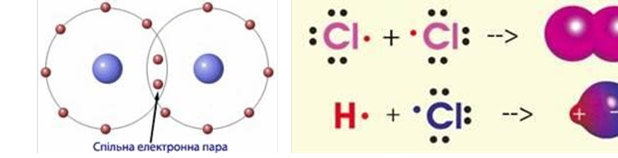
Клікніть і тягніть для зауажень Клікніть і тягніть для зауважень
Рисунок 1 – Спрощена модель Рисунок 2 – Утворення ковалентного зв’язку
виникнення спільної відповідно до теорії Льюїса електронної пари при утворення ковалентного зв’язку
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Ковалентний зв’язок – найпоширеніший тип хімічного зв’язку, що здійснюється при взаємодії атомів елементів з однаковими або близькими значеннями електронегативності.
Ковалентний зв’язок – це зв’язок атомів за допомогою спільних електронних пар.
Основною ознакою ковалентного зв’язку є наявність спільної електронної пари, яка належить обом хімічно сполученим атомам, оскільки перебування двох електронів у полі дії двох ядер енергетично вигідніше, ніж знаходження кожного електрона у полі свого ядра.
За обмінним механізмом утворення ковалентного зв’язку кожний із взаємодіючих атомів постачає на утворення зв’язку однакову кількість електронів з антипаралельними спінами (рис. 3). Наприклад:
![]()
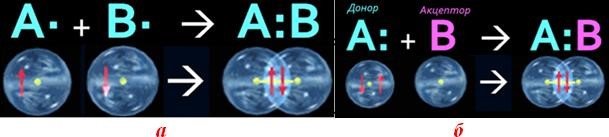
Рисунок 3 – Загальна схема утворення ковалентного зв’язку: а) за обмінним механізмом; б) за донорно-акцепторним механізмом
За донорно-акцепторним механізмом зв’язок виникає при взаємодії різних частинок. Одна з них – донор А: має неподілену пару електронів А: (тобто таку, що належить тільки одному атому), а іншаакцептор В□ – має вакантну орбіталь (рис. 3б).
Частинка, яка надає для зв’язку двохелектронну хмару (неподілену пару електронів), називається донор, а частинка з вільною орбіталлю, яка приймає цю електронну пару, – акцептор.
Механізм утворення ковалентного зв’язку за рахунок двохелектронної хмари одного атома та вакантної орбіталі іншого називається донорноакцепторний механізм.
Залежно від розміщення електронної густини у між’ядерному просторі розрізняють полярний і неполярний ковалентні зв’язки.
Неполярнийзв’язок називається такий зв’язок, при якому спільна електронна хмара розміщується симетрично відносно ядер сполучених атомів і однаковою мірою належить обом атомам.
Молекули з таким типом зв’язку називаються неполярними(тобто такими, до складу яких входять атоми одного елемента). Неполярний зв’язок виявляється як правило в гомоядерних молекулах (Н2, Cl2, N2 тощо) чи – значно рідше – у сполуках, утворених атомами елементів з близькими значеннями електронегативності, наприклад, карборунд SiC.
Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
![]()
У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним. Розглянь, наприклад, схему утворення подвійного ковалентного зв'язку в молекулі киснюО2і потрійного ковалентного зв'язку в молекулі азоту N2:
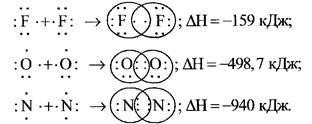
Одинарний зв'язок зображується однією рискою (штрихом), подвійний - двома, потрійний - трьома. Риска між двома атомами показує, що у них пара електронів узагальнена, унаслідок чого і утворився хімічний зв'язок. За допомогою таких рисок зображують структурні формули молекул. F – F (одинарний зв'язок); О = О (подвійний зв'язок); N≡N (потрійний зв'язок).
Потрійний зв'язок міцніший, ніж подвійний і первинний (одинарний). Тому молекула азоту є міцнішою, ніж молекула кисню або водню, чим зумовлена значна інертність азоту у хімічних реакціях.
Полярнийзв’язок називається зв’язок, при якому спільна електронна хмара несиметрична і зміщена до одного з атомів.
Молекули з полярним зв’язком називаються полярними. У молекулах з полярним зв’язком узагальнена електронна пара зміщується у бік атома з більшою електронегативністю. У результаті на цьому атомі виникає деякий частковий негативний заряд (δ−), який називається ефективним, а у атома з меншою електронегативністю – однаковий за величиною, але протилежний за знаком частковий позитивний заряд (δ+). Наприклад, експериментально встановлено, що ефективний заряд на атомі Гідрогену в молекулі гідрогенхлориду HCl δH=+0,17, а на атомі Хлору δCl=−0,17 абсолютного заряду електрона.
Щоб визначити, у який бік буде зміщуватися електронна густина полярного ковалентного зв’язку, необхідно порівняти електронегативність обох атомів. За зростанням електронегативності найбільш поширені хімічні елементи розміщуються у такій послідовності:
Rb, K, Na, Li, Ca, Mg, Be, In, Al, Sr, Ga, Sb, Si, B, As, H, Te, P, C, Se, I, S, Br, Cl, N, O, F.
![]()
Підвищення електронегативності
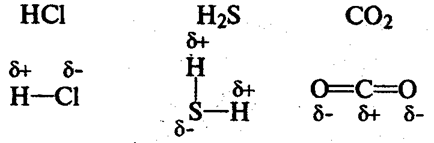
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Серед запропонованих формул вибери формулу речовини з ковалентним неполярним типом зв’язку, поясни механізм його утворення: а) CuCI2;
б) CI2;
в) HCI.
2. Серед запропонованих формул вибери формулу речовини з ковалентним полярним типом зв’язку, поясни механізм його утворення. а) Br2;
б) FeBr3;
в) HBr.
3. Яким типом зв’язку утворена молекула кисню? Поясни механізм його утворення використовуючи електронно-крапкові формули.
4. Яким типом зв’язку утворена молекула вуглекислого газу? Поясни механізм його утворення використовуючи електронно-крапкові формули.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 20
Тема:Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок. Електронні формули молекул.
Мета:Закріпити знання учнів про принципи утворення ковалентного неполярного й полярного зв'язку. Продовжити формувати навички складання електронних формул речовин. Розвивати навички написання електронних формул речовин, уміння визначати вид хімічних зв'язків у молекулах за будовою атомів, що утворюють цю молекулу.
Основні поняття: хімічний звʼязок, електронегативність, ковалентний полярний і ковалентний неполярний звʼязок.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: Урок застосування знань,навичок і умінь,творчого застосування їх на практиці
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
• Що таке хімічнийзвʼязок?
• За рахунок чого утворюється ковалентнийзвʼязок?
• Чим відрізняєтьсяковалентний полярний і ковалентний неполярний звʼязок?
• Як визначити, у який бік буде зміщуватися електронна густина полярного ковалентного зв’язку?
ІІ Повідомлення теми, цілей і завдань уроку
ІІІ Осмислення змісту й послідовності застосування способів виконання дій
1 Вкажіть зв’язок, що утворюється за рахунок спільної пари електронів, розташованої на однаковій відстані від обох атомів:
А йонний; В ковалентний полярний;
Б ковалентний неполярний; Г металічний
2 Вкажіть кількість електронів на зовнішньому енергетичному рівні у Карбону:
А 5; Б 7; В 4; Г 2
3 Вкажіть речовину з ковалентним полярним типом зв’язку:
А H2; Б; Li2O В PH3; Г S8
4 Запишіть схему утворення зв’язку між атомами у сполуках
А H2S; Б SiH4.
5 Розставте речовини у порядку зменшення полярності зв’язку
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
А K2Se;
Б K2O;
В K2S; Г KF
ІVСамостійне виконання учнями завдань під контролем і за допомогою вчителя
1. У якій з перерахованих сполук полярність зв’язку найменша:CO2,NO2,OF2? Чому?
2. Склади формули сполук Сульфуру з: Оксигеном, Гідрогеном. Вкажи типи зв’язку та поясни механізми їх утворення.
3. Розташуй сполуки у порядку зростання полярності зв’язку: SiO2 , CO2 , P2O5 , N2O5 , SO2 .
4. Розташуй сполуки у порядку зменшення полярності зв’язку CI2 , HCI,PCI5.Складіть схеми утворення.
5. Складіть структурні і електронні формули сполук з фосфором:
а)гідрогену; б) хлору; в) бору.
6. Поясніть, за рахунок електронів якого енергетичного рівня утворюється зв'язок між атомами у ковалентних сполуках: Н2; СІ2; О2; N2. Складіть схеми утворення.
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 21
Тема:Йони. Йонний зв’язок, його утворення.
Мета:Розширити знання учнів про будову атомів металів і неметалів на прикладі утворення йонів. Ознайомити учнів з механізмом утворення йонного зв'язку. Розвивати навички складання електронних формул. Основні поняття: хімічний звʼязок, йони, йонний зв’язок, ступінь окиснення.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
• Що таке хімічнийзвʼязок?
• За рахунок чого утворюється ковалентнийзвʼязок?
• Чим відрізняєтьсяковалентний полярний і ковалентний неполярний звʼязок?
• Що таке електронегативність?
• Як визначити, у який бік буде зміщуватися електронна густина полярного ковалентного зв’язку?
ІІ Мотивування учіння.
• Який зв’язок утворюється тоді, коли електронегативності елементів різко відрізняються між собою ?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Йонний зв’язок виявляється тоді, коли електронегативності елементів різко відрізняються між собою (Δχ>1,7), а це відбувається при взаємодії йонів, утворених з атомів елементів, що характеризуються суттєво відмінними хімічними властивостями.
Іонний зв’язок – це електростатичне притягання між різнойменно зарядженими йонами, що утворені внаслідок повного зміщення спільної електронної пари від атома одного елемента до атома іншого елемента. Залежно від індивідуальних властивостей у атомів одних елементів переважає тенденція до утрати електронів з перетворенням у позитивно заряджені йони (катіони), а атоми інших елементів, навпаки, прагнуть набути електрони, перетворюючись при цьому в негативно заряджені йони (аніони), як це відбувається з атомами типового металу натрію і типового неметалу хлору (рис. 1).
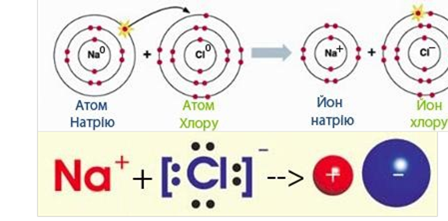
Рисунок 1 – Умовна модель утворення йонів Na+ і Cl– шляхом повного передавання валентного електрона від атома натрію атому хлору
2Na + Сl2 = 2NaCl
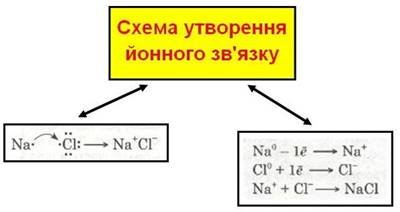
Здатність елементів утворювати прості йони (тобто такі, що походять від одного атома) зумовлена електронною конфігурацією їх атомів.
Зрозуміло, що найлегше катіони утворюються атомами елементів з малими енергіями іонізації – лужними і лужноземельними металами (Na, К, Cs, Rb, Ca, Ba, Sr тощо).
Прості аніони найлегше утворюються р-елементами сьомої групи (Cl, Br, I) внаслідок їх високої спорідненості до електрона.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Серед запропонованих формул вибери формулу речовини з йонним типом зв’язку пояснити механізм його утворення: а) F2;
б) OF2;
в) NaF.
2. Склади формулу сполуки Сульфуру зЦинком. Вкажи тип зв’язку та поясни механізми їх утворення.
3. Склади електронні формули сполук утворених елементами з порядковими номерами:
а) 12 та 17; б) 19 та 35;
в) 11 та 1; г) 16 та 8.
Вкажи тип зв’язку у кожній сполуці.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 22
Тема:Йонний зв’язок, його утворення.
Мета:Продовжити розвивати навички складання електронних формул.
Основні поняття: хімічний звʼязок, йони, йонний зв’язок, ступінь окиснення.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: Урок застосування знань,навичок і умінь,творчого застосування їх на практиці.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
• Що таке хімічнийзвʼязок?
• Які типизвʼязків вам відомі?
• За рахунок чого утворюється йоннийзвʼязок?
• Чим відрізняються катіони і аніони? Як вони утворюються?
ІІ Повідомлення теми, цілей і завдань уроку
ІІІ Осмислення змісту й послідовності застосування способів виконання дій
1 Вкажіть речовину з йонним типом зв’язку:
АFeCl2; БN2О; В Cl2; ГCаF2
2 Виберіть твердження, щодо йонного зв’язку:
А зв’язок утворюється за рахунок спільної електронної пари;
Б передавання електронної густини від одного атома до другого;
В зв’язок ґрунтується на електронному механізмі;
Г передавання електронів від одного атома до другого
3 Виберіть формули речовин з йонним типом зв’язку:
А Na3N; Б HCl; В BaO; Г N2O
4 Встановіть відповідність між електронною формулою та катіоном:
Електронна формула Катіон
|
1 |
|
|
2 |
|
|
3 |
|
1 1s22s22p63s23p6; А N 3+;
2 1s22s22p6; Б N2+;
3 1s22s2; В Ca2+;
Г Al3+
5 Запишіть схему утворення зв’язку між атомами у сполуках
А Li2S; Б AlCl3.
ІVСамостійне виконання учнями завдань під контролем і за допомогою вчителя
1. Серед запропонованих формул вибери формулу речовини з йонним типом зв’язку пояснити механізм його утворення: а) F2;
б) OF2;
в) NaF.
2. Серед запропонованих формул вибери формулу речовини з йонним типом зв’язку , поясни механізм його утворення:
а) CuCI2;
б) CI2;
в) HCI.
3. Серед запропонованих формул вибери формулу речовини з йонним типом зв’язку , поясни механізм його утворення.
а) Br2;
б) FeBr3;
в) HBr.
4. Склади формулу сполуки Сульфуру зЦинком. Вкажи тип зв’язку та поясни механізми їх утворення.
5. Атом хімічного елемента має на 6 електронів менше ніж атом Магнію. Назвіть елемент. Напишіть електронну формулу атома та йоннів які він може утворити. Складіть схему утворення хімічного зв’язку цього елемента з Алюмінієм.
6. Атом хімічного елемента має на 5 електронів більше ніж йон Алюмінію. Назвіть елемент. Напишіть електронну формулу атома та йонів які він може утворити.Складіть схему утворення хімічного зв’язку цього елемента з Кальцієм.
7. Атом хімічного елемента має на 2 електрони більше ніж йон Оксигену. Назвіть елемент. Напишіть електронну формулу атома та йонів які він може утворити.Складіть схему утворення хімічного зв’язку цього елемента з Нітрогеном.
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 23
Тема:Ступінь окиснення.
Мета:Дати уявлення про ступінь окиснення, розділити поняття «валентність» і «ступінь окиснення». Сформувати навички визначення ступеня окиснення в сполуках за формулою, а також за будовою атомів, які утворюють ці сполуки.
Основні поняття: хімічний звʼязок, йони, йонний зв’язок, ступінь окиснення, валентність.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
• Які види хімічних звʼязків вам відомі?
• Який вид хімічногозвʼязку називається ковалентним?
• Який вид хімічногозвʼязку називається йонним?
• Які частинки називаються йонами?
• Як вони утворюються?
• Що таке електронегативність?
• Як змінюється електронегативність у періодах і групах періодичної системи? Чому?
ІІ Мотивування учіння.
• Що таке валентність?
• Чи має валентність знак?
• Чи можна поняття валентність застосовувати до речовин немолекулярної будови?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
У наш час валентність визначається числом ковалентних зв'язків, якими атом з'єднаний з іншими атомами.А число зв'язків, які може утворювати атом, дорівнює числу його неспарених електронів, які йдуть на утворення спільних електронних пар. При цьому полярність утворених зв'язків не враховується, а тому валентність не має знака. Вона не може бути ні позитивною, ні негативною. Наприклад, у молекулах азоту N2 та амоніаку NH3 атом Нітрогену N тривалентний, оскільки він з'єднаний з N і з Н трьома спільними електронними парами (три зв'язки). Отже, валентність визначається тільки числом ковалентних зв'язків. Ось чому поняття «валентність» не можна застосовувати для сполук немолекулярної будови (з йонним, атомним, металічним зв'язками). Саме тому замість поняття «валентність» використовується поняття «ступінь окиснення».
Ступінь окиснення — це умовний заряд атома в речовині, який виник би на атомі за умови, що спільні електронні пари повністю змістилися б до більш електронегативного атома.
Ступінь окиснення, на відміну від валентності, може мати позитивне, негативне і нульове значення. Це значення зі знаком плюс чи мінус перед арабською цифрою зазначається над символом елемента або римською цифрою без знака у дужках після назви елемента. Наприклад:
+1 -2 0
Na, O, Н2, де ступені окиснення Натрію +1, Оксигену -2, Гідрогену 0; або Ферум(ІІІ), Купрум(ІІ), Нітроген(V) тощо.
Якщо сполука бінарна, то один із елементів має позитивний ступінь окиснення, а інший — негативний. Так, у більшості сполук Гідроген має ступінь окиснення +1, а Оксиген -2. Наприклад, у формулі води:
+1 -2
Н2O.
Але це зовсім не означає, що атоми елемента, наприклад Гідрогену, несуть на собі заряд +1, а атоми Оксигену -2. Це умовні числа, якими домовилися позначати ступінь окиснення.
А як дізнатися, який елемент у сполуці виявляє позитивний ступінь окиснення, а який — негативний?
З цією метою потрібно звернутися до ряду електронегативності хімічних елементів:
У бінарних сполуках хімічний елемент, що стоїть у цьому ряду лівіше, виявляє негативний ступінь окиснення, а той, що стоїть правіше, — позитивний. Так, у сполуці MgO хімічний елемент Магній мас позитивний ступінь окиснення +2, а Оксиген — негативний ступінь окиснення -2.
Позитивні значення ступенів окиснення мають ті атоми, які віддали свої електрони іншим атомам (зв'язувальна електронна хмара зміщена від них). Наприклад, атоми металів.
Негативні значення ступенів окиснення мають ті атоми, які приєднали електрони від інших атомів (зв'язувальна електронна хмара зміщена до них).
Негативне значення ступеня окиснення -1 завжди має Флуор у всіх сполуках.
Нульове значення ступенів окиснення мають атоми в простих речовинах, наприклад Сl2, N2, Н2, 02, Br2, F2, оскільки у них зв'язувальна електронна пара не зміщена в жоден бік, а розміщена симетрично.
Під час обчислення ступенів окиснення слід пам'ятати, що: 1) алгебрична сума ступенів окиснення всіх атомів у сполуці має дорівнювати нулю, наприклад у ферум(ІІІ) хлориді FeCl3 сума усіх ступенів окиснення дорівнює: +3 + (-1) -3 = 0;
2) ступінь окиснення елементів у простих речовинах дорівнює нулю;
3) ступінь окиснення лужних металів завжди дорівнює +1;
4) ступінь окиснення Гідрогену в сполуках, як правило, дорівнює +1;
5) Флуор в усіх сполуках має ступінь окиснення -1;
6) ступінь окиснення Оксигену в сполуках, як правило, дорівнює -2.
Наприклад,
+1 +6 -2 0 -3 +1 +1 +7 -2 + 1 -2
H2SO4, N2, NH3, KMnO4, H2S
Ступінь окиснення не слід ототожнювати з валентністю навіть у тому разі, коли їхні значення збігаються. Наприклад, у хлороводні НСl ступінь окиснення Гідрогену +1, Хлору -1 і валентність того й іншого елемента — 1. А в молекулі азоту N2 (N≡N) є три електронні пари між атомами Нітрогену, тому він тривалентний. Проте ступінь окиснення Нітрогену дорівнює нулю, оскільки спільні електронні пари розміщені симетрично й однаковою мірою належать обом атомам. Через це в усіх простих речовинах ступінь окиснення елементів дорівнює нулю.
Наприклад, для Сульфуру як елемента VI групи ступінь окиснення дорівнює +6, для Нітрогену, елемента V групи, +5, для Барію, елемента II групи, +2. На підставі теорії будови атома це легко пояснити. Адже зовнішній електронний шар атомів цих елементів містить відповідно 6, 5 і 2 валентні електрони. Під час взаємодії з більш електронегативним елементом, наприклад з Оксигеном, електрони зміщуються в бік Оксигену, а сполучені з ним елементи набувають ступеня окиснення відповідно +6, +5, +2. Прикладами можуть бути сполуки SО3, Р2О5, ВаО.
Винятком є Флуор та Оксиген як найбільш електронегативні елементи (Флуор ніколи не виявляє позитивного ступеня окиснення, а Оксиген інколи виявляє,
+2 -1
тільки у сполуках з Флуором, наприклад флуорид оксигену OF2), а також деякі елементи VIII групи і підгрупи Купруму з І групи.
Найвищий ступінь окиснення у сполуках з Оксигеном, що чисельно дорівнює номеру групи, виявляють елементи не лише головних підгруп, а й побічних, незважаючи на те, що на зовнішньому електронному шарі їхніх атомів найчастіше міститься 1—2 електрони незалежно від того, в якій групі вони перебувають. Наприклад, в оксиді мангану(VII) Мn207 ступінь окиснення Мангану, елемента VII групи, дорівнює +7, хоча на зовнішньому електронному шарі атома Мангану містяться два електрони (ще 5 валентних електронів розміщені на передостанньому шарі).
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Визначте ступені окиснення атомів елементів у сполуках, формули яких:
(a) N2, NO2, NO, N2O5, N2O, N2O3;
(б) MnSO4, MnO2, Mn2O7, Mn2O3;
(в) As2O3, AsH3, H2, H2O;
(г) Cl2O7, Cl2, Cl2O, O2, Cl2O5, Cl2O3.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 24
Тема:Визначення ступеня окиснення елемента за хімічною формулою сполуки.
Мета:Розвивати навички визначення ступеня окиснення в сполуках за формулою, а також за будовою атомів, які утворюють ці сполуки. Сформувати навички складання хімічних формул за відомими ступенями окиснення атомів.
Основні поняття: хімічний звʼязок, йони, йонний зв’язок, ступінь окиснення.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: Урок застосування знань,навичок і умінь,творчого застосування їх на практиці
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
Самостійна робота. Ступінь окиснення Варіант № 1
1. Вкажіть максимальний та мінімальний ступінь окиснення As:
А +3, -2; Б +2, -2; В +5, -3; Г +3, -5
2. Визначте ступені окиснення елементів у сполуках:
АNH3; Б Al; В H4P2O7; Г Mn(NO3)2
3. Розмістіть сполуку в порядку зменшення ступеня окиснення Хлору:
АNaСlO2; Б AlCl3; В KClО4; Г Cl2O
Самостійна робота. Ступінь окиснення Варіант № 2
1. Вкажіть максимальний та мінімальний ступінь окиснення Se:
А +4, -2; Б +2, -4; В +2, -2; Г +6, -2
2. Визначте ступені окиснення елементів у сполуках:
АCH4; Б Ag2O; В Li3PO4; Г Mg(BrO3)2
3. Розмістіть сполуку в порядку зменшення ступеня окиснення Мангану:
АNaMnO4; Б MnCl2; В BaMnО4; Г MnO2
ІІ Повідомлення теми, цілей і завдань уроку
ІІІ Осмислення змісту й послідовності застосування способів виконання дій
1. Визначте ступені окиснення атомів елементів у сполуках, формули яких:
(а) H2SO4, SO2, SO3, H2SO3, MgSO4;
(б) HClO4, HPO3, Ba(NO3)2, Al2(SO4)3, P2O5; (в) Ca3(PO4)2, AI(NO3)3, K2SO3, Na2SO4.
ІVСамостійне виконання учнями завдань під контролем і за допомогою вчителя
1. Розрахуйте ступінь окиснення Мангану у сполуках: MnSO4, К2MnO4, MnO3 , Mn2O7 , KMnO4, H2MnO3.
2. Розрахуйте ступінь окиснення:
а) Фосфору в сполуках: H3PO4, Ca(H2PO4)2 , P2O5, Mg3P2;
б) Купруму в сполуках: Cu2O, Cu(NO3)2 , CuCI, СuS;
в) Сульфуру в сполуках: SО2 , K2SO3 , H2SO4, KAI(SO4)2, Mg(HS)2
3. Визначтеступіньокисненняатомівусполуках: K2B2O7 , КMnO4, NaCIO4, Sn(SO4)2 , Na2Cr2O7.
4. У молекулі білого фосфору Р4 валентність і ступінь окиснення атома Фосфору дорівнюють відповідно
(а)1 і +3; (б)3 і +3; (в) 3 і 0; (г) 2 і 0.
5. Атоми Нітрогену мають однаковий ступінь окиснення в сполуках, формули яких
(a) HNO3; (б) Ca3N2; (в) NH4Cl; (г) N2O3.
6. Найменший ступінь окиснення атомів Сульфуру має речовина, формула якої
(a) H2SO4; (б) Na2SO3; (в) SO3; (г) Al2(SO4)3.
7. *Ступінь окиснення атома Фосфору в йоні НР042- дорівнює
(а) + 5; (б) + 3; (в) 0; (г) - 5.
8. *. Передбач мінімальний і максимальний ступені окиснення Селену.
9. *. Визнач ступені окиснення атомів елементів у таких сполуках: O2, Н2O, Н2O2, OF2, Н2, ВаН2, NaH, H2S.
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 25
Тема:Складання формули сполуки за відомими ступенями окиснення елементів.
Мета:Закріпити навички складання хімічних формул за відомими ступенями окиснення атомів, визначення ступенів окиснення Розширити уявлення про хімічні реакції на прикладі хімічних реакцій зі зміною ступеня окиснення атомів. Показати єдність двох процесів — окиснення й відновлення — як властивість атомів віддавати або приєднувати електрони.
Основні поняття: хімічний звʼязок, йони, йонний зв’язок, ступінь окиснення.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: Урок застосування знань,навичок і умінь,творчого застосування їх на практиці
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку.
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
• Що таке ступінь окиснення?
• Які ви знаєте правила для визначення ступенів окиснення?
ІІ Повідомлення теми, цілей і завдань уроку
ІІІ Осмислення змісту й послідовності застосування способів виконання дій
З’ясуємо, як можна скласти формулу сполуки за відомими
ступенями окиснення атомів елементів. Складемо формулу ферум(III) оксиду. Слово
«оксид» означає, що справа від символу Феруму треба записати символ Оксигену: ![]() Зазначимо
ступені окиснення хімічних елементів над їх символами. Ступінь окиснення Феруму
вказаний в назві в дужках (III), отже, дорівнює +3, ступінь окиснення Оксигену
в оксидах –2:
Зазначимо
ступені окиснення хімічних елементів над їх символами. Ступінь окиснення Феруму
вказаний в назві в дужках (III), отже, дорівнює +3, ступінь окиснення Оксигену
в оксидах –2: ![]()
Знайдемо найменше спільне кратне для чисел 3 та 2, це
6. Розділимо число 6 на 3, одержимо число 2 ― це індекс для Феруму. Розділимо
число 6 на 2, одержимо число 3 – це індекс для Оксигену: ![]()
1. Cкладіть формули хлоридів виходячи з ступенів окиснення металів:
А Cd+2; Б Sn+4; В In+3; Г Ag+1
2. Cкладіть формули йодидів виходячи з ступенів окиснення металів:
АGa+3; Б Cu+1; В Sr+2; Г Mo+6
3. Cкладіть формули бромідів виходячи з ступенів окиснення металів:
АSn+2; Б Cr+3; В Ti+4; Г Na+1
ІVСамостійне виконання учнями завдань під контролем і за допомогою вчителя
Група 1. Тема. Ступінь окиснення.
Склад групи: ____________________________________________________
1. Визначте ступінь окиснення елементів в заданих сполуках:
АSiO2; БH2; ВH2CrO4 Г Сr(OH)3
2. Складіть формули сполук і зазначте ступені окиснення елементів:
А хлор (VII) оксид; Б станум(ІV) оксид
3. Складітьрівняння взаємодії магнію з киснем та розставте ступені окиснення елементів.
Група 2. Тема. Ступінь окиснення.
Склад групи: ____________________________________________________
1. Визначте ступінь окиснення елементів в заданих сполуках:
АFeO; БS8; ВK2MnO4; Г Fe(OH)3
2. Складіть формули сполук і зазначте ступені окиснення елементів:
А алюміній хлорид; Б манган (ІІ)оксид
3. Складіть рівняння взаємодії кальцію з бромом та розставте ступені окиснення елементів.
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 26
Тема:Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
Мета:Показати взаємозв'язок між будовою речовин та їх фізичними властивостями на основі знань про типи хімічних зв'язків у неорганічних речовинах. Ознайомити учнів з типами кристалічних ґраток (атомними, молекулярними, йонними, металевими). Сформувати вміння характеризувати фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв'язку.
Основні поняття: Кристалічні ґратки,атомні, молекулярні та йонні кристали.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
• Який вид хімічногозвʼязку називається ковалентним?
• Який вид хімічногозвʼязку називається йонним?
• Які частинки називаються йонами?
• Як вони утворюються?
• Наведіть приклади речовин з різними типами хімічногозвʼязку.
ІІ Мотивування учіння.
• Як розташовані частинки в твердих речовинах?
• З яких частинок складаються речовини?
• Чи залежить це від типу хімічного звʼязку?
• Чи залежать фізичні властивості речовин від типу частинок, з яких вони складаються?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Демонстрація №4 Моделі кристалічних ґраток різних типів.
Демонстрація №5 Речовини з різними типами кристалічних ґраток.
Демонстрація №6 Фізичні властивості речовин із різними типами кристалічних ґраток.
Розглядаємо моделі кристалічних ґраток натрій хлориду,алмазу, графіту, карбон(ІV)оксиду і описуємо властивості кожної речовини.
Лабораторний дослід №2 Ознайомлення з властивостями речовин з різними типами кристалічних ґраток. Інструктивна картка
1. Розгляньте видані вам речовин і заповніть таблицю.
|
Речовина |
Хімічний звʼязок |
Кристалічна ґратка |
Структурні частинки |
Сили взаємодії |
Фізичні властивості |
|
NaCl |
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
S |
|
|
|
|
|
2. Зробіть висновок.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Виберіть одну правильну відповідь
1 Вкажіть назву зв’язку, утвореного за рахунок спільної пари електронів:
А металічний; Бйонний; В ковалентний; Г водневий
2 Визначте сполуку, що має більш полярний зв’язок:
АPbS2; БSiO2; ВK3N; Г Cl2O
3 Вкажіть тип кристалічної решітки CsOH:
А атомна; Б металічна; В молекулярна; Г йонна
4 Визначте тип кристалічної гратки твердої, крихкої речовини з високою температурою плавлення, розчинної у воді:
Амолекулярна; Батомна; В металічна; Гйонна
Виберіть кілька правильних відповідей
5 Вкажіть речовини з молекулярною кристалічною граткою:
АPbО; БСO2; ВN2; ГК2O
6 Встановіть відповідність між властивостями та речовинами:
Властивості Речовина
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
1 кристалічна речовина, розчинна у воді; А кремній;
2 безбарвна газоподібна речовина; Б літій нітрат;
3 тверда речовина з дуже високою В азот;
температурою плавлення; Г вода
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 27
Тема:Семінарське заняття «Хімічний зв’язок і будова речовини».
Мета:Узагальнити й систематизувати знання учнів про види хімічного зв'язку й типи кристалічних ґраток з огляду на будову атома. Продовжити формування елементів наукового світогляду учнів, багатогранності та єдності будови речовини, взаємозв'язку явищ у природі. Розвивати вміння й навички учнів застосовувати набуті знань для розв'язання задач. Підготувати учнів до тематичного оцінювання з теми «Хімічний зв'язок і будова речовини».
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:семінарське заняття.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Коректуючи частина.
( усна перевірка знань) 10 хвилин
Учні працюють в групах. Запитання надруковані і роздані групам.
Опитування проводить консультант по запитанням коректуючої частини уроку. ( не виключається можливість консультантам самостійно ставити запитання з теми)
Під час усного опитування консультант оцінює відповіді і записує оцінки в облікову картку консультанта.
|
№ п/п |
Зміст запитань і завдань |
Прізвища членів групи |
||
|
|
|
|
||
|
|
|
|
|
|
|
Загальна сума балів |
|
|
|
|
|
Оцінка |
|
|
|
|
Крім відповідей на усні запитання, консультант вносить до картки оцінки за виконання письмових завдань.
Запитання коректуючої частини: Які види хімічних звʼязків вам відомі?
• Який вид хімічногозвʼязку називається ковалентним?
• Який вид хімічногозвʼязку називається йонним?
• Які частинки називаються йонами?
• Як вони утворюються?
• Що таке електронегативність?
• Як змінюється електронегативність у періодах і групах періодичної системи? Чому?
• Що таке ступінь окиснення?
• Які ви знаєте правила для визначення ступенів окиснення?
• Які типи кристалічних ґраток вам відомі?
• Охарактеризуйте фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв'язку.
ІІ Навчаюча частина. (20 хвилин)
У процесі роботи консультант спостерігає, як члени його групи виконують письмові завдання і оцінює їх роботу.
Після завершення навчаючої частини консультанти здають вчителеві облікові картки, в яких, крім балів чи оцінок за кожне із завдань, виставлена підсумкова оцінка кожному члену групи за результатами групової роботи на занятті.
Завдання навчаючої частини
1. Вкажіть максимальний та мінімальний ступінь окиснення Br:
А +1, -1; Б +5, -2; В +2, -1; Г +7, -1
2. Визначте ступені окиснення елементів у сполуках:
АNO2; Б Fe2S3; В SrSO4; Г Al(ClO3)3
3. Складіть схеми утворення зв’язків у NO2і Fe2S3.
4. Розмістіть сполуку в порядку зменшення ступеня окиснення Фосфору:
АP2O3; Б Mg3(PO4)2; В Ba3P2; Г P
5. Визначте ступінь окиснення елементів в заданих сполуках:
АNa2S; Б O3; В NaClО4; Г Co(OH)2
6. Складіть формули сполук і зазначте ступені окиснення елементів:
А алюміній хлорид; Б манган (ІІ)оксид
7. Складітьрівняння взаємодії алюмінію з хлором та розставте ступені окиснення елементів.
ІІІ Контролююча частина. (15 хвилин)
Учні отримують індивідуальні завдання (картки) і самостійно працюють над їх виконанням.
Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть назву зв’язку, утвореного за рахунок спільної пари електронів: А металічний; Бйонний; В ковалентний; Г водневий
2 Визначте сполуку, що має більш полярний зв’язок і складіть схеми утворення зв’язків:
АPbS2; БSiO2; ВK3N; Г Cl2O
3 Вкажіть тип кристалічної решітки CsOH:
А атомна; Б металічна; В молекулярна; Г йонна
4 Визначте тип кристалічної гратки твердої, крихкої речовини з високою температурою плавлення, розчинної у воді:
Амолекулярна; Батомна; В металічна; Гйонна
Виберіть кілька правильних відповідей
5 Вкажіть речовини з молекулярною кристалічною граткою:
АPbО; БСO2; ВN2; ГК2O
6 Встановіть відповідність між властивостями та речовинами:
Властивості Речовина
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
1 кристалічна речовина, розчинна у воді; А кремній;
2 безбарвна газоподібна речовина; Б літій нітрат;
3 тверда речовина з дуже високою В азот;
температурою плавлення; Г вода
7 Охарактеризуйте йонну кристалічну гратку
8 Опишіть властивості речовини з атомною кристалічною граткою
Варіант № 2
Виберіть одну правильну відповідь
1 Вкажіть назву зв’язку, утвореного між атомами, що різко відрізняються за електронегативністю:
А водневий; Б ковалентний; В йонний; Г металічний
2 Визначте сполуку, що має більш полярний зв’язок і складіть схеми утворення зв’язків:
АSeO2; БK3P; ВSF6; Г As2O5
3 Вкажіть тип кристалічної решітки CаO:
А молекулярна; Б атомна; В йонна; Г металічна
4 Визначте тип кристалічної гратки твердої нерозчинної речовини з дуже високою температурою плавлення:
Аатомна; Бйонна Вмолекулярна; Г металічна;
Виберіть кілька правильних відповідей
5 Вкажіть речовини з молекулярною кристалічною граткою:
АBaО; БСO; В О2; Г Li2O
6 Встановіть відповідність між властивостями та речовинами:
Властивості Речовина
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
1 кристалічна речовина, розчинна у воді; А графіт;
2 безбарвна газоподібна речовина; Б хлор; 3 тверда речовина з дуже високою В азот температурою плавлення; Г калій гідроксид
7 Охарактеризуйте молекулярну кристалічну гратку
8 Опишіть властивості речовини з йонною кристалічною граткою
Урок 28
Тема:Контрольна робота з теми «Хімічний зв’язок і будова речовини».
Мета:Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Формування компетентностей:Загальнопредметна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку : контроль та коригування знань, уміньі навичок.
Обладнання : картки – завдання.
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
Хімічний зв’язок
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 клас. Хімічний зв’язок |
1 – 6 |
0,5 |
30-35 хв. |
|
7 - 8 |
1 |
||
|
9 |
3 |
||
|
10 |
4 |
8 кл Хімічний зв’язок Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть який зв’язок утворюється за рахунок спільної пари електронів:
А електронний; Б йонний; В ковалентний; Г металічний
2 Вкажіть кількість електронів на зовнішньому енергетичному рівні у Фосфору:
А 4; Б2; В 3; Г 5
3 Вкажіть речовину з ковалентним полярним зв’язком:
А Zn; Б CH4; В O2; Г LiF
4 Вкажіть речовину з йонним типом зв’язку:
АKF; БN2O3; В Ca; ГCO
Виберіть кілька правильних відповідей
5 Виберіть твердження, щодо ковалентного полярного зв’язку:
А спільна пара електронів симетрична відносно обох елементів;
Б зв’язок утворюється за рахунок спільної електронної пари;
В зв’язок ґрунтується на електронному механізмі; Г спільна пара електронів зміщена до одного з елементів 6 Вкажіть металічні елементи:
А P; Б Al; В Ag; Г S
7 Виберіть формули речовин з йонним типом зв’язку:
А KF; Б Na2O; В HJ; Г CO2
8 Запишіть речовини у порядку збільшення полярності зв’язку:
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
А NH3
Б HCl;
В CH4; Г H2S
9 Встановіть відповідність між електронною формулою та катіоном:
Електронна формула Катіон
|
1 |
|
|
2 |
|
|
3 |
|
1 1s22s22p63s23p6; А H1+;
2 1s22s22p63s2; Б К1+;
3 1s22s22p6; В Mg2+;
Г S 4+
10 Запишіть схему утворення зв’язку між атомами у сполуках:
А дигідроген сульфід; Б хлору.
Хімічний зв’язок
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 клас. Хімічний зв’язок |
1 – 6 |
0,5 |
30-35 хв. |
|
7 - 8 |
1 |
||
|
9 |
3 |
||
|
10 |
4 |
8 кл Хімічний зв’язок Варіант № 2
Виберіть одну правильну відповідь
1 Вкажіть який зв’язок утворюється за рахунок електростатичної дії йонів:
А йонний; Б ковалентний; В електронний; Г металічний
2 Вкажіть кількість електронів на зовнішньому енергетичному рівні у Сульфуру:
А 4; Б 5; В 6; Г 2
3 Вкажіть речовину з ковалентним неполярним типом зв’язку
А H2; Б ZnO; В H2O; Г Fe
4 Вкажіть речовину з ковалентним полярним типом зв’язку
АHCl; БN2; В CaCl2; ГCu
Виберіть кілька правильних відповідей
5 Виберіть твердження, щодо ковалентного неполярного зв’язку:
А зв’язок ґрунтується на електронному механізмі;
Б зв’язок утворюється за рахунок спільної електронної пари;
В спільна пара електронів зміщена до одного з елементів;
Г спільна пара електронів симетрична відносно обох елементів
6 Вкажіть неметалічні елементи
А Fe; Б N; В S; Г Na
7 Виберіть формули речовин з йонним типом зв’язку
А CaCl2; Б P2O5; В HCl; Г NaF
8 Розставте речовини у порядку збільшення полярності зв’язку
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
А NaI;
Б NaCl;
В NaF;
Г NaBr
9 Встановіть відповідність між електронною формулою та аніоном:
Електронна формула Аніон
|
1 |
|
|
2 |
|
1 1s22s22p63s23p6; А O2-;
2 1s22s22p6; Б H1-;
|
3 |
|
3 1s2 В P3+;
Г Cl1-
10 Запишіть схему утворення зв’язку між атомами у сполуках:
А гідроген фторид; Б азот.
Урок 29 Тема:Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро.
Мета:Сформувати уявлення учнів про хімічне поняття «кількість речовини». Показати сутність фізичної величини «кількість речовини». Ознайомити з одиницею вимірювання кількості речовини. Увести поняття «моль», «стала Авогадро».
Основні поняття та терміни: кількість речовини, моль, число Авогадро, константа.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: Урок засвоєння нових знань, умінь і навичок.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань.
Фронтальна бесіда.
1. З яких частинок складаються всі речовини?
2. Наведіть приклади речовин молекулярної та не молекулярної будови?
3. Як визначити відносну атомну масу елемента? Молекулярну масу речовини.
ІІІ. Вивчення нового матеріалу
Розповідь вчителя
Для вивчення навколишнього світу недостатньо лише спостерігати предмети та явища, необхідно характеризувати їх кількісно, тобто за допомогою певних величин. Будь-яка фізична величина – це характеристика об’єктів або явищ, яка може бути виміряна. У хімії крім таких величин, як маса і об’єм застосовують величену кількість речовини.
Кількість речовини - фізична величина, що показує число структурних частинок (атомі, молекул, йоннів ) у певній порції речовини. Одиницею вимірювання кількості речовини є моль. Позначається грецькою літерою ν(ню).
Відомий італійський вчений Амадео Авогадро вивчив і виміряв кількість речовини для різних речовин. За допомогою спеціальних розрахунків учений підрахував, що у 12 г вуглецю міститься 6,02 · 1023 атомів. Таку кількість речовини взяли за 1 моль.
Встановлено, що 1 моль будь-якої речовини містить 6,02 · 1023 структурних частинок, 1 моль води - 6,02 · 1023 молекул, 1 моль заліза - 6,02 · 1023 атомівФеруму. Число 6,02 ·1023 дістало назву – Число Авогадро, а відповідно фізико-хімічну константу, що відповідає цьому числу сталою Авогадро (позначається NA).
Отже 1 моль – це кількість речовини, що містить стільки ж частинок (атомів, молекул, йоннів ), скільки атомів у 12 г вуглецю, тобто 6,02 ·1023 частинок.
N
![]() де
ν – кількість речовини, N – число атомів або молекул у речовині, NA
де
ν – кількість речовини, N – число атомів або молекул у речовині, NA
NA – число Авогадро
ІV. Застосування учнями знань і умінь.
1. Обчисліть кількість речовини в порції вуглекислого газу (СО2), що містить 9,03· 1023молекул.
![]() ν(CO2) - ?CO2
ν(CO2) - ?CO2 ![]() 9,03102323молекул 1,5моль
9,03102323молекул 1,5моль
6,0210 молекул
Відповідь: 1,5 моль
2. Обчисліть число атомів Купруму в порції міді кількістю речовини 3 моль.
Дано: Розв’язання
N
![]() ν
(Сu)=3 моль
ν
(Сu)=3 моль
![]() NA N
NA тоді
NA N
NA тоді
N(Cu) - ?
N(Cu) 3моль6,021023атомів/ моль 18,061023атомів
Відповідь: 18,06·1023 атомів.
V. Підведення підсумків уроку.
VI. Домашнє завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 30
Тема:Обчислення числа атомів (молекул) у певній кількості речовини..
Мета:Формувати вміння і практичні навички хімічних обчислень з використанням понять «кількість речовини», «моль» і «стала Авогадро».
Основні поняття та терміни: кількість речовини, моль, число Авогадро, константа.
Формування компетентностей: Загальнопредметна, ключова, саморозвитку і самоосвіти, комунікативна.
Тип уроку: Урок формування вмінь і навичок.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Тестові завдання
1) Кількість речовини вимірюється:
а) молях; б) кілометрах;
в) літрах.
2) Число частинок, що міститься у 4 молях
а) 6,02·1023; б) 24,08·1023;
в)12,04 ·1023.
3) Два моль кисню містить:
а) 13,02·1023; б) 12 молекул;
в)12,04 ·1023.
2. Якою формулою виражається взаємозв’язок між кількістю речовини і сталою Авогадро
N
![]() NA , або N
NA
NA , або N
NA
ІІІ Поглиблення знань, формування вмінь і навичок.
Задача 1
Обчисліть число атомів Феруму в порції заліза кількістю речовини 5 моль.
N(Fe) 5моль6,021023атомів/ моль 30,11023атомів
Відповідь: 30,1·1023 атомів.
Задача 2
Яке число молекул міститься у воді кількістю речовини 0,15 моль?
Дано:
![]() ν (Н2О) = 0,15моль H2O
ν (Н2О) = 0,15моль H2O ![]() N(H2 O);NH2OH2ONA
N(H2 O);NH2OH2ONA
N (H2O) - ? NA
NH2O 0,15моль6,021023моль/атомів 0,9031023
Відповідь: у воді кількістю речовини 0,15 моль міститься 0,903 · 1023 молекул.
Самостійна робота зі взаємоперевіркою
Заповнити пропуски в таблиці
|
Речовина |
ν |
N |
|
O2 |
1,5 моль |
? |
|
Fe |
0,2 моль |
? |
|
HCl |
? |
1,8·1023 молекул |
|
H2SO4 |
? |
24,08·1023 молекул |
|
CuO |
8 моль |
? |
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 31
Тема: Молярна маса.
Мета:Увести поняття «молярна маса». Ознайомити з одиницею вимірювання молярної маси речовини. Показати фізичний зміст молярної маси речовини. Пояснити взаємозв'язок між кількістю речовини, масою і молярною масою.
Основні поняття та терміни: кількість речовини, моль, число Авогадро, молярна маса, атомна маса.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти.
Тип уроку: Урок засвоєння нових знань.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
Розв’язати задачу
1. Яке число молекул містить кисень кількістю речовини 2 моль?
2. Яке число атомів містить цинк кількістю речовини1,5 моль?
3. Яке число молеку азоту та атомів Нітрогену містить азот кількістю речовини 2,5 моль?
4. Розрахувати молекулярні маси сполук: Р2О5 та SiO2.
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Сприймання й усвідомлення учнями фактичного матеріалу.
В одному молі будь- якої речовини міститься6,02·1023 частинок речовини. Кожна частинка має певну масу.
Молярна маса – це маса 1 моль речовини, а отже сумарна маса всіх частинок, що входять до 1 моль цієї речовини.
Молярна маса пропорційна масі однієї молекули певної речовини. Отже числове значення молярної маси дорівнює відносній молекулярній масі речовини.
Молярна маса – це фізична величина, що дорівнює відношеню маси речовини до відповідної кількості речовини. m
M ![]()
Молярну масу позначають латинською літерою М. Вимірюється молярна маса в г/моль.
Наприклад , масса 1 моль кисню дорівнює:
Mr (O2) = 32 а.о.м.; m(O2) 32г
![]() MO2
32г/ моль
MO2
32г/ моль
O2 1моль
Знаючи масу речовини, ми можемо обчислити кількість речовини за формулою: m
![]() звідси m M M
звідси m M M
ІVОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Задача 1
Обчисліть кількість речовини кисню масою 56 г.
Дано: Розв’язання
m
![]() (О )=56 г З формули
(О )=56 г З формули
![]() отримуємо:
отримуємо:
M
mO2
![]() ν (О2) -
? O2MO2
ν (О2) -
? O2MO2
|
Mr (O2) = 2·16 а.о.м.; |
|
|
M(O2) 32г/ мольтоді Відповідь: 1,75 моль. Задача 2 |
56 (О2) 32г / моль |
Обчисліть масу 2 моль Нітроген (V) оксиду.
Дано: Розв’язання
m
![]() ν(N O ) = 2 моль
з формули
ν(N O ) = 2 моль
з формули
![]() отримуємо:
отримуємо:
M
m(N2O5) = ? m(N2O5) (N2O5) M(N2O5).
Mr(N2O5) 142165 108а.о.м. M(N2O5) 108г / моль
Тоді :mN2O5 2моль108г / моль 216г
V. Самостійна робота зі взаємоперевіркою
Розрахуйте молярну масу для речовин, обчисліть масу 2 моль данних речовин
І варіант: алюміній оксид Al2O3, нітратна кислота HNO3
ІІ варіант:калій оксид К2О, ортофосфатна кислота Н3РО4
VПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 32
Тема:Обчислення за хімічними формулами молярної маси, маси й кількості речовини.
Мета:Поглибити уявлення учнів про молярну масу речовини. Навчити використовувати набуті знання для розрахунків за хімічними формулами молярної маси, маси й кількості речовини.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти.
Тип уроку: Урок формування вмінь і навичок..
Обладнання:Періодична система. Хімічних елементів Д.І.Менделєєва, картка з завданням.
Хід уроку
І Організаційний етап
ІІ Перевірка домашнього завдання.
Хімічний диктант.Кількість речовини. Моль
1. Відносна атомна маса елемента позначається …
2. Відносна молекулярна маса елемента позначається …
3. Маса позначається …
4. Одиниці вимірювання маси речовини …
5. Стала Авогадро дорівнює…
6. Назвіть структурні частинки речовини …
7. Кількість структурних частинок речовини позначається …
8. Кількість речовини позначається …
9. 1 моль речовини містить … частинок
10. Моль – це …
11. Обчисліть число молекул в 10 моль кисню. За кожну вірну відповідь один бал
ІІІ Формування умінь і навичок.
Сьогодні ми закріпимо уміння з розв’язань розрахункових задач з використанням фізичних величин «кількість речовини» та «молярна маса».
Записуємо на дошці всі відомі нам формули:
N m
![]() N
; N
NA ;
N
; N
NA ;
![]() M ; m M
M ; m M
A
Розв’язування задач.
Розрахуйте кількість речовини натрій карбонату (Na2CO3) масою70г.
Дано Розв’язання
![]() m(Na2CO3) =
70г 1.Обчислюємо молярну массу Na2CO3 ν
(Na2CO3) - ? M(Na2CO3) 23212163106г/ моль
m(Na2CO3) =
70г 1.Обчислюємо молярну массу Na2CO3 ν
(Na2CO3) - ? M(Na2CO3) 23212163106г/ моль
![]() m 70г
m 70г
2.
За формулою
: (Na2CO3) ![]()
0,7моль.
0,7моль.
M 106г / моль
Відповідь: 0,7 моль.
Задачі для самостійного розв'язування 1. Обчисліть масу 0,5 моль натрій гідроксиду (NaOH).
2. Обчисліть масу сульфатної кислоти (H2SO4) кількістю речовини 2,5 моль;
3. Обчисліть кількість атомів Оксисену у кисні масою 48 г.
4. Розрахуйте кількість речовини натрійхлориду(NaCI) масою 146,25г.
5. Розрахуйте кількість речовини сульфатної кислоти (H2SO4) масою294 г.
ІVПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 33 Тема:Закон Авогадро. Молярний об’єм газів.
Мета:Ознайомити учнів з поняттям «молярний об'єм». Розкрити особливості використання поняття «молярний об'єм» для газоподібних речовин. Навчити учнів виконувати розрахунки об'єму газу за нормальних умов.
Основні поняття та терміни:молярний об'єм, кількість речовини, закон Авогадро.
Формування компетентностей: Загальнопредметні, саморозвитку і самоосвіти, продуктивної творчості.
Тип уроку:Урок засвоєння нових знань, навичок і вмінь.
Обладнання:Періодична система. Хімічних елементів Д.І.Менделєєва, картка з завданням
Хід уроку
І Організаційний момент
ІІ Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь
Фронтальна бесіда
1) Що таке «кількість речовини»?
2) В яких одиницях вимірюється кількість речовини?
3) Яка кількість частинок міститься в одному молі речовини?
4) Скільки молекул води міститься в 1 моль льоду?
5) А в 1 моль рідкої води?
6) В 1 моль водяної пари?
7) Яку масу матимуть:
• 1 моль льоду?
• 1 моль води?
• 1 моль водяної пари?
ІІІ Сприймання й усвідомлення учнями фактичного матеріалу
Проблемне питання. Який об’єм займе:
• 1 моль льоду?
• 1 моль води?
• 1 моль водяної пари?
Дати відповідь на ці питання відразу ми не зможемо, тому, що об’єм
m
речовини залежить від густини
речовини. І відповідно до формули V ![]() ,
,
об’єм буде різним. 1 моль газоподібної води займе більший об’єм , ніж 1моль води або льоду.
Чому? А тому, що в рідких і газоподібних речовинах відстань між молекулами різна.
Вивченням газоподібних речовин займалося багато вчених. Значний внесок у вивчення цього питання зробили французький вчений-хімік Жозеф Луї Гей Люсак та англійський фізик Роберт Бойль. Вони сформулювали низку фізичних закономірностей , що описують стан газів.. Об’єми газів залежать не від розмірів окремих молекул, а від відстані між молекулами. Відстані між молекулами залежить від швидкості їхнього руху, енергії та відповідно, температури.
На піставі цих законів і своїх досліджень італійський учений Амадео Авогадро сформулював закон: В однакових об’ємах різних газів міститься однакова кількість молеку.
За звичайних умов газоподібні речовини мають молекулярну будову.
Молекули газів мають маленькі розміри, в порівнянні з відстанню між ними. Тому об’єми газів визначаються не розмірами частинок (молекул), а відстанню між ними, що для будь яких газів приблизно однакова.. Оскільки один моль будь-якої речовини містить 6,02·1023 молекул, то звідси випливає, що за певних умов температури й тиску 1 моль будь-якої речониви, що перебуває у газоподібному стані займає однаковий об’єм. Цей об’єм дістав назву молярного об’єму і позначається Vm .
Молярний об’єм газу Vm знаходять за відношенням об’єму V порції данного газу до кількості речовини в цій порції:
V
Vm
![]() ,
,
Де V - об’єм газу за н.у., л (м3); - кількість речовини газу, моль..
Отже молярний об’єм газу вимірюється в літрах на моль (л/моль) або метрах кубічних на моль (м3/моль).
Наприклад: Обчисліть молярний об’єм карбон (ІV) оксиду, якщо відомо, що за нормальних умов (н.у.) 0,5 моль його займає об’єм 11,2 л/моль. Для обчислення скористаємося формулою:
11,2л
Vm(CO2) ![]()
22,4л/ моль
0,5моль
22,4л/ моль
0,5моль
Моляриний об’ємVm можна обчислити також, знаючи молярну масу газу та його густину ρ тобто масу 1 літра даного газу за нормальних умов. За формулою:
M
Vm![]()
Наприклад:. Обчисліть молярний об’єм азоту, кількістю речовини 1 моль, якщо його густина становить 1,25г/л. Молярна маса азоту дорівнює 28г/моль. Тоді:
Vm
![]() 28г / моль
22,4л/ моль.
28г / моль
22,4л/ моль.
1,25г / л
Отже,
молярний об’єм – це об’єм 1 моль газу. За нормальних умов він становить 22,4 л/моль.
Виходячи з цього, якщо 1 моль будь- якого газу за нормальних умов займає один і той же об’єм то він і містить однакову кількість молекул - 6,02·1023. Це припущення ,ще на початку ХІХ ст.. висловив А.Авогадро. Пізніше це припущення дістало експериментальне підтвердження і теоретичне обґрунтування. Йому дали назву закон Авогадро: в однакових об’ємах різних газів за однакових умов міститься однакове число молекул.
Важливим наслідком із закону Авогадро є наступне: в однакових об’ємах різних газів за однакових умов міститься онакова кількість речовини.

ІV Осмислення змісту й послідовності застосування способів виконання дій;
Розв’язування задач
Задача 1
Обчисліть, який об’єм займуть 2 моль водю (Н2) за н.у.
Дано: Розв’язання
V
![]() (H2) 2моль(н.у.) З
формули Vm
(H2) 2моль(н.у.) З
формули Vm ![]() випливає V Vm
випливає V Vm
VН2? тоді V(H2) 2моль22,4л/ моль 44,8л
Відповідь: 44,8 л
Задача 2
Обчисліть кількість молекул кисню, що займають об’єм 36,6л
Задача 3
Обчисліть об’єм, що займає хлор (СІ2) масою 56 г.
V Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 34
Тема:Відносна густина газів.
Мета:Розкрити зміст поняття «відносна густина газів». Навчити здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною. Показати практичне значення цих розрахунків.
Основні поняття та терміни: відносна молекулярна маса, молярна маса, відносна густина газів.
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти,комунікативні.
Хід уроку
І Організаційний момент
ІІ Актуалізація і корекція опорних знань.
Робота на дошці і в зошитах (учні виходять до дошки і виконують по одному прикладу. Інші працюють у зошитах)
Заповніть таблицю:
|
Формула газу |
Кількість речовини |
Молярна маса |
маса |
Об’єм |
|
О2 |
2 моль |
|
|
|
|
СІ2 |
|
|
100г |
|
|
N2 |
|
|
|
11,2л |
|
СО |
2 моль |
|
|
|
|
NH3 |
|
|
32 г |
|
|
С2Н4 |
|
|
|
11,2л |
ІІІ Сприймання й усвідомлення учнями фактичного матеріалу.
З таблиці, яку ми щойно заповнювали на дошці видно, що однакова кількість речовини різних газів займає однаковий об’єм, але має різну масу та молярну масу. За законом Авогадро однокові об’єми газів (н.у.) містять однакове число молекул. Звідси виходить, що маси однакових об’ємів двох газів повинні відноситися одна до одної як їхні молекулярні маси або чисельно
![]() m1 M1 , де m1,m2- маси першого і другого
газів; такі самі молярні маси:
m1 M1 , де m1,m2- маси першого і другого
газів; такі самі молярні маси:
m2 M2
M1,M2 -молярні (або молекулярні маси) першого і другого газів.
Відношення маси певного газу до маси такого самого об’єму іншого газу, взятих за однакових температури і тиску, називаютьсявідносною густиною першого газу за другими (позначається D):
Наприклад маса 1 л СО2 дорівнює 1,98 г , а маса 1 л Н2 за таких самих умов –
0,09 г. Звідси густина карбон (IV) оксиду СО2 за воднем становить 1,98 ÷0,09 = 22, тобто карбон (IV) оксид у 22 рази важчий за водень або водень у 22 рази легший за карбон (IV) оксид..
Найчастіше густину різних газів визначають відносно водню як найлегшого з
газів.Оскільки молекулярна маса водню дорівнює 2, то густина будь якого
M
газу за воднем
обчислюється за формулою: DH2 ![]() .
2
.
2
Якщо ж густину певного газу визначають за повітрям чи
киснем то використовують наступні формули: Dпов ![]() М ; DO2
М ; DO2
![]() М , де 29 – молекулярна
М , де 29 – молекулярна
29 32
масо повітря; 32 – молекулярна маса кисню.
Густину газів можна також визначити за іншими газами, якщо відомі їхні молекулярні маси. Знаючи відносну густину одного газу за іншим, можна визначити його молекулярну масу, а отже, й молярну за формулами:
M 2D;М 29D;М 32Dі.т.д.
Молярна маса газу дорівнює його густині відносно іншого газу, помноженій на молярну масу останнього.
ІVОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Задача 1
Обчисліть відносні густину Карбон (ІІ) оксиду за повітрям.
M1 D ![]()
M2
M (CO) Dпов(CO) ![]()
M (пов)
Розв’язання: М (СО) 28г / моль М (пов) 29г / моль
Dпов(СО) ![]()
0,965
0,965
Відповідь: 0,965
Задача 2. Обчисліть відносну густину сульфур (VІ) оксиду за воднем.(Відповідь: 40)
Задача 3
Густина Нітрогеноксиду за воднем дорівнює 23. Обчисліть молярну масу цього оксиду.
![]() Дано
Розв’язання
Дано
Розв’язання
1) З формулиD
![]() M1 випливає M1
D
M2. M2
M1 випливає M1
D
M2. M2
М(N O ) - ? M(NxOу) 232 46г/ моль
Густина водневої сполуки елемента ІV групи за воднем дорівнює 8.
Обчисліть молярну масу цієї сполуки та виведіть її формулу.(Відповідь 16г/моль; СН4)
V Підсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок35
Тема: Обчислення з використанням відносної густини газів.
Мета:Поглибити уявлення учнів про поняття «відносна густина газів». Навчити здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною.
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти, комунікативні.
Тип уроку: поглиблення знань.
Обладнання: періодична система хімічних елементів.
Хід уроку
І. Організація класу
ІІ. Актуалізація знань
1) Дайте визначення поняття «відносна густана газів»
2) За якою формулою можна розраховується відносна густина за воднем?
3) За якою формулою можна розраховується відносна густина за повітрям?
4) Як розрахувати молекулярну масу речовини, якщо відома її густина за воднем?
5) Як розрахувати молекулярну масу речовини, якщо відома її густина за повітрям ?
ІІІ Розв’язування розрахункових задач з використанням поняття
«відносна густина газів»
Задача 1.
Розрахуйте густину за воднем та повітрям парів наступних газів: а) F2;
б) H2S;
в) NH3;
г) N2;
Задача 2.
Розрахувати у скільки разів наступні гази важчі за азот (N2): а) Н2S;
б) CO2;
в) C3H8;
г) NH3.
Задача 3
Густина газу за повітрям дорівнює 1,5. Знайти густину цього газу за воднем.
Задача 4
Знайти молекулярну масу газу, якщо його густина за повітрям дорівнює 0,59.
Задача 5
Густина парів брому за повітрям дорівнює 5,52. Визначте склад молекули брому.
ІV. Підбиття підсумків уроку. Домашне завдання Повторити параграфи (§).
Творче завдання: використовуючи набуті знання скласти й розв’язати задачі аналогічні до задач, які розв’язувалися на уроці.
Урок 36
Тема:Розрахунки за хімічними формулами
Мета:Систематизувати знання про кількість речовини, молярну масу, молярний об'єм. Удосконалювати навички обчислень за хімічними формулами. Підготувати учнів до тематичного оцінювання з теми «Кількість речовини. Розрахунки за хімічними формулами».
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти, комунікативні.
Тип уроку: поглиблення знань. Обладнання: періодична система хімічних елементів, картки із завданнями
Хід уроку
І. Організація класу
ІІ. Актуалізація знань. Перевірка домашнього завдання
1. Два-три учні пропонують складені вдома задачі на обчислення відносної густини газоподібних речовин.
2. На дошці виписуємо всі формули, які вивчили протягом теми.
3. Розв’язування задач:
1. Розрахувати масу натрій гідроксиду (NaOH) кількістю речовини 0,5моль. 2. Розрахувати масу сульфатної кислоти (H2SO4) кількістю речовини 2,5моль.
3. Яка кількість речовини міститься в алюміній гідроксиді (АІ(ОН)3) масою 7,8 г?
4. Яка кількість речовини міститься в натрій хлориді (NаСІ) масою 0,35 г?
5. Скільки молекул міститься в хлоридній кислоті (НСІ) кількістю речовини 2,5 моль?
6. Обчислити відносну густину за гелієм та повітрям азоту (N2).
7. Яку масу матиме гідрогенсудьфід (H2S), що за нормальних умов займає об’єм 5,6 л?
ІІІ .Підбиття підсумків, виставлення оцінок.
ІV. Домашне завдання
Повторити параграфи (§).
Урок 37
Тема:Розрахунки за хімічними формулами
Мета:Систематизувати знання про кількість речовини, молярну масу, молярний об'єм. Удосконалювати навички обчислень за хімічними формулами. Підготувати учнів до тематичного оцінювання з теми «Кількість речовини. Розрахунки за хімічними формулами».
Формування компетентностей: Загальнопредметних, саморозвитку і самоосвіти, комунікативні.
Тип уроку: поглиблення знань. Обладнання: періодична система хімічних елементів, картки із завданнями
Хід уроку
І. Організація класу
ІІ. Актуалізація знань
1. Що таке кількість речовини?
2. В яких одиницях вимірюється кількість речовини?
3. Яка формула відображає взаємозв'язок між кількістю речовини та кількістю частинок з яких вона складається?
4. Як знайти масу речовини, якщо відома її кількість?
5. Чому дорівнює стала Авогадро?
Самостійна робота.
Кількість речовини. Розрахунки за хімічними формулами.
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 кл. Кількість речовини. Розрахунки за хімічними формулами |
1 - 6 |
0,5 |
30 - 35 хв. |
|
7 - 8 |
1 |
||
|
9 - 10 |
2 |
||
|
11 |
3 |
8 кл. Кількість речовини. Розрахунки за хімічними формулами.
Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть що позначає молярний об’єм газів:
|
А об’єм однієї молекули у л; |
В об’єм одного моль газу у л; |
|
Б об’єм одного атома у мл; |
Г об’єм газу |
2 Вкажіть об’єм що займає однакове число молекул будь-яких газів за однакових умов:
А 11,2 л; Б 22,4 л; В 0,5 л; Г 44,8 л
3 Вкажіть формулу, що застосовується для обчислення молярної маси речовини:
![]()
![]() m Бm M; В M m ; Г m V А V ;
m Бm M; В M m ; Г m V А V ;
4 Вкажіть правильний запис короткої умови задачі: «Обчисліть кількість речовини, що відповідає 7,8 г калію»:
|
А Дано: m(К) = 7,8 г |
Б Дано: m(К) = 7,8 г |
В Дано: ν(К) = 7,8 г |
Г Дано: m(К2) = 7,8 г |
|
V(К) - ?
|
ν(К) - ? |
V(К) - ? |
V(К2) - ? |
5 Вкажіть об’єм 3 моль метану (СН4):
А 22,4 л; Б 67,2 л; В 44,8 л; Г 44800 мл
6 Визначте кількість речовини, що містить 12,04 · 10 23 молекул хлору:
А 1 моль; Б 0,5 моль; В 2 моль; Г 4 моль
Виберіть кілька правильних відповідей 7 Вкажіть формули газів:
А H2; Б CuO; В Р2О5; Г N2
8 Установіть послідовність зменшення молярних мас речовин:
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
А карбон (ІІ) оксид;
Б вода;
В повітря; Г кисень;
9 Встановіть відповідність між формулою газу та його відносною густиною за воднем:
Формула газу Відносна густина за воднем
|
1 |
|
|
2 |
|
1 СO А 8,5
2 СO2 Б 14
|
3 |
|
3 NH3 В 22
Г 32
10 Обчисліть кількість речовини, яка міститься у воді масою 180 г. 11 Визначте кількість речовини і об’єм сульфур (IV) оксиду (SO2) масою
16 г.
Для відповідей можна використати картку :
Картка відповідей
Кількість речовини. Розрахунки за хімічними формулами.
|
П.І. ____________________ Варіант № __ Клас ________ Дата ____________
10
|
П.І. ____________________ Варіант № __ Клас ________ Дата ____________
10
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ІІІ .Підбиття підсумків, виставлення оцінок.
ІV. Домашне завдання
Підготуватися до семінарського заняття
Урок 38.
Тема:Семінарське заняття«Кількість речовини. Розрахунки за хімічними формулами»
Мета:Закріпити та систематизувати теоретичні знання про хімічні властивості кисню, методи його добування та збирання; виробити навички складання відповідних рівнянь реакцій. Розвивати пізнавальну активність і творчі здібності. Розвивати уміння логічно мислити ; вміння знаходити взаємозв'язок між різними темами в хімії . Розвивати самостійність мислення, мова, пам'ять. Підтримувати стійкий інтерес до хімії.
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку: узагальнення та систематизація знань, умінь і навичок
Обладнання:періодична система хімічних елементів, картки - завдання.
Хід уроку
І. Організаційний етап.
ІІ. Семінар
1. Завдання для фронтальної роботи
Завдання 1.Розрахуйте кількість речовини заліза масою 78 г.
Завдання 2. Визначити кількість атомів феруму у цьому зразку зразку заліза Учні виконують завдання по черзі біля дошки.
2. Завдання для групової роботи
Учні об’єднуються в чотири групи, завдання в групах повторюються з метою взаємоперевірки.Кожній групі на завдання 15 хв.
Завдання для 1,3 групи
|
|
ZnCI2 |
SO2 |
HNO3 |
|
m,г |
135 |
|
|
|
М,г / моль |
|
|
|
|
, моль |
|
|
3 |
|
N,частинок |
|
|
|
|
V, л |
|
24 л |
|
Завдання для груп 2,4 групи.
|
|
NaCI |
CO2 |
HPO3 |
|
m,г |
71 |
|
|
|
М,г / моль |
|
|
|
|
, моль |
|
|
2 |
|
N,частинок |
|
|
|
|
V, л |
|
33,6 л |
|
3. Розв’яжіть задачу
Кожна група одержує завдання (5 хв) Знайдіть масу амоніаку (NH3), об’ємом:
Група 1 - 67,2 л Група 2 – 11,2 л
Група 3 – 44,8 л Група 4 – 3,36 л
Записуємо на дошці відповіді всіх груп
4.Самостійна робота.
Кожен учень отримує картку із завданням
Заповніть таблицю Варіант № 1. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
Н2 |
0,25 моль |
|
|
|
|
СаF2 |
4 моль |
|
|
|
Заповніть таблицю Варіант № 2. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
CO2 |
0,6 моль |
|
|
|
|
FeS2 |
5 моль |
|
|
|
Заповніть таблицю Варіант № 3. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
SO2 |
0,3 моль |
|
|
|
|
MnCl2 |
8 моль |
|
|
|
Заповніть таблицю Варіант № 4. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
NO2 |
0,4 моль |
|
|
|
|
Li2S |
3 моль |
|
|
|
Заповніть таблицю Варіант № 5. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
Н2S |
0,7 моль |
|
|
|
|
MgBr2 |
2 моль |
|
|
|
Заповніть таблицю Варіант № 6. П.І.Б. _____________________
|
|
ν |
m |
V |
N |
|
NH3 |
0,35 моль |
|
|
|
|
K2O |
6 моль |
|
|
|
IV. Підбиття підсумків уроку
Обговорення підсумків уроку, оцінювання учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфів вивчених з теми, відповісти на запитання до них.
Урок 39
Тема:Контрольна робота з теми «Кількість речовини. Розрахунки за хімічними формулами».
Мета:Перевірити рівень знань і вмінь здійснювати розрахунки з використанням понять «кількість речовини», «молярна маса», «молярний об'єм», «відносна густина газу». Виявити рівень навчальних досягнень учнів з теми «Кількість речовини. Розрахунки за хімічними формулами».
Формування компетентностей: Загальнопредметна, саморозвитку і самоосвіти, соціальної, комунікативної.
Тип уроку:Контролю знань, умінь і навичок.
Обладнання: періодична система хімічних елементів.
Хід уроку
І. Організаційний етап.
ІІ. Письмова контрольна робота
Учитель нагадує учням про зміст завдань, час виконання, розподіляє варіанти, наголошує на ключових моментах оформлення відповідей
8 кл. Контрольна робота. Розв’язування задач. Варіант № 1 1 Відносна молекулярна маса сульфур (IV) оксиду дорівнює:
А 48; Б 64; В 96; Г 80
2 Знайдіть відносну густину хлору за гелієм.
3 Знайдіть формулу нітроген оксиду, відносна густина якого за киснем 1,4375.
4 Визначте кількість речовини сульфур (IV) оксиду масою 256 г.
5 Обчисліть об’єм 2 моль сульфур (IV) оксиду.
6 Обчисліть об’єм, що займає 12,8 г сульфур (IV) оксиду.
7 Обчисліть кількість молекул і атомів, що міститься в 11,02 л сульфур (IV) оксиду.
8 кл. Контрольна робота. Розв’язування задач. Варіант № 2 1 Відносна молекулярна маса нітроген (II) оксиду дорівнює:
А 44; Б 60; В 46; Г 30
2 Знайдіть відносну густину нітроген (II) оксиду за киснем.
3 Знайдіть формулу карбон оксиду, відносна густина якого за воднем 14.
4 Визначте кількість речовини нітроген (II) оксиду масою 60 г.
5 Обчисліть об’єм 3 моль нітроген (II) оксиду.
6 Обчисліть об’єм, що займає 22,5 г нітроген (II) оксиду.
7 Обчисліть кількість молекул і атомів, що міститься в 54,88 л нітроген (II) оксиду.
Урок 40
Тема:Основні класи неорганічних сполук.
Мета:Сформувати уявлення про загальну класифікацію неорганічних речовин на підставі отриманих раніше знань про прості та складні речовини.
Основні поняття: неорганічні речовини, кислоти,оксиди, основи, кислоти, солі.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
• На які два класи поділяються всі хімічні речовини?
• На які дві групи поділяються прості речовини?
• На які дві групи можна поділити всі складні речовини?
• Яких речовин більше – складних, чи простих?
• За якими ознаками можна класифікувати складні речовини?
ІІ Мотивування учіння.
Сьогодні ми починаємо вивчати нову тему, яка познайомить вас не тільки з класифікацією складних речовин, але й дозволить дізнатися, як склад і будова впливають на їхні властивості, способи добування і застосування.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Класифікація неорганічних речовин
(складання опорної схеми)
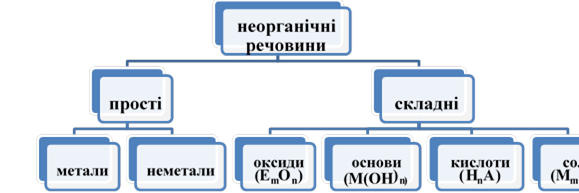
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Розподіліть по класам такі речовини :
MgSO4, Ca(OH)2, CO2, SnCl2, S03, AgCl, ZnO, FeCl3, CuSO4, Hg2O, HgO,
H2CO3, Hg(OH)2, H2S, HNO3, H2O, Al(OH)3,СuО, КОН. H2SO4, СuОН, H2Si03, Ni(OH)2, NiO, P2O5, Ca(NO3)2, Na2CO3, CaO, HBr,NaOH, Zn(OH)2, NaF, Mg3(PO4)2, S02, Cr2O7, FeCl3, Cr(OH)3.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 41
Тема:Оксиди, їх склад і назви. Класифікація оксидів.
Мета:Розширити знання про класифікацію неорганічних речовин на прикладі оксидів та їх класифікацію за складом. Ознайомити із сучасною науковою українською номенклатурою оксидів. Формувати навички використання номенклатури на прикладі назв оксидів. Розвивати навички учнів зі складання формул бінарних сполук на прикладі складання формул оксидів.
Основні поняття: неорганічні речовини, оксиди, основні оксиди, кислотні оксиди, номенклатура.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва, зразки оксидів.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що вивчає хімія?
2. На які дві групи поділяють речовини?
3. Чим відрізняються за складом прості і складні речовини?
ІІ Мотивування учіння.
1. Які хімічні властивості характерні для кисню?
2. Які речовини утворюються в результаті горіння?
3. Що таке оксиди?
4. Які оксиди відносять до основних, а які до кислотних?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Демонстрація №7 Зразки оксидів.
Учні розглядають оксиди в запаяних ампулах, на яких написані формули оксидів та їх назви, розподіляють їх на класи:
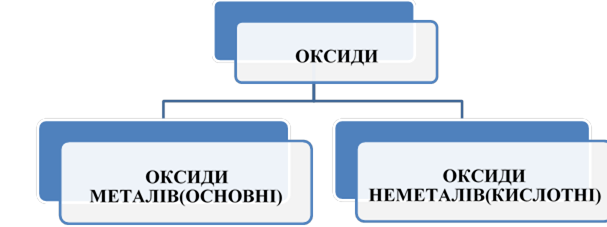
Учитель пояснює як складається назва оксидів:
Назва металу ( валентність) + слово «оксид» Учитель дає назву Na2O- натрій оксид.
Учні дають назви оксидам:
K2O, CuO,Al2O3,CaO
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
• Скласти формули оксидів відповідно до назв: барій оксид, ферум(ІІ)оксид, фосфор(V)оксид, сульфур(ІV) оксид, сульфур(VІ) оксид, силіцій (ІV) оксид.
• Обчислити масові частки Алюмінію і Оксигену в алюміній оксиді.
• Скласти формулу ферум оксиду, що містить 70% Феруму.
• Обчислити відносну густину за киснем і за повітрямсульфур(ІV) оксиду. Яку масу матиме карбон (ІV) оксид обʼємом 67,2 л?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 42
ТемаКислоти, їх склад і назви. Класифікація кислот.
Мета:Розширити знання про класифікацію неорганічних речовин на прикладі кислот. Ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот.
Основні поняття: неорганічні речовини, кислоти, кислотний залишок, основність, оксигеновмісні і безоксигенові кислоти.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:урок засвоєння нових знань. Обладнання і реактиви: зразки кислот.
Хід уроку
І Актуалізація і корекція опорних знань.
5. Що вивчає хімія?
6. На які дві групи поділяють речовини?
7. Чим відрізняються за складом прості і складні речовини?
8. З яким класом складних речовин ви вже знайомі?
9. Які бувають оксиди?
10. Чим відрізняються між собою основні і кислотні оксиди?
11. Які речовини утворюються при взаємодії кислотних оксидів з водою?
12. Формули яких кислот вам відомі?
ІІ Мотивування учіння.
Вчитель записує на дошці формули кислот, які назвали учні.
?- Що ви бачите спільного у складі молекул цих речовин?
ІІІПовідомлення теми, цілей і завдань уроку.
Тема: Кислоти.
Завдання:
1.Вивчити склад, назви і класифікацію кислот.
2.Навчитися визначати валентність кислотного залишку і на основі цього класифікувати кислоти.
3.Отримати знання про добування деяких кислот.
4.Розглянути поширення кислот в природі та значення для життєдіяльності організмів.
5.Ознайомитися з технікою безпеки під час роботи з кислотами.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
(Вчительська презентація проекту „Кислоти” з використанням комп’ютерних технологій.)
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Фронтально:
1.Які речовини відносять до кислот?
2.Що означає вираз „основність кислоти”?
3.На які групи поділяють кислоти за вмістом Оксигену у їх складі?
Робота з картками (індивідуально):
1.З переліку формул речовин виписати формули кислот, назвати їх і прокласифікувати:
NH3, H2CO3, CH4, H2O, HF, H2O2, H2SO4, CaH2, HNO3, NaOH.
2. З переліку формул речовин виписати формули кислот, назвати їх і прокласифікувати:
C3H8, H2S, Cu(OH)2, H3PO4, K2O, HF, H2CO3, C2H6, HCl, H2SO3.
3. З переліку формул речовин:
C2H4, HI, Ba(OH)2, H2SO4, H2O2, HNO3, H2O, H3PO4, Na2O, H2S, KNO3.
виписати формули кислот. Згрупувати їх за такими ознаками: а) складом; б) основністю.
4. Написати формули кислот, яким відповідають такі оксиди:
а) фосфор(V)оксид; б) сульфур(VІоксид); в) карбон(ІV)оксид;
г) нітроген(V)оксид.
5. Складіть формули кислот, які містять такі кислотні залишки:
II III I I IV
-SiO3 ; - AsO4 ; -ClO4 ; -ClO ; -P2O7 .
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Завдання: Оксигеновмісні кислоти мають такий склад: а) Н-2,2%; Р- 34,9%; О-62,9%.
б) Н-0,8%; Мn-45,8%; О-53,4%.
Встановити формули кислот.
Урок 43
Тема:Солі (середні), їх склад і назви.
Мета:Розширити знання про класифікацію неорганічних речовин і номенклатуру неорганічних речовин на прикладі солей. Навчити називати солі, складати їхні формули за валентністю, розпізнавати серед інших класів неорганічних сполук. Розвивати вміння й навички складання формул за валентністю на прикладі солей, виконувати розрахунки.
Основні поняття: неорганічні речовини, солі.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: зразки солей.
Хід уроку
І Актуалізація і корекція опорних знань.
Графічний диктант
(Учитель зачитує фрази, учні, якщо погоджуються з твердженням, записують «—», якщо ні, записують «˄»)
1.Формула нітратної кислоти ![]()
2.Формула натрій оксидуNaO
3.Силікатна кислота – двохосновна кислота.
4.Хлоридна кислота належить до оксигеновмісних сполук
5.Формула сульфатної кислоти ![]()
6.Соляна кислота – це хлоридна кислота
7.![]() – це ферум (II) оксид
– це ферум (II) оксид
8.Сульфатну кислоту ще називають сірчаною кислотою
9.Сучасна назва кислот не відповідає назві кислотних залишків
10.Карбонатна кислота – одноосновна кислота
11.Вода має формулу ![]()
12.Формула карбон (II) оксиду ![]()
Відповідь: —˄—˄˄—˄—˄˄—˄
Взаємоперевірка диктанту.
ІІ Мотивування учіння.
На попередніх уроках ми познайомились із загальними формулами оксидів і кислот.
Розглянемо реакції та визначимо клас відомих нам сполук.
CuO +![]() →
→ ![]() +
+ ![]()
CuO + 2HCl→![]() +
+ ![]()
З наведених
реакцій нам не відомі класи сполук, формули яких ![]() ,
, ![]() . Ці
сполуки належать до класу солей, які ми маємо вивчити на уроці.
. Ці
сполуки належать до класу солей, які ми маємо вивчити на уроці.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Порівняймо розглянуті формули солей із формулами кислот та визначимо спільне у складі їх молекул. Записуємо визначення солей.
Солі – це складні речовини, до складу яких входять атоми металів й кислотні залишки.
За стандартних умов усі солі – тверді кристалічні речовини, різного кольору. Мають різну розчинність у воді.
Звертаємо увагу на те, що солі безоксигенових кислот мають суфікс -иди, солі оксигеновмісних – суфікс –ат. Записуємо загальну формулу солей:
Ме + кислотний залишок → сіль
(Учні наводять приклади солей за назвами кислот. Сучасна назва солей співпадає з назвами кислот)
NaCl – натрій хлорид
![]() -
натрій сульфат KNO3 – калій нітрат
-
натрій сульфат KNO3 – калій нітрат
Аналогічно можна скласти формули солей, знаючи їхню назву, валентність металу й валентність кислотного залишку.
Ферум![]() хлорид
хлорид ![]()
Натрійфосфат ![]()
Алюмінійсульфат![]()
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Скласти формули солей : калій сульфату, кальцій сульфату, магній нітрату, ферум (III) хлориду.
2.«Хто швидше»
Кожен ряд по черзі складає формули солей. Виграє той ряд, який швидше складе формули.
3. Додаткове завдання
Серед одержаних солей виберіть формулу солі з найбільшою молярною масою
Обчисліть масу речовини в 32 г цієї солі
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 44
Тема:Основи, їх склад і назви. Класифікація основ.
Мета:Розширити знання про класифікацію й номенклатуру неорганічних речовин на прикладі основ. Розвивати вміння й навички складання формул неорганічних сполук за валентністю на прикладі основ, складання назв речовин за сучасною українською номенклатурою, розпізнавання класів неорганічних речовин.
Основні поняття: неорганічні речовини, основи.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: зразки основ.
Хід уроку
І Актуалізація і корекція опорних знань.
А) Конкурс дартс. Хто влучніше дасть визначення термінів ( працють дві команди).
1 команда.Основні оксиди, кислоти.
2 команда. Кислотні оксиди, безоксигенові кислоти. Б) Знайди зайве.
1 команда.CuSO4, H2SO4, H3PO4, HNO3
2 команда.Na2O, HCl, Al2O3, CuO
Учитель підводить підсумки роботи команд, визначає переможця.
- Які класи неорганічних сполук вам відомі?
ІІ Мотивування учіння.
Учитель пише формули речовин на дошці: Na2O, HCl, KOH, H2SO4, SO3, Ca(OH)2.
Учні вибирають знайомі речовини ( кислоти, оксиди ) і дають їм назви.
Учитель звертає увагу учнів на речовини, які залишилися і порівнюють будову їх молекули.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Учитель пояснює, що група « ОН» має назву гідроксильної групи.
Учні спільно з учителем роблять висновок, будови молекули основ – на першому місці обов’зково стоїть метал, а за ним група « ОН».
Учитель пояснює як складається назва основ: Назва металу ( валентність) + слово «гідроксид» Учитель дає назву NaOH- натрій гідроксид.
Учні дають назви основам:
KOH, Cu(OH)2,Al(OH )3,Ca(OH )2
Калій гідроксид, купрум ( ІІ ) гідроксид, алюміній гідроксид, кальцій гідроксид.
Учитель звертає увагу учнів на кількість груп « ОН» у складі основ. Розбирають на прикладі NaOH, Ca(OH)2, Al(OH)3 визначають валентність металу, учні відповідають, що кількість гідроксильних груп залежить від валентності металу.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Учні працюють у групах. ( 5 хвилин )
Конкурс « Хімічне лото»
Скласти формули речовин і дати їм назви.
1 група.
2група.
Учні обирають учня, який буде відповідати - за допомогою кубика.
Кожна група дає відповідь за чергою,учні інших груп приймають участь у оцінці знань інших учнів.
Конкурс « Ворожіння на ромашці».
На дошці прикріплена «ромашка» із завданнями на зворотному боці кожної пелюстки.По одному учню з кожної команди знімають пелюстки по черзі.
Завдання на пелюстках:
1. На які групи поділяються кислоти?
2. Дати назви наступним оксидам:CaO,Al2O3,SO2.
3. Що таке луги? Наведіть приклад.
4. Дати назви кислотам - H2SO4, HNO3, H2S.
5. Як утворюються кислотні оксиди?
6. Як утворюються основні оксиди?
7. Як можна визначити кислоту?
8. На які групи поділяються основи?
9. Які типи хімічних реакцій вам відомі?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 45
Тема:Фізичні й хімічні властивості оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
Мета:Ознайомити учнів з фізичними й хімічними властивостями оксидів. Дати поняття індикаторів, пояснити значення їх використання для визначення кислот і основ. Розвивати логічне мислення учнів на прикладі порівняння взаємодії кислотних і основних оксидів з водою, кислотами, лугами, іншими оксидами. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів.
Основні поняття: неорганічні речовини, оксиди, індикатори, оснóвні і кислотні оксиди, несолетворні й солетворні оксиди.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва, лабораторне обладнання, хімічні реактиви.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Що вивчає хімія?
2. На які дві групи поділяють речовини?
3. Чим відрізняються за складом прості і складні речовини?
4. Перерахуйте основні класи неорганічних речовин.
5. Що таке оксиди?
6. Які оксиди відносять до основних, а які до кислотних?
ІІ Мотивування учіння.
1. Як розрізнити речовини, які відносяться до різних класів неорганічних речовин?(за складом)
2. А якщо формула речовини не відома? (за властивостями)
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Демонстрація №8Взаємодія кислотних і основних оксидів із водою. Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 1). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)2. Виділення теплоти засвідчує, що відбулася реакція. СаО + Н2О = Са(ОН)2
Мал. 1. Гашення вапна
• Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію: Na2О + Н2О = 2NaOH
Натрій гідроксид
Li2О + Н2О = 2LiOH
Літій гідроксид

водою чи ні) називаються основними.
Усі основні оксиди за стандартних умов — тверді речовини.
Речовини, які змінюють своє забарвлення під дією кислот (або лугів), називаються індикаторами.
Розчини їдких лугів мають здатність змінювати забарвлення індикаторів. Так, у лужному середовищі фіолетовий колір лакмусу змінюється на синій, оранжевий колір метилоранжу — на ясно-жовтий, а безбарвний розчин фенолфталеїну стає малиновим. Демонстрація:
Взаємодія фосфор(V) оксиду з водою. Дія водного розчину добутої речовини на індикатори.
Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води.
Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ортофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота: Р2О5 + Н2О = 2НРО3
холодна Метафосфатна кислота
Р2О5 + ЗН2О = 2Н3РО4
гаряча Ортофосфатна кислота
Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду СО2або сульфур(VI) оксиду SO3, також утворюються кислоти. CO2 + H2O = H2CO3
Карбонатна кислота
SO3 + Н2O = H2SO4
Сульфатна кислота
Кислоти діють на індикатори (речовини-визначники).
Дослід 3. У три пробірки з розчином сульфатної кислоти H2SО4 додамо по кілька крапель індикаторів: у першу — лакмусу, розчин стає червоним; у другу — метилового оранжевого, розчин стає рожево-червоним; у третю — фенолфталеїну, розчин залишається безбарвним.
Лакмус, метиловий оранжевий (метилоранж), фенолфталеїн — індикатори на кислоти і луги
Оксиди взаємодіють з речовинами протилежної хімічної природи:
1. Основні оксиди взаємодіють з кислотними оксидами: СаО + СО2 =СаСО3
2. Основні оксиди взаємодіють з кислотами:
СаО +H2SO4=СаSO4 +H2О
3. Кислотні оксиди взаємодіють з основами:
СО2 +2NaOH = Na2СО3+H2О
Реакції, під час яких сполуки обмінюються своїми складовими частинами, називають реакціями обміну.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Користуючись підручником скласти схему найважливіших хімічних властивостей оксидів і навести приклади хімічних реакцій.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 46
Тема:Оксиди в природі. Використання оксидів.
Мета:Поглибити знання про класи неорганічних сполук на прикладі фізичних і хімічних властивостей оксидів. Розвивати вміння й навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів, навички виконання розрахунків за хімічними формулами. Ознайомити учнів з поширенням оксидів у природі, показати зв'язок між властивостями та сферами використанням оксидів.
Основні поняття: неорганічні речовини, оксиди, індикатори, оснóвні і кислотні оксиди, несолетворні й солетворні оксиди .
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку:узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Які сполуки називають оксидами? Як їх класифікують? Наведіть приклади.
2. Перелічіть хімічні властивості оксидів.
3. Які реакції відносять до реакцій обміну? Наведіть приклади.
ІІ Мотивування учіння.
ІІІПовідомлення теми, цілей і завдань уроку.
ІV. Повторення і узагальнення понять, їх систематизація.
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 кл. Оксиди |
1 - 10 |
0,5 |
30 - 35 хв. |
|
11 - 12 |
1 |
||
|
13 |
2 |
8 кл. Оксиди Варіант № 1
Виберіть одну правильну відповідь
1 Вставте пропущені слова «Оксиди – це ... речовини, утворені атомами ... елементів, одним з яких обов’язково є ... »:
А складні...двох...Оксиген; В складні...двома...Гідроген; Б складні...трьома...Оксиген; Г прості…двома…Гідроген
2 Вкажіть сполуки при взаємодії яких утворюються основні оксиди:
А метал та Оксиген; В метал та кисень;.
Б неметал та кисень; Г неметал та Оксиген
3 Вкажіть вид оксиду, який при взаємодії з водою утворює луг:
А амфотерний; Б несолетворний; В кислотний; Г основний
4 Вкажіть формулу нітроген (II) оксиду:
А N2O; Б NO2; В NO; Г N2O3
5 Укажіть назву оксиду СаО:
А калій оксид; Б карбон(II) оксид; В кальцій оксид; Г карбон(IV) оксид
6 Вкажіть значення відносної молекулярної маси натрій оксиду:
А 62 г/моль; Б 23 г/моль; В 16 г/моль; Г 30 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть групи, що складаються з оксидів: А HCl, NaH, CaO; Б CO2, ZnO, SO3; В BaO, H2SO4, Г N2O, P2O5 CO; Na2О
8 Виберіть з переліку формули кислотних оксидів:
А SO3; Б CO2; В ZnO; Г BaO
9 Випишіть речовини, що взаємодіють з водою:
А SiO2; Б Na2O; В CO2; Г Al2O3
10 Розмістіть формули оксидів по мірі зростання валентності металу:
А SnO2; Б BeO; В Ag2O; Г Al2O3
11 Встановіть відповідність між формулами речовин та їх назвами:
Формула речовини Назва
|
1 |
|
|
2 |
|
|
3 |
|
1 CO2; А кальцій оксид;
2 CaO; Б калій оксид;
3 К2O; В карбон (ІІ) оксид;
Г карбон (ІV) оксид
12 Закінчіть рівняння хімічної реакції: SO2 + H2O →
13 Здійсніть перетворення за схемою Ca → CaO → Ca(OH)2
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 кл. Оксиди |
1 - 10 |
0,5 |
30 - 35 хв. |
|
11 - 12 |
1 |
||
|
13 |
2 |
8 кл. Оксиди Варіант № 2
Виберіть одну правильну відповідь
1 Вставте пропущені слова: «Основні оксиди - це..., яким відповідають...:»:
А ... сполуки ... солі; В ... оксиди ... основи;
Б ... основи ... солі; Г ... оксиди ... кислоти
2 Вкажіть речовину в результаті взаємодії якої з металом чи неметаломутворюються оксиди:
А Сульфур; Б кисень; В Гідроген; Г Оксиген
3 Вкажіть вид оксиду, який при взаємодії з водою утворює кислоту:
А основний; Б кислотний; В несолетворний; Г амфотерний
4 Вкажіть формулу магній оксиду:
А Hg2O; Б MnO2; В MoO3; Г MgO
5 Укажіть назву оксиду N2О:
А нітроген(I) оксид; В натрій оксид;
Б натрій(IV) оксид; Г нітроген(II) оксид
6 Вкажіть значення відносної молекулярної маси кальцій оксиду:
А 40 г/моль; Б 55 г/моль; В 56 г/моль; Г 28 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть групи, що складаються з оксидів:
А CO2, BаО, CaO, Б ZnO, SO3, KJ; В BaO, P2O5,
CO;
8 Виберіть з переліку формули основних оксидів:
Г N2O, Na2S, Al2O3 А Na2O; Б SiO2; В CаO; Г Br2O7
9 Випишіть речовини, що взаємодіють з водою:
А SiO2; Б SO3; В FeO; Г K2O
10 Розмістіть формули оксидів по мірі зростання валентності металу:
А Fe2O3; Б Li2O; В PbO2; Г CaO
11 Встановіть відповідність між формулами речовин та їх назвами:
Формула речовини Назва
|
1 |
|
|
2 |
|
|
3 |
|
1 SO3; А ферум (III) оксид;
2 Fe2O3; Б калій оксид;
3 CO2; В сульфур (VІ) оксид;
Г карбон (ІV) оксид
12 Закінчіть рівняння хімічної реакції: BaO + H2O →
13 Здійсніть перетворення за схемою SО2 → SO3 → H2SO4
VГрупова робота з підручником
Використовуючи матеріал підручника, складіть схему поширення оксидів у природі, відшукайте зв'язок між властивостями та сферами використанням оксидів.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 47
Тема:Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
Мета:Закріпити знання про хімічні властивості оксидів. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей оксидів. Розвивати вміння й навички виконання розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
Основні поняття: неорганічні речовини, рівняння хімічних реакцій, маса, кількість речовини, об’єм газу (н.у.), реагенти, продукти реакції.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: урок вивчення нового матеріалу та розвитку вмінь. Обладнання і реактиви:періодична система хімічних елементів Д.І.Менделєєва.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Які сполуки називають оксидами? Як їх класифікують? Наведіть приклади.
2. Перелічіть хімічні властивості оксидів.
3. Сформулюйте закон збереження маси речовини.
4. Які речовини називають реагентами, а які продуктами реакції?
5. За якою формулою можна розрахувати масу?
6. За якою формулою можна розрахувати обʼєм?
7. За якою формулою можна розрахувати кількість речовини?
ІІ Мотивування учіння.
На виробництві та в побуті потрібно вміти розрахувати масу або об’єм речовини , що вступає або утворилася в хімічних реакціях .
Тому необхідно навчитися проводити розрахунки за хімічними рівняння ми .
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Визначте масу Сульфур (VI) оксиду , яка потрібна для реакції з кальцій оксидом кількістю речовини 4 моль .
![]() Дано
Розв’язування
Дано
Розв’язування
n(CaO) = 4 моль 1.Запишемо рівняння реакцій
![]()
m(SO3) = ? 4 мольх г
CaO + SO3 = CaSO4
1 моль 1 моль
80г![]() моль
моль
80 г
2. Знайдемо масу Сульфур (VI) оксиду за пропорцією.
![]() 4моль
хг
4моль
хг
1моль 80г
х ![]() 320г
320г
Відповідь: m(SO3) = 320 г.
Який об’єм кисню (н.у.) було взято для реакції , якщо при цьому утворився фосфор (V) оксид масою 28,4 г?
Для розв'язування розрахункової задачі використовуй такий алгоритм:
1. Запиши скорочену умову задачі.
2. Склади рівняння хімічної реакції.
3. Підкресли в рівнянні формули речовин, про які йдеться в умові задачі (відомої і невідомої).
4. Над формулами речовин з умови задачі запиши відому величину й невідому з відповідними одиницями вимірювання (йдеться лише про чисті речовини, без домішок).
5. Під формулами речовин з відомою і невідомою величиною запиши відповідні значення цих величин, знайдені за рівнянням реакції.
6. Склади й розв'яжи пропорцію на підставі двох даних, узятих з рівняння реакції, і двох даних — з умови задачі.
7. Запиши повне формулювання відповіді.
ВИСНОВКИ
Рівняння хімічної реакції відображає матеріальний баланс процесу, тому воно дає змогу здійснювати розрахунки маси, об'єму або кількості речовини продуктів реакції чи вихідних речовин.
Щоб розв'язати хімічну задачу треба правильно написати формули речовин, вміти правильно скласти рівняння хімічної реакції і пам'ятати, що розв'язування задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин.
Для розв'язування задачі треба знати формули, що виражають взаємозв'язок між величинами (див. форзац).
Можна використовувати будь-які величини, але для кожної з речовин (чи взятої з умови задачі, чи з рівняння реакції) потрібно застосовувати одну й ту ж саму величину.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. При взаємодії фосфор (V) оксиду з водою утворилася ортофосфатна кислота масою 19,6 г. Яку масу оксиду взяли для реакції?
2. Яка кількість карбон (І V) оксиду утворюється при розкладі карбонатної кислоти кількістю речовини 0,4 моль?
3. При прожарюванні на повітрі тривалентного металу масою 10,8 г отримали оксид масою 20,4 г. Який метал був взятий для реакції?
4. Скільки потрібно води для взаємодії з 56 г кальцій оксиду?
5. Який об’єм карбон (І V) оксиду виділиться при спалюванні метану в 11,2л кисню (н.у.)? (Реакція відбувається за схемою: СН4 + О2 → СO2 + Н2О)
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 48
Тема:Фізичні й хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами,основами й солями. Поняття про ряд активності металів.
Мета:Ознайомити учнів з фізичними й хімічними властивостями кислот. Розширити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот, їх узаємодіїз металами, основними оксидами, основами й солями. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот.
Основні поняття: Ряд активності металів,реакції заміщення й обміну.Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: лакмус, метиловий оранжевий, фенолфталеїн, сульфатна кислота, хлоридна кислота, магній, цинк, мідь,купрум(ІІ)оксид.
Хід уроку
І Актуалізація і корекція опорних знань.
1) Що таке кислоти?
2) Як класифікують ці речовини?
3) Чи мають різні кислоти щось спільне у будові своїх молекул?
ІІ Мотивування учіння.
Завдяки наявності Гідрогену в молекулах кислот, водні розчини їх виявляють спільні властивості. Сьогодні ми познайомимося з найхарактернішими з цих властивостей.
ІІІПовідомлення теми, цілей і завдань уроку.
Тема: Хімічні властивості кислот.
Мета: вивчити характерні властивості кислот.
Завдання:
1) Дія кислот наіндикатори.
2) Особливості взаємодії з металами.
3) Взаємодія з основними оксидами.
4) Реакція обміну.
5) Правила техніки безпеки під час роботи з кислотами.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Лабораторний дослід № 6. Дія водних розчинів кислот на індикатори. Інструктивна картка
У три пробірки з сульфатною кислотою додаємо по кілька крапель різних індикаторів:
У І-лакмус;
ІІ-метиловий оранжевий; ІІІ-фенолфталеїн.
?-Чи відбулись хімічні реакції?
-Так, оскільки відбулася зміна кольору (одна з ознак хімічних реакцій), можна зробити висновок, що хімічні реакції відбулися. ?- Про що ми дізналися, досліджуючи дію кислот на індикатори?
- Лакмус змінив забарвлення на червоний, метилоранж-на рожевий, фенолфталеїн забарвлення не змінив.
?- То що ж це за речовини-індикатори?
- Це речовини, які змінюють своє забарвлення під впливом кислот.
Зробіть висновок.
Бесіда
2) Дія кислот на метали.
Демонстрація :
Mg Zn Cu
Бесіда:
?- Чи відбувається хімічна взаємодія?
- Так, але тільки у І і ІІ пробірці.
?- За якою ознакою зроблений висновок?
- Однією з ознак хімічних реакцій є виділення газу.
?- Чому ж не відбувається взаємодія міді з хлоридною кислотою?
(пояснення вчителя)
Кислоти реагують не з усіма металами однаково. Не всі метали здатні витіснювати водень з кислот. За своєю активністю метали можна розмістити у так званий витискувальний ряд металів, який розміщено в нашому кабінеті над дошкою (він є і в підручнику).
На основі експериментальних даних цей ряд склав М.М. Бекетов. Метали в цьому ряду розміщені в порядку зменшення їх активності. Цей ряд розділений на ліву і праву половину воднем. Метали, що стоять зліва від водню, здатні витісняти його з кислот ( крім нітратної-під час взаємодії нітратної кислоти з металами замість водню виділяються інші гази), а ті, що стоять справа від водню, ні.
Тепер ви повинні завжди звертатись до цього ряду, щоб правильно складати рівняння хімічних реакцій.
?- То які ж продукти реакції утворилися під час взаємодії металів з кислотами?
- Один з утворених продуктів (водень) сумнівів не викликає, оскільки ви бачили виділення пухирців газу, і, підпаливши його, ви чули характерний звук.
Щоб дослідити, який ще продукт реакції утворився, я пропоную вам ще один дослід. Демонстрація :
На годинникове скельце наноситься декілька крапель розчину з І чи ІІ пробірки, в якій магній або цинк прореагували з хлоридною кислотою, і тримаємо щипцями скельце над полум’ям спиртівки. З розчину випарюється вода і на скельці стають помітними кристали.
Пояснення вчителя.
Це кристали нової складної речовини, що утворилася в результаті реакції, солі- магнійхлориду або цинкхлориду.
Записуємо рівняння хімічної реакції:
І ІІ І
Mg + 2HCl = MgCl2 + H2↑
!- Реакцію взаємодії цинку з хлоридною кислотою запишіть самостійно.
?- До якого типу відноситься ця хімічна реакція
3) Взаємодія з основними оксидами.
Демонстрація :
HCl

чорний осад→розчин зеленкувато-блакитного забарвлення
↓ випарювання
↓
зеленкувато-блакитні кристали t
CuO + 2HCl = CuCl2 + H2O
Купрум(ІІ) хлорид
АБ + СД = АД + ВС реакція обміну!
Самостійно:
Дописати рівняння реакцій:
ZnO + HNO3 =
Fe2O3 + H2SO4 =
?- То в чому суть реакції обміну?
- Реакції обміну- це реакції між двома складними речовинами, в результаті яких вони обмінюються своїми складовими частинами.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1) Які хімічні властивості кислот вам відомі?
2) В якому разі буде виділятися водень під час змішування? a) Zn + H2SO4 ;
б) Al + HCl ;
в) Hg + HCl ;
г) Mg + HNO3 ;
д) Ba + H3PO4.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 49
Тема:Реакції заміщення й обміну.Хлоридна кислота. Правила безпеки під час роботи з кислотами. Використання кислот.
Мета:Закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти. Поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот. Розвивати навички експериментальної роботи з кислотами, повторити правила техніки безпеки під час роботи з кислотами. Ознайомити учнів зі сферами використання кислот.
Основні поняття: Ряд активності металів,реакції заміщення й обміну.Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: лакмус, метиловий оранжевий, фенолфталеїн, сульфатна кислота, хлорид на кислота, магній, цинк, мідь,купрум(ІІ)оксид.
Хід уроку
І Актуалізація і корекція опорних знань.
Клас ділиться на 2 команди. Між ними розпочинається змагання.
1-й конкурс „Естафета”
Від кожної команди виділяється по 3 учасника.
Завдання:
(Завдання в конвертах. Витягають-кому яке попаде.)
Напишіть рівняння реакцій, що характеризують хімічні властивості кислот:
І команда - сульфатної;
ІІ команда - ортофосфатної.
Завдання виконується на час - хто швидше. Кожне рівняння реакції записують учасники по черзі. Перемагає команда, яка найшвидше виконала завдання. Враховується грамотність запису.
2-й конкурс „Експеримент”
Від кожної команди виділяється по 2 учасника.
Завдання:
( Завдання в конвертах. Першим тягне представник команди-переможця І конкурсу.)
І команда: Виконайте 2 досліди, що підтверджують хімічні властивості сульфатної кислоти.
ІІ команда: Доведіть експериментально (двома способами), що оксид кальцію-основний оксид.
Реактиви для дослідів знаходяться на демонстраційному столі в одному лотку.
Оцінюється:
1) правильність вибору реактивів;
2) правильність вибору хімічних взаємодій;
3) правильність написання рівнянь хімічних реакцій;
4) швидкість;
5) акуратність;
6) дотримання правил проведення хімічного експерименту.
ІІ Мотивування учіння.
?- Що таке властивості речовин?
- Це ознаки, за якими різні речовини подібні між собою, або відрізняються одна від одної.
На попередньому уроці ви вивчили загальні властивості кислот.
?- Чи будуть вони характерними для хлоридної кислоти?
?- Чи мають окремі кислоти, в тому числі і хлоридна кислота, якісь свої специфічні властивості, що відрізняють її від інших кислот?
ІІІПовідомлення теми, цілей і завдань уроку.
Тема:Реакції заміщення й обміну.Хлоридна кислота. Правила безпеки під час роботи з кислотами. Використання кислот.
Мета: Вивчити характерні і специфічні властивості хлоридної кислоти, з’ясувати її застосування.
Завдання:
1.Вивчити характерні властивості:
а) дію на індикатори;
б) взаємодію з металами;
в) взаємодію з основними оксидами.
2.Провести лабораторне дослідження взаємодії хлоридної кислоти з металами.
3.Вивчити специфічну властивість.
4.Познайомитись з застосуванням хлоридної кислоти.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Учитель: зпрогнозуйте, будь ласка, властивості хлоридної кислоти.
Учні перечислюють:
- дія на індикатори;
- взаємодія з металами;
- взаємодія з основними оксидами.
-
Демонстрація 1. Дія хлоридної кислоти на індикатори.
Лабораторнийдослід № 7
„Взаємодія хлоридної кислоти з металами”
MgZnCu
У висновку вказати:
1) Що спостерігається?
2) Чому?
3) Запишіть відповідні рівняння хімічних реакцій.
Демонстрація
t
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Крім загальних хімічних властивостей, окремі кислоти мають ще свої специфічні властивості.
Демонстрація.
Якісна реакція на хлоридну кислоту.
HCl + AgNO3 = AgCl↓ + HNO3
білий сирнистий осад
Висновок учителя:
Таким чином чи всі кислоти мають спільні властивості.
Чому?
Загальні властивості їх значною мірою обумовлені спільністю їх складу (атоми Гідрогену).
Але кожна кислота - це індивідуальна речовина, яка проявляє індивідуальні властивості.
Є такі світоглядні поняття – одиничне, особливе і загальне. Як же можна цими поняттями описати кислоти?
↓
Індивідуальна кислота → Клас кислоти → Складні речовини
Так встановлюються певні взаємозв’язки речовин, їхня підпорядкованість.
Самостійна робота учнів з підручником:
Застосування хлоридної кислоти.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1. Які загальні властивості проявляє хлоридна кислота?
2. За допомогою якого реактива можливо визначити наявність хлоридної кислоти?
3. Який об’єм хлороводню можна отримати при взаємодії 2 моль натрійхлориду з сульфатною кислотою при сильному нагріванні?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 50
Тема:Хімічні властивості кислот.
Мета:закріпити знання про хімічні властивості кислот у процесі виконання тренувальних вправ і експериментальних задач.
Основні поняття: Ряд активності металів,реакції заміщення й обміну. Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:семінарське заняття.
Обладнання і реактиви: хлоридна кислота, ферум(ІІІ)оксид, кальцій карбонат, кальцій, барій оксид,купрум(ІІ)оксид.
Хід уроку
І Коректуючи частина.
( усна перевірка знань) 10 хвилин
Учні працюють в групах. Запитання надруковані і роздані групам.
Опитування проводить консультант по запитанням коректуючої частини уроку. ( не виключається можливість консультантам самостійно ставити запитання з теми)
Під час усного опитування консультант оцінює відповіді і записує оцінки в облікову картку консультанта.
|
№ п/п |
Зміст запитань і завдань |
Прізвища членів групи |
||
|
|
|
|
||
|
|
|
|
|
|
|
Загальна сума балів |
|
|
|
|
|
Оцінка |
|
|
|
|
Крім відповідей на усні запитання, консультант вносить до картки оцінки за виконання письмових і експериментальних завдань.
Запитання коректуючої частини:
1. Дати визначення кислот. Навести приклади.
2. Як класифікують кислоти? Навести приклади.
3. Назвіть хімічні властивості кислот.
4. В чому полягає особливість взаємодії кислот з металами?
5. Які реакції відносять до реакцій обміну? Наведіть приклади.
ІІ Навчаюча частина. (20 хвилин)
У процесі роботи консультант спостерігає, як члени його групи виконують письмові і експериментальні завдання і оцінює їх роботу.
Після завершення навчаючої частини консультанти здають вчителеві облікові картки, в яких, крім балів чи оцінок за кожне із завдань, виставлена підсумкова оцінка кожному члену групи за результатами групової роботи на занятті.
Завдання навчаючої частини
Кожна група одержує надруковані завдання і набір реактивів.
1. Напишіть формули кислот, що відповідають таким оксидам: CO2, P2O5, NO2, SiO2, SO3, SO2.
2. З якими з перелічених речовин буде реагувати хлоридна кислота:
срібло, ферум(ІІІ)оксид, кальцій карбонат, кальцій, барій оксид? Напишіть рівняння можливих реакцій, вкажіть типи реакцій.
3. Як з купрум(ІІ)оксиду добути купрум(ІІ) хлорид? Провести дослід. Записати рівняння реакції.
ІІІ Контролююча частина. (15 хвилин)
Учні отримують індивідуальні завдання (картки) і самостійно працюють над їх виконанням.
Варіант І (для консультантів)
Маємо речовини: алюміній оксид, алюміній, сірку, мідь, магній, ферум(ІІ) оксид, сульфур(VI)оксид. Які з цих речовин будуть реагувати з сульфатною кислотою? Складіть рівняння можливих реакцій, назвіть утворені солі.
Варіант ІІ (для учнів, чиї результати групової діяльності консультант оцінив на „відмінно” та „добре”)
Маємо речовини: хром (ІІІ) оксид, барій оксид, вуглець, цинк, фосфор(V) оксид, ферум(ІІІ)оксид, ртуть. Які з них будуть реагувати з хлоридною кислотою? Складіть рівняння можливих реакцій. Назвіть утворені солі.
Варіант ІІІ (для учнів, чиї результати групової діяльності консультант оцінив на „відмінно” та „добре”)
Складіть рівняння можливих реакцій, назвіть солі:
а) цинк оксид + нітратна кислота →;
б) алюміній + сульфатна кислота →;
в) карбон(ІV)оксид + ортофосфатна кислота →;
г) срібло + хлоридна кислота →;
д) аргентумоксид + хлоридна кислота →;
е) кальцій + ортофосфатна кислота →.
Варіант ІV (для учнів, чиї результати групової діяльності консультанти оцінили „задовільно”)
Напишіть рівняння реакцій у тих випадках, де вони можливі:
Ag + HCl →
Fe2O3 + HCl →
CaCO3 + HCl →
BaO + HCl →
Ca + HCl →
CuO + HCl →.
Урок 51
Тема:Контрольна робота з теми «Класи неорганічних сполук. Фізичні й хімічні властивості оксидів, кислот». (проміжне оцінювання)
Мета:Узагальнити й систематизувати знання учнів про класифікацію неорганічних сполук, фізичні та хімічні властивості оксидів і кислот. Визначити рівень навчальних досягнень учнів з цієї теми.
Формування компетентностей:Загальнопредметна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку : контроль та коригування знань, уміньі навичок.
Обладнання : картки – завдання
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
Проміжне оцінювання з теми
«Оксиди. Кислоти. Розв’язування розрахункових задач за рівнянням реакцій»
І варіант
Виберіть одну правильну відповідь
1 Вставте пропущені слова «Оксиди – це ... речовини, утворені атомами ... елементів, одним з яких обов’язково є ... »:
А складні...двох...Оксиген; В складні...двома...Гідроген; Б складні...трьома...Оксиген; Г прості…двома…Гідроген
2 Вкажіть сполуки при взаємодії яких утворюються основні оксиди:
А метал та Оксиген; В метал та кисень;.
Б неметал та кисень; Г неметал та Оксиген
3 Вкажіть вид оксиду, який при взаємодії з водою утворює луг:
А амфотерний; Б несолетворний; В кислотний; Г основний
4 Вкажіть формулу нітроген (II) оксиду:
А N2O; Б NO2; В NO; Г N2O3
5 Укажіть назву оксиду СаО: А калій оксид; Б карбон(II) оксид; В кальцій оксид; Г карбон(IV) оксид
6 Вкажіть значення відносної молекулярної маси натрій оксиду:
А 62 г/моль; Б 23 г/моль; В 16 г/моль; Г 30 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть групи, що складаються з оксидів: А HCl, NaH, CaO; Б CO2, ZnO, SO3; В BaO, H2SO4, Г N2O, P2O5 CO; Na2О
8 Виберіть з переліку формули кислотних оксидів:
А SO3; Б CO2; В ZnO; Г BaO
9 Випишіть речовини, що взаємодіють з водою:
А SiO2; Б Na2O; В CO2; Г Al2O3
10 Розмістіть формули оксидів по мірі зростання валентності металу:
А SnO2; Б BeO; В Ag2O; Г Al2O3
11 Встановіть відповідність між формулами речовин та їх назвами:
Формула речовини Назва
|
1 |
|
|
2 |
|
|
3 |
|
1 CO2; А кальцій оксид;
2 CaO; Б калій оксид;
3 К2O; В карбон (ІІ) оксид;
Г карбон (ІV) оксид
12 Закінчіть рівняння хімічної реакції: SO2 + H2O →
13 Здійсніть перетворення за схемою Ca → CaO → Ca(OH)2
14 Обчисліть об’єм карбон (IV) оксиду (н.у.), що утвориться при згоранні вуглецю масою 1,8 г.
Проміжне оцінювання з теми
«Оксиди. Кислоти. Розв’язування розрахункових задач за рівнянням реакцій» ІІ варіант
Виберіть одну правильну відповідь
1 Вкажіть складові частини кислот:
А два елементи, одним з яких є ОксигенВ атом металу та гідроксогруп
Б атоми металу і кислотного Г Гідроген і кислотний залишок залишку;
2 Вкажіть, як необхідно готувати розчини кислот:
А лити воду в кислоту; В лити кислоту в воду
3 Вкажіть формулу сульфітної кислоти:
А Н2SiO3; Б Н2SO4; В Н2S; Г Н2SO3
4 Вкажіть валентність кислотного залишку ортофосфатної кислоти:
А II; Б III; В IV; Г I
5 Вкажіть назву кислотного залишку - NO3:
А нітрит; Б нітрид; В нітрат; Г нітроген
6 Вкажіть значення відносної молекулярної маси бромідної кислоти:
А 36 г/моль; Б 81 г/моль; В 80 г/моль; Г 82 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть властивості характерні для кислот:
А важчі за воду; Б рідини; В нерозчинні у воді; Г гази
8 Вкажіть групи, що складаються з кислот:
А НCl, NaH, Б НNO2, Н2S, HJ; В BaO, HNO3, Г HF, HNO3 Н2SO CaO; CH4;
9 Виберіть з переліку формули кислотних оксидів:
А SrO; Б SiO2; В P2O3; Г MgO
10 Випишіть речовини, з якими реагують кислоти:
А Cu; Б Zn; В CuO; Г СO
11 Розмістіть формули кислот по мірі зростання їх основності:
А H3PO4; Б Н2СО3; В HCl; Г H4P2O7
12 Встановіть відповідність між формулою кислоти та її характеристикою:
Формула Класифікація
|
1 |
|
|
2 |
|
|
3 |
|
1 HCl; А двоосновна, оксигеновмісна;
2 H2SO4; Б чотириосновна, оксигеновмісна;
3 H3PO4; В одноосновна, безоксигенова;
Г трьохосновна, оксигеновмісна
13 Встановіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
|
1 |
|
|
2 |
|
|
3 |
|
1 Mg + 2HCl → А MgSO4 + H2O;
2 MgO + H2SO4 → Б MgCl2 + H2;
3 2Mg + Cl2 → В MgCl2 + H2O;
Г MgCl2
14 Закінчіть рівняння хімічної реакції: Pb + H2SO4 →
15 Здійсніть перетворення за схемою: SO2 → H2SO3 → BaSO3
16 Обчисліть масу цинк хлориду, що утвориться при взаємодії 130г цинк оксиду з хлоридною кислотою.
Урок 52
Тема:Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.
Мета:Ознайомити учнів з фізичними властивостями основ, закріпити знання про класифікацію основ на розчинні й нерозчинні. Розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі основ, показати дію лугів на індикатори. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ.
Основні поняття: реакція нейтралізації, термічний розклад.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: лакмус, метиловий оранжевий, фенолфталеїн, натрій гідроксид,купрум(ІІ)сульфат, вапняна вода, сульфатна кислота, хлоридна кислота.
Хід уроку
І Актуалізація і корекція опорних знань.
1) Які речовини називають основами?
2) Як ці речовини класифікують?
ІІ Мотивування учіння.
На основі знань про хімічні властивості оксидів і основ, зпрогнозуйте хімічні властивості основ.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Кожен учень отримує роздруковані таблиці „Хімічні властивості основ.”
|
Основа |
|
|
Розчинна (луг) |
Нерозчинна |
|
1. Дія на індикатори |
|
|
|
|
|
2.Взаємодія з кислотами |
|
|
|
|
|
3. Взаємодія з кислотними оксидами |
|
|
|
|
|
4. Розклад під час нагрівання |
|
|
|
|
Таблиці заповнюються учнями протягом уроку.
Лабораторний дослід № 2. Дія водних розчинів лугів на індикатори. Інструктивна картка
У три пробірки з натрій гідроксидом додаємо по кілька крапель різних індикаторів:
У І-лакмус;
ІІ-метиловий оранжевий; ІІІ-фенолфталеїн.
?-Чи відбулись хімічні реакції?
?- Про що ми дізналися, досліджуючи дію кислот на індикатори?
-?- То що ж це за речовини-індикатори?
Зробіть висновок.
Лакмус метилоранж фенолфталеїн
NaOH NaOH NaOH
Висновок: лакмус → синій;
метилоранж → жовтий; фенолфталеїн → малиновий.
Дія індикаторів відбувається в розчинах!
?- Чи буде змінюватися колір індикаторів при дії на них нерозчинних основ? 1) Лабораторний дослід №3 Взаємодія лугів із кислотами в розчині. (Самостійна робота учнів за інструктивними картками в підручнику під наглядом учителя.)
2) Лабораторний дослід №4Взаємодія нерозчинної основи з кислотою.
(Самостійна робота учнів за інструктивними картками в підручнику під наглядом учителя.)
Лабораторний дослід №5Термічне розкладання нерозчинних основ.
(Самостійна робота учнів за інструктивними картками в підручнику під наглядом учителя.)
Демонстрація:
„ Взаємодія кальцій гідроксиду з карбон( ІV)оксидом.”
Ca (OH)2 + CO2 = CaCO3↓ + H2O
Вапняна через скляну вода трубку вдихають повітря
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
1) Напишіть рівняння реакцій, які властиві таким основам: KOH, Fe(OH)3.
2) Який об’єм (н. у.) сульфуру(ІV)оксиду можна поглинути розчином барійгідроксиду кількістю речовини 3 моль?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 53
Тема:Хімічні властивості основ.
Мета:закріпити знання про способи добування основ та їх хімічні властивості; продовжити формувати вміння складати рівняння хімічних реакцій.
Основні поняття: реакція нейтралізації, термічний розклад.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:семінарське заняття.
Обладнання і реактиви: натрій гідроксид,сульфатна кислота, вода, ферум(ІІІ)гідроксид, купрум(ІІ)сульфат.
Хід уроку
Семінар двоелементний. Тобто складається з коректуючої і навчаючої частин, які тривають протягом однієї навчальної години.
Вчитель вибірково перевіряє і оцінює результати групової роботи окремих учнів на уроці.
Письмові завдання навчаючої частини учні виконують у двох екземплярах (під копірку). Один з екземплярів здається вчителю після уроку на перевірку.
Коректуючи частина.
(усна перевірка знань) 10 хвилин
Учні працюють в групах. Запитання надруковані і роздані групам.
Опитування проводить консультант і оцінює відповіді в обліковій картці.
1. Які сполуки називають основами? Як їх класифікують? Наведіть приклади.
2. Перелічіть способи добування основ.
3. Перелічіть хімічні властивості:
а) розчинних основ;
б) нерозчинних основ.
4. Які реакції відносять до реакцій нейтралізації? Наведіть приклади.
Навчаюча частина.
35 хвилин.
1.(Експериментальне завдання)
У трьох пронумерованих пробірках містяться розчини кислоти, лугу і води. Розпізнайте, в яких пробірках ці речовини.
2.(Експериментальне завдання)
Проведіть хімічні реакції, характерні для ферум(ІІІ)гідроксиду. Запишіть рівняння хімічних реакцій. 3. Складіть формули основ, що відповідають таким оксидам: кальційоксид, хром(ІІІ)оксид, натрійоксид, берилійоксид, купрум(ІІ)оксид.
Які з них легко розкладаються при нагріванні?
Підтвердьте відповідь рівняннями хімічних реакцій. 4. Між якими з попарно взятих речовин можлива хімічна взаємодія?
а) барійгідроксид і хлоридна кислота;
б) калій гідроксид і ортофосфатна кислота;
в) ферум(ІІ)гідроксид і нітратна кислота;
г) купрум(ІІ)гідроксид і вода;
д) калійгідроксид і вуглекислий газ;
е) натрійгідроксид і магнійоксид. Скласти рівняння можливих реакцій.
Урок 54
Тема:Поняття про амфотерні основи.
Мета:Розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ. Розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук. Формувати вміння й навички складання рівнянь хімічних реакцій на прикладі амфотерних основ.
Основні поняття: амфотерність.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, хімічні реактиви.
Хід уроку
І Актуалізація і корекція опорних знань.
1. Які сполуки називають основами? Як їх класифікують? Наведіть приклади.
2. Перелічіть способи добування основ.
3. Перелічіть хімічні властивості:
а) розчинних основ;
б) нерозчинних основ.
4. Які реакції відносять до реакцій нейтралізації? Наведіть приклади.
ІІ Мотивування учіння.
Демонстрація №14. Доведення амфотерності цинк гідроксиду.
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4
В результаті реакції отримали нерозчинну речовину, драглеподібний осад. Розділяємо одержаний осад на дві пробірки. Який реактив слід додати, щоб провести реакцію нейтралізації?
Zn(OH)2 +2HCl = ZnCl2 + 2H2O Що спостерігаємо?
А тепер у другу частину осаду додамо розчину натрій гідроксиду.
Zn(OH)2 +2NaOH = Na2ZnO2+ 2H2O
Що відбувається? Чому?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
Цинк гідроксид – амфотерна основа.
Амфотерність – це здатність сполуки виявляти кислотні та основні властивості, залежно від природи речовини, з якою відбувається взаємодія. До таких сполук також належать алюміній гідроксид, берилій гідроксид, хром(ІІІ)гідроксид, ферум(ІІІ)гідроксид.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
• Складіть рівняння реакційхром(ІІІ)гідроксиду з хлоридною кислотою і натрій гідроксидом.
• Складіть рівняння реакційалюміній гідроксиду з хлоридною кислотою і натрій гідроксидом.
• Яку масу алюміній оксиду можна добути при термічному розкладі алюміній гідроксиду масою 39 г?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 55
Тема:Правила безпеки під час роботи з лугами. Використання основ.
Мета:Закріпити й поглибити знання про хімічні властивості класів неорганічних сполук на прикладі властивостей основ. Розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ, здійснення розрахунків за хімічними рівняннями.
Повторити правила техніки безпеки під час роботи з лугами. Ознайомити учнів зі сферами використання основ.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку:узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності.
Хід уроку
І Актуалізація і корекція опорних знань.
8. Які сполуки називають основами? Як їх класифікують? Наведіть приклади.
9. Перелічіть способи добування основ.
10. Перелічіть хімічні властивості:
а) розчинних основ;
б) нерозчинних основ.
11. Які реакції відносять до реакцій нейтралізації? Наведіть приклади.
ІІ Мотивування учіння.
ІІІПовідомлення теми, цілей і завдань уроку.
ІV. Повторення і узагальнення понять, їх систематизація.
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 кл. Основи |
1 - 10 |
0,5 |
30 - 35 хв. |
|
11 - 14 |
1 |
||
|
15 - 16 |
2 |
Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть складові частини основ: А Гідроген і кислотний залишок; В два елементи, одним з яких є
Оксиген;
|
|
Б атом металу та Г атоми металу і кислотного залишку |
|
|
гідроксогрупа; |
|
|
|
|
|
|
|
2 |
Виберіть елемент, що входить до складу лугу: |
|
|
|
А Pb; Б Mn; В Na; |
Г Fe |
|
|
|
|
|
3 |
Вкажіть формулу аргентум гідроксиду: |
|
|
|
А Al(OH)3; Б Fe(OH)3; В KOH; |
Г AgOH |
4 Вкажіть валентність металу у Ga(OH)3:
АI; Б IV; В II; Г III
5 Виберіть формулу оксиду, що відповідає NaOH:
А N2O; Б Na2O; В NiO; Г Fe2O3
6 Вкажіть значення відносної молекулярної маси натрій гідроксиду:
А 39 г/моль; Б 31 г/моль; В 57 г/моль; Г 40 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть властивості характерні для амфотерних гідроксидів:
А гази; Б тверді речовини; В рідини; Г нерозчинні у воді
8 Вкажіть групи, що складаються з основних оксидів:
А MgO, K2O, SrO; Б CoO, Н2O, В BaO, Na2O, Г CО, NaF, К2O MgO; Cs2O;
9 Виберіть з переліку формули лугів:
А Sr(OH)2; Б Мn(OH)4; В Pb(OH)2; Г KOH
10 Випишіть речовини, з якими реагують нерозчинні основи:
А H2O; Б HCl; В CO2; Г Н3РO4
11 Розмістіть формули основ по мірі зростання їх відносної молекулярної маси:
А Mn(OH)2; Б Sc(OH)3; В LiOH; Г CuOH
12 Встановіть відповідність між формулою основи та її характеристикою:
Формула Класифікація
|
1 |
|
|
2 |
|
|
3 |
|
1 Zn(OH)2; А двокислотна, нерозчинна;
2 NaOH; Б двокислотна, луг;
3 Cu(OH)2; В двокислотна, амфотерна;
Г однокислотна, луг
13 Встановіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
|
1 |
|
1 Mg(ОН)2 + 2HCl → А K2СO3 + H2O;
|
2 |
|
|
3 |
|
2 2KOН + СО2 → Б КНСО3;
3 КОН + CО2 → В MgCl2 + 2H2O;
Г MgCl2 + H2O
14 Закінчіть рівняння хімічної реакції: Ca(OH)2 + H2SO4 →
15 Здійсніть перетворення за схемою: Ba(OH)2 → BaSO3 → BaBr2
16 Обчисліть масу цинк гідроксиду, що утвориться при взаємодії 27,2 г цинк хлориду з натрій гідроксидом.
Варіант № 2
Виберіть одну правильну відповідь
1 Вкажіть складові частини основ:
А атом металу та гідроксогрупаВ атоми металу і кислотного залишку;
Б Гідроген і кислотний залишок; Г два елементи, одним з яких є Оксиген
2 Виберіть елемент, що входить до складу амфотерного гідроксиду:
А К; Б Mg; В N; Г Zn
3 Вкажіть формулу плюмбум (II) гідроксиду:
А К2SiO3; Б RbOH; В CuOH; Г Pb(OH)2
4 Вкажіть валентність металу у Sn(OH)2:
А III; Б II; В IV; Г I
5 Вкажіть формулу оксиду, що відповідає Fe(OH)3:
А FeO; Б OF2; В Fr2O; Г Fe2O3
6 Вкажіть значення відносної молекулярної маси магній гідроксиду:
А 21 г/моль; Б 58 г/моль; В 30 г/моль; Г 57 г/моль
Виберіть кілька правильних відповідей
7 Вкажіть властивості характерні для лугів:
А гази; Б розчинні у воді; В білі кристали; Г рідини
8 Вкажіть групи, що складаються з основних оксидів:
А SnO2, Ag2O, SrO;Б CaO, Na2O, BaO;
В BeO, NO, Г Li2О, CaO, FeO
Cu2O;
9 Виберіть з переліку формули амфотерних гідроксидів:
А Be(OH)2; Б LiOH; В Fe(OH)3; Г Sr(OH)2
10 Випишіть речовини, з якими реагують луги:
А H2; Б H2SO4; В SO2; Г BaSO4
11 Розмістіть формули основ по мірі зростання їх відносної молекулярної маси:
А CsOH; Б Cr(OH)3; В Ba(OH)2; Г Be(OH)2
12 Встановіть відповідність між формулою основи та її характеристикою:
Формула Класифікація
|
1 |
|
|
2 |
|
|
3 |
|
1 Be(OH)2; А двокислотна, луг;
2 KOH; Б двокислотна, амфотерна;
3 Ba(OH)2; В двокислотна, нерозчинна;
Г однокислотна, луг
13 Встановіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
|
1 |
|
|
2 |
|
|
3 |
|
1 Mn(ОН)2 → А MgSO4 + 2H2O;
2 Mn(ОН)2 + H2SО4 → Б MnO + H2O;
3 Mg(ОН)2 + H2SО4 → В MnSO4 + 2H2O;
Г MgSO4 + H2O
14 Закінчіть рівняння хімічної реакції: LiOH + H3PO4 →
15 Здійсніть перетворення за схемою: K → KOH → K2SO4
16 Обчисліть масу літій гідроксиду, що утвориться при взаємодії 21 г літію з водою.
VГрупова робота з підручником
Використовуючи матеріал підручника, складіть схему використання основ.
VІПідсумки уроку;повідомлення домашнього завдання.
Учитель ще раз нагадує учням про правила роботи з лугами, підсумовує результати учнівських досліджень про використання основ.
Вивчити §. Виконати вправу (с. підручника).
Урок 56
Тема:Фізичні й хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
Мета:Розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі властивостей середніх солей. Розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей.
Основні поняття: неорганічні речовини.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:комбінований.
Обладнання і реактиви: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності, розчини купрум (ІІ) хлориду, натрійгідроксиду та барій гідрооксиду, розчини барійхлориду, натрійхлориду, натрій карбонату, аргентум нітрату, сульфатної кислоти та калійфосфату, магнійхлориду, залізний цвях, мідна дротина.
Хід уроку
Учитель розповідає учням про те що працюючи на уроці кожен з них набирає індивідуальний кумулятивний бал під час виконання завдань на певних етапах уроку і записує його у свою індивідуальну карточку. Сумарний бал стане його оцінкою за урок.
І Актуалізація і корекція опорних знань.
Бесіда
• Які речовини називаються оксидами? Як класифікують оксиди?
• Які речовини називаються кислотами? За якими ознаками класифікують кислоти?
• Які речовини називаються основами? Як класифікують основи?
• Які речовини називаються солями?
(За кожну правильну повну відповідь учні записують собі по одному балу)
Самостійна робота учнів Розділити речовини за класами:
Fe2O3NaOHCuCI2H2SO4K2OHNO3Zn(OH)2AI2(SO4)3.
• Скласти формули солей металів, що містять перелічені залишки, і дати їм назви (кожному роздається індивідуальне завдання) За правильно виконанні завдання учень набирає по два бали.
ІІ Мотивування учіння.
Вчитель: А зараз ми будемо досліджувати хімічні властивості солей Бесіда
• Які спільні властивості на вашу думку, притаманні кислотам, лугам та основам?
• Як потрібно поводитися з їдкими речовинами, кислотами?
• Які ознаки того, що відбулася реакція?
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
1. Фізичні властивості солей
За стандартних умов усі солі тверді кристалічні речовини різного кольору. Мають різну розчинність у воді ( див. таблицю на форзаці). Так усі солі нітратної кислоти розчинні у воді. Солі утворенні Натрієм та Калієм також добре розчинні. Солі фосфатної, карбонатної та силікатної кислот майже всі нерозчинні, за винятком солей Натрію та Калію. (демонстрація розчинності солей)
2. Хімічні властивості солей
Лабораторний дослід № 8.
Взаємодія металів із солями у водному розчині.
У дві пробірку наливаємо по 2 мл розчину сульфату купруму (ІІ) та хлориду магнію і опускаємо залізний цвях. Що спостерігаємо? Записуємо рівняння реакцій.
Кожен лівіше стоячий метал витісняє правіше за нього стоячий метал у електрохімічному ряду напруг металів з розчину його солей.
Лабораторний дослід № 9.
Взаємодія солей з лугами у водному розчині.
У пробірку з розчином хлориду феруму (ІІІ) додаємо розчин гідроксиду натрію. Що спостерігаємо? Записуємо рівняння реакцій.
У пробірку з розчином сульфату натрію додаємо розчин гідроксиду барію. Що спостерігаємо? Записуємо рівняння реакцій.
Солі взаємодіють з основами якщо одна з утворених речовин в результаті реакції випадає у осад.
Лабораторний дослід
Взаємодія з кислотами. Солі реагують з кислотами: а) коли утворюється осад нерозчинний у кислоті
У пробірку з розчином барій хлориду додаємо сульфатну кислоту. Що спостерігаємо? Записуємо рівняння реакцій.
б) коли реагуюча кислота сильніша від тої, якою утворена сіль
У пробірку з розчином натрій хлориду додаємо розчин сульфатної кислоти. Записуємо рівняння реакцій.
в) коли сіль утворена леткою кислотою, а реагуюча кислота – нелетка.
У пробірку з розчином карбонату натрію додаємо розчин сульфатної кислоти. Що спостерігаємо? Записуємо рівняння реакцій.
Лабораторний дослід № 10 Реакція обміну між солями в розчині.
У пробірку з розчином аргентум нітрату додаємо розчин калій фосфату. Що спостерігаємо? Записуємо рівняння реакцій.
А тепер у пробірку з розчином аргентум нітрату додамо розчин натрій сульфату. Що спостерігаємо?
Солі реагують з солями, якщо одна з солей утворених у результаті реакції випадає у осад.
Учні по черзі виходять до дошки та записують рівняння реакцій. В залежності від правильності запису виставляється бал ( максимум 3) який вони записують у свою картку.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Самостійна робота (10 хв)
Учням роздаються картки з індивідуальними завданнями ( закінчити рівняння реакцій, якщо вони можливі). Після чого роздаються картки з правильними варіантами відповіді. Максимальна оцінка за роботу три бали.
Робиться підрахунок балів які виставляються у журнал як оцінка за урок.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Домашній експеримент:
1. Взаємодія яєчної шкаралупи з оцтом.
Додаток до уроку
Кумулятивна картка уроку учня 8 класу___________________________
|
Етапи уроку
|
Бали
|
|||
|
І
|
Актуалізація опорних знань
|
|
||
|
1
|
Усна відповідь (1 бал)
|
|
||
|
2
|
Хімічний диктант (2 бали)
|
|
||
|
|
3 |
Складання формул речовини ( 2 бали) |
|
|
|
ІІ
|
|
Вивчення нового матеріалу
|
|
|
|
|
1 |
Усна відповідь (1бал)
|
|
|
|
|
2 |
Написання хімічних рівнянь на дошці (3бали)
|
|
|
|
ІІІ
|
|
Закріплення
|
|
|
|
|
|
Самостійна робота Індивідуальне завдання (3 бали)
|
|
|
|
|
|
Загальний бал
|
|
|
Варіант 1
Дописати рівняння реакцій, якщо вони можливі. Розставити коефіцієнти
1. CuSO4 + Ag =
2. FeCI3+ NaOH =
3.AgNO3 + HCI =
4. Na2SO3 + HCI =
5. K2CO3 + HNO3 =
6. AgNO3 + BaCI2 =
Правильнівідповіді
1. Аргентумневзаємодієзрозчиномкупрумсульфату
2. FeCI3+ 3NaOH= Fe(OH)3 ↓+ 3NaCI
3. AgNO3 + HCI = AgCI↓ +HNO3
4. Na2SO3 + 2HCI = 2NaCI + H2SO3
5. K2CO3 +2 HNO3 =2 KNO3 + H2O + CO2↑
6. 2AgNO3 + BaCI2 = 2AgCI↓ + Ba(NO3)2
Варіант 2
Дописати рівняння реакцій, якщо вони можливі. Розставити коефіцієнти
1. FeSO4 + Ag =
2. CrCI3+ NaOH =
3.HgNO3+ HCI =
4. K2SO3 + HCI =
5. Na2CO3 + HNO3 =
6. Ba(NO3)2+ Na2SO4 =
Правильнівідповіді
1. Аргентумневзаємодієзрозчиномсульфатуферуму
2. CrCI3+ 3NaOH = Cr(OH)3 ↓+ 3NaCI
3. Hg(NO3)2 + 2HCI = HgCI2↓ +2HNO3
4. K2SO3 + 2HCI = 2KCI + H2SO3
5. Na2CO3 + 2HNO3= 2NaNO3 + H2O + CO2↑
6. Ba(NO3)2+ Na2SO4 = BaSO4 ↓+2 NaNO3
Варіант 3
Дописати рівняння реакцій, якщо вони можливі. Розставити коефіцієнти
1. AI2(SO4)3 + Mg = 2. MgBr2+ KOH =
3. BaCI2 + H2SO4 =
4. Na2SO3 + HNO3 =
5. K2CO3 + H2SO4 =
6. AgNO3 + Na3PO4 =
Правильнівідповіді
1. AI2(SO4)3 + 3Mg =3MgSO4 + 2AI
2. MgBr2+2 KOH = Mg(OH)2↓ +2KBr
3. BaCI2 + H2SO4 = BaSO4↓ + 2HCI
4. Na2SO3 +2HNO3 = 2NaNO3 + H2SO3
5. K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑
6.3AgNO3 + Na3PO4 =Ag3PO4↓ + 3NaNO3
Урок 57
Тема:Поширення солей у природі та їх практичне значення.
Мета:Систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей. Показати поширення солей у природі, їх практичне значення.
Основні поняття: неорганічні речовини.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
Бесіда Які речовини називаються оксидами? Як класифікують оксиди?
• Які речовини називаються кислотами? За якими ознаками класифікують кислоти?
• Які речовини називаються основами? Як класифікують основи?
• Які речовини називаються солями?
ІІІ. Розв’язування вправ.
Самостійна робота учнів ( хімічний диктант) Розділити речовини за класами:
Fe2O3NaOHCuCI2H2SO4K2OHNO3Zn(OH)2AI2(SO4)3.
• Скласти формули солей металів, що містять перелічені залишки, і дати їм назви (за варіантами)
Скласти формули солей Na та Mg, що містять перелічені залишки та дати їм назви.
=S___________________________________________________________
─NO3________________________________________________________
≡PO4_________________________________________________________
Скласти формули солей K та AI, що містять перелічені залишки та дати їм назви.
= SO4___________________________________________________________
─ CI____________________________________________________________
= CO3___________________________________________________________
ІІІПовідомлення теми, цілей і завдань уроку.
IV. Узагальнення
Перегляд кінофільму «Солі»
V. Повторення і узагальнення понять, їх систематизація.
Самостійна робота (10 хв)
Учням роздаються картки з індивідуальними завданнями ( закінчити рівняння реакцій, якщо вони можливі). Після чого роздаються картки з правильними варіантами відповіді.
Дописати рівняння реакцій, якщо вони можливі. Розставити коефіцієнти:
1. CrCI3 + Zn =
2. Fe2(SO4)3 + NaOH =
3. Ca3(PO4 )2 +H2SO4 =
4.MgCI2 + H2SO4 =
5. Na2CO3 + ZnCI2 =
6. Ca(NO3)2 + H3PO4 =
Правильнівідповіді
1.2CrCI3 + 3Zn =3 ZnCI2 + 2Cr
2. Fe2(SO4)3 + 6NaOH = 2 Fe(OH)3↓+ 3Na2SO4
3. Ca3(PO4 )2 +3H2SO4 = 3CaSO4 +2H3PO4
4. MgCI2 + H2SO4 = MgSO4 +2HCI↑
5. Na2CO3 + ZnCI2 =2 NaCI + ZnCO3↓
6.3Ca(NO3)2 + 2H3PO4 = Ca3(PO4)2 +6HNO3
СкластиформулисолейBaтаFe (II) , щомістятьпереліченізалишки та дати їм назви.
=S________________________________________________________________
─NO3_____________________________________________________________
≡
PO4_____________________________________________________________
Скласти формули солей Zn та Cu (II), що містять перелічені залишки та дати їм назви.
=SO3______________________________________________________________
─Br_______________________________________________________________
= SiO3_____________________________________________________________ Скласти формули солей Ca та Fe (III), що містять перелічені залишки та дати їм назви.
=SO4______________________________________________________________
─Br_______________________________________________________________
─NO3_____________________________________________________________
Скласти формули солей Na та Ba ,що містять перелічені залишки та дати їм назви.
=SO4______________________________________________________________
─Br_______________________________________________________________
─NO3___________________________________________________________
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 58
Тема:Практична робота № 1. Дослідження властивостей основних класів неорганічних сполук.
Мета:Продовжити формування навичок роботи з хімічними речовинами й лабораторним устаткуванням. Перевірити знання техніки безпеки під час роботи в кабінеті хімії. Поглибити знання про хімічні властивості оксидів, кислот, основ і солей. Визначити рівень засвоєння знань про хімічні властивості класів неорганічних сполук.
Основні поняття: неорганічні речовини.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: Урок практичного застосування знань, навичок і вмінь.
Обладнання і реактиви: нікель(ІІ) сульфат порошок, гранули цинку, розчин калій гідроксиду, барій нітрат та натрій карбонат; штатив з пробірками.
Техніка безпеки:Забороняється!

1. Висипати, виливати, залишки реактивів назад у посуд з ними;
2. Вживати їжу;
3. Брати речовини руками;
4. Залишати неприбраними реактиви;
5. Висипати, виливати реактиви в раковину;
6. Замінювати корки, піпетки з різних посудин;
7. Набирати однією ложкою або піпеткою piзні речовини;
8. Залишати відкритим посуд з реактивами
Категорично забороняється проводити досліди, не зазначені в poботі, та самостійно зливати i змішувати реактиви
ХІД РОБОТИ
Дослід 1
Дослідження фізичних властивостей властивостей нікель(ІІ) сульфату
Уважно розгляньте видану вам тверду речовину та опишіть її. Вкажіть характер часточок сполуки(кристали, порошок, кусочки без форми).
З’ясуйте чи розчиняється нікель(ІІ сульфат ) у воді. Для цього невелику кількість порошку насипте у стакан додайте невелику кількість води та розмішуємо скляною паличкою. Який результат досліду? Чи узгоджуються отримані вами результати з даними з таблиці розчинності? Виготовлений розчин розділіть на чотири пробірки.
Дослід 2
Реакція нікель (ІІ) сульфату з металом
У пробірку з розчином нікель(ІІ) сульфату помістіть гранули цинку. Нагрійте вміст пробірки протягом 1-2 хв., але не до кипіння. Чи змінилася поверхня металу, забарвлення розчину?.
Дослід 3
Реакція нікель(ІІ) сульфату з лугом
В іншу пробірку з розчином нікель(ІІ) сульфату добавте такий самий об’єм розчину лугу. Які зміни помічаєте?
Дослід 4
Реакції нікель(ІІ) сульфату з іншими солями
В одну із двох пробірок із розчином нікель(ІІ) сульфату, які залишилися, добавте розчин натрій карбонату, а в другу — розчин барій хлориду. Що спостерігаєте?
Після завершення кожного з дослідів записуйте свої спостереження та відповідні хімічні реакції у зошит. Завершивши роботу зроби висновки.

Урок 59
Тема:«Основні класи неорганічних сполук».
Мета:Узагальнити й систематизувати знання учнів про властивості класів неорганічних сполук, їх генетичний зв'язок. Визначити рівень навчальних досягнень з теми.
Основні поняття: неорганічні речовини.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: семінарське заняття.
Хід уроку
Семінар двоелементний. Тобто складається з коректуючої і навчаючої частин, які тривають протягом однієї навчальної години.
Вчитель вибірково перевіряє і оцінює результати групової роботи окремих учнів на уроці.
Письмові завдання навчаючої частини учні виконують у двох екземплярах (під копірку). Один з екземплярів здається вчителю після уроку на перевірку.
Коректуючи частина.
(усна перевірка знань) 10 хвилин
Учні працюють в групах. Запитання надруковані і роздані групам.
Опитування проводить консультант і оцінює відповіді в обліковій картці.
1. Які речовини називаються оксидами?
2. Як класифікують оксиди?
3. Перерахуйте хімічні властивості оксидів.
4. Які речовини називаються кислотами?
5. За якими ознаками класифікують кислоти?
6. Перерахуйте хімічні властивостікислот.
7. Які речовини називаються основами?
8. Як класифікують основи?
9. Перерахуйте хімічні властивостікислот.
10. Які речовини називаються солями?
11. Перерахуйте хімічні властивості солей.
Навчаюча частина.
35 хвилин.
І варіант.
1. Розподілити речовини за класами: оксиди, кислоти, основи, солі.
HCl, NaСІ, CaO, BaO, , CO, Ca(OH)2, KOH, Fe(OH)3,Н2SO3,Н2SO4, BaCO3, LiF, Na2S, FePO4.
2. З якими з речовин з першого завдання реагуватиме сульфатна кислота.
Написати можливі рівняння реакцій.
3. Напишіть рівняння реакцій за допомогою яких можна здійснити перетворення:
Mg MgO MgCI2 MgOH2 MgSO4
4.У воді при нагріванні розчинили 5,6 г фосфор (V) оксиду. Обчисліть масу утвореної кислоти.
5. Який об’єм карбон (І V) оксиду виділиться (н.у.), якщо нанатрій карбонат масою 36 г подіяти надлишком хлоридної кислоти ІІ варіант.
1. Розподілити речовини за класами: оксиди, кислоти, основи, солі.
HS, BaСІ2, CaS, Ba(OH)2, , ZnO, Fe(OH)2, NaOH, Fe(NO3)3,H2SiO3Н2SO4, CaCO3, LiBr, K2S, AIPO4.
2. З якими з речовин з першого завдання реагуватиме хлоридна кислота. Написати можливі рівняння реакцій
3. Напишіть рівняння реакцій за допомогою яких можна здійснити перетворення:
CuO→CuSO4→Cu→ CuO → Cu(NO3)2
4.Яка маса осаду утвориться, якщо до розчину, що містить 3,85 гнатрійхлориду, додати аргентум нітрат?
5.Через розчин барій гідроксиду пропустили вуглекислий газ, у результаті випав осад масою 4,65 г. Обчисліть об’єм вуглекислого газу (н.у.)
Урок 60
Тема:Генетичний зв'язок між класами неорганічних сполук.
Мета:Розкрити взаємозв'язок явищ у природі на прикладі взаємоперетворень одних класів речовин на інші. Узагальнити знання про неорганічні речовини та їх властивості. Розвивати вміння порівнювати склад і властивості речовин, класифікувати речовини й реакції, встановлювати генетичний зв'язок між класами неорганічних сполук.
Основні поняття: основні класи неорганічних речовин, генетичний зв’язок. Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти,здоров’язберігаюча.
Тип уроку:урок засвоєння нових знань.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності.
Хід уроку
І Актуалізація і корекція опорних знань.
• Які речовини називають оксидами? Які речовини називають основами?
• Які речовини називають кислотами?
• Які речовини називають солями?
• Розподіліть по класам такі речовини:
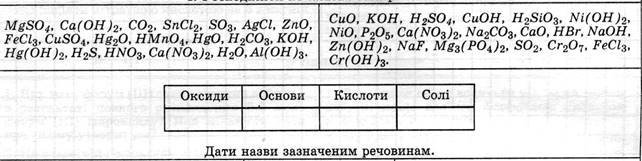
• Які властивості характерні для оксидів?
• Які властивості характерні для основ?
• Які властивості характерні для кислот?
• Які властивості характерні для солей?
ІІ Мотивування учіння.
Чи існує зв’язок між окремими класами неорганічних сполук?
Речовини одного класу взаємодіють з іншими речовинами. При цьому утворюються речовини інших класів.Тобто між класами неорганічних сполук існує генетичний зв’язок, що забезпечує їх взаємоперетворювання під час хімічних реакцій.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVСприймання й усвідомлення учнями фактичного матеріалу.
• Здійсніть перетворення:
S → SO2→H2 SO3→Na2 SO3
1. S + O2=SO2
2. SO2+ Н2O =H2 SO3
3. H2 SO3 + 2Na OH = Na2 SO3+ 2Н2O
Цю схему можна записати в загальному вигляді: неметал→кислотний оксид →кислота →сіль (1)
Здійсніть перетворення:
Na→ Na2O →Na OH → Na2 SO3
1. 4Na + O2=2Na2 O
2. Na2 O+ Н2O =2Na OH
3. 2Na OH+H2 SO3= Na2 SO3+ 2Н2O
Цю схему можна записати в загальному вигляді: метал→основний оксид →основа →сіль (2)
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу. Запропонуйте свої варіанти ланцюжків перетворень за першою і другою схемами.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Скласти ланцюжки перетворень за схемами 1 і 2 для Фосфору і Кальцію.
Домашній експеримент:
2. Дія на сік буряка оцту, лимонного соку, розчину харчової соди, мильного розчину.
Урок 61
Тема:Генетичний зв'язок між класами неорганічних сполук.
Мета:Розкрити взаємозв'язок явищ у природі на прикладі взаємоперетворень одних класів речовин на інші. Узагальнити знання про неорганічні речовини та їх властивості. Розвивати вміння порівнювати склад і властивості речовин, класифікувати речовини й реакції, встановлювати генетичний зв'язок між класами неорганічних сполук.
Основні поняття: реакція нейтралізації, термічний розклад.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності.
Хід уроку
І Перевірка домашнього завдання.
Учні записують на дошці підготовлені схеми генетичного зв’язку на прикладі Фосфору і Кальцію, а також рівняння хімічних реакцій, що підтверджують їх.
ІІ Мотивування учіння.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVРозв’язування вправ.
• Здійсніть перетворення:
1. цинк→цинк оксид →цинк хлорид →цинк гідроксид
2. алюміній→алюміній оксид →алюміній сельфат → алюміній гідроксид → алюміній хлорид
3. вуглець→карбон (IV)оксид →кальцій карбонат → карбон (IV)оксид
• Із чотирьох елементів – Натрій, Сульфур, Оксиген і Гідроген – складіть формули основи, кислоти і трьох солей. Які з цих речовин будуть взаємодіяти між собою? Складіть рівняння хімічних реакцій.
V Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Самостійна робота учнів
І варіант
2. Дописати рівняння таких реакцій: BaCl2 + NaOH =
BaCl2 + H2SO4 = Cu SO4 + Fe =
Na2SO4 + BaCl2=
3. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
кальцій→ кальцій оксид → кальцій гідроксид → кальцій хлорид → аргентум хлорид.
3. Визначіть масу купрум(ІІ) сульфату, що утворюється при взаємодії 2 моль купрум(ІІ) оксиду з сульфатною кислотою.
ІІ варіант
Дописати рівняння таких реакцій:
ZnCl2 + NaOH =
ZnCl2 + AgNO3 =
Cu Cl2 + Fe =
ZnCO3 + HCl =
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Алюміній → алюміній хлорид → алюміній гідроксид → алюміній оксид → алюміній сульфат → барій сульфат.
3. Яку кількість речовини барій оксиду необхідно взяти для реакції з сульфатною кислотою, щоб добути барій сульфат масою23,3 г?
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 62
Тема:Загальні способи одержання оксидів, основ, кислот, солей.
Мета:Ознайомити учнів із загальними способами одержання оксидів, основ, кислот, солей. Розвивати навички роботи з навчальною літературою. На прикладі одержання різних класів неорганічних сполук показати взаємозв'язок між будовою, штастивостями та способами одержання цих речовин.
Основні поняття: оксиди, основи, кислоти, солі, синтез.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: комбінований.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
Хід уроку
І Актуалізація і корекція опорних знань.
• Які властивості характерні для оксидів?
• Які властивості характерні для основ?
• Які властивості характерні для кислот?
• Які властивості характерні для солей?
ІІ Мотивування учіння.
Між класами неорганічних сполук існує генетичний зв’язок, який дає можливість припустити шляхи синтезу речовин різнихкласів неорганічних сполук.
ІІІПовідомлення теми, цілей і завдань уроку.
ІV Осмислення зв'язків і залежностей між елементами вивченого матеріалу.
Самостійна робота учнів з навчальною літературою.
Завдання:
Скласти схеми можливих способів добування оксидів, основ, кислот і солей і навести приклади рівнянь реакцій синтезу відповідно до них.
СПОСОБИ ДОБУВАННЯ ОКСИДІВ
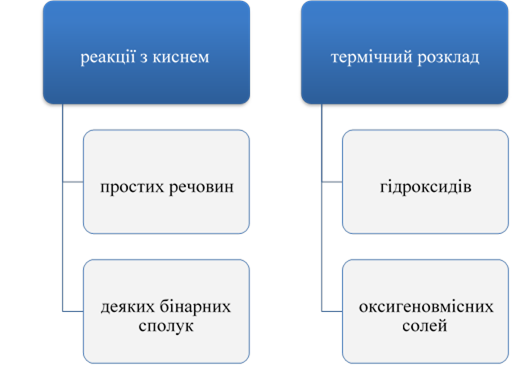
2Ca + O2 =2CaO
2 H2 S + 3O2=2SO2 + 2H2 O
Cu (OH)2=CuO + H2 O
H2 SO4=SO3 + H2 O
CaCO3= CaO + CO2
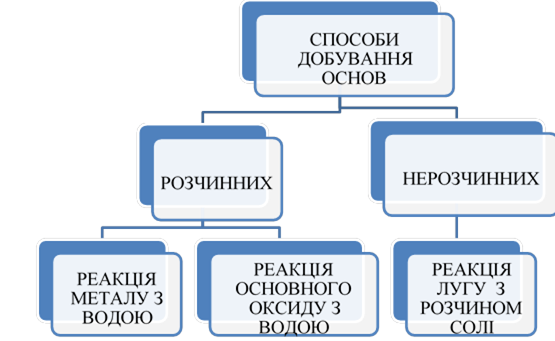
2Na + 2H2 O = 2NaOH +H2 Na2 O +H2 O = 2NaOH
Na2 SO4 + Ba (OH)2 = BaSO4+2NaOH
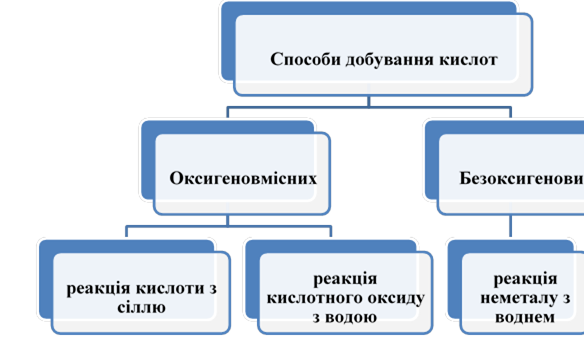
Приклади:
Н2 + СІ2 = 2НСІ К2S + 2НСІ = 2КСІ + Н2S
SO3 + H2O = H2SO4
Оксид Силіцію з водою не взаємодіє
|
СПОСОБИ ДОБУВАННЯ СОЛЕЙ |
||
|
РЕАКЦІЇ МЕТАЛІВ |
РЕАКЦІЇ МІЖ СПОЛУКАМИ ОСНОВНОГО І КИСЛОТНОГО ХАРАКТЕРУ |
РЕАКЦІЇ ОБМІНУ СОЛЕЙ |
|
ІЗ СОЛЯМИ |
МІЖ ОСНОВОЮ ТА КИСЛОТОЮ |
З ЛУГАМИ |
|
З КИСЛОТАМИ |
МІЖ ОКСИДАМИ |
З КИСЛОТАМИ |
|
З МЕТАЛАМИ |
МІЖ ОСНОВОЮ ТА ОКСИДОМ |
З СОЛЯМИ |
|
|
МІЖ КИСЛОТОЮ ТА ОКСИДОМ |
|
Приклади:
2Na + Br2 = 2NaBr
Zn +2 HCI = ZnCI2 + H2
Fe +CuSO4 = FeSO4 + Cu
Ba(OH)2 + H2SO4 = BaSO4 +2H2O
CaO + CO2 = CaCO3
2KOH + SO3 = K2SO4 + H2O
2HCI + Na2O = 2NaCI + H2O
Na2SO3 +2 HF = 2NaF + H2O +SO2
FeSO4 + 2KOH = Fe(OH)2 ↓ + K2SO4
2AgNO3 + BaCI2 = 2AgCI↓ + Ba(NO3)2
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 63
Тема:Загальні способи одержання оксидів, основ, кислот, солей.
Мета:Розвивати вміння й навички учнів складати рівняння на прикладі одержання оксидів, основ, кислот, солей. Систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей, показати їх узаємозв'язок з генетичним зв'язком класів неорганічних сполук.
Основні поняття: оксиди, основи, кислоти, солі, синтез.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: узагальнення і систематизація знань, умінь, навичок і творчого їх застосування на практиці.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
Хід уроку
І Перевірка домашнього завдання.
Презентація учнями свох варіантів класифікації способів добування неорганічних речовин.
ІІ Мотивування учіння.
Тепер розглянемо, як практично можна застосувати ці знання.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVОсмислення зв'язків і залежностей між елементами вивченого матеріалу.
Демонстрація 18:
. Взаємодія кальцій оксиду з водою, дослідження добутого розчину індикатором, пропускання вуглекислого газу крізь розчин.
Завдання:
• Що спостерігаємо?
• Які речовини утворилися під час експерименту?
• Складіть ланцюжок перетворень і рівняння відповідних хімічних реакцій.
• Обчисліть масу кальцій карбонату, який можна отримати при взаємодії вуглекислого газу з кальцій гідроксидом кількістю речовини 1 моль.
Демонстрація 19:
Спалювання фосфору, розчинення добутого фосфор(V) оксиду у воді, дослідження розчину індикатором і нейтралізація лугом.
Завдання:
• Що спостерігаємо?
• Які речовини утворилися під час експерименту?
• Складіть ланцюжок перетворень і рівняння відповідних хімічних реакцій.
• Обчисліть масу натрій ортофосфату, який можна одержати з фосфору масою15,5 г.
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 64
Тема:Значення експериментального методу в хімії.
Мета:Розвивати навички й уміння розв'язання експериментальних задач, використання знання про властивості речовин різних класів неорганічних сполук для визначення цих речовин. Показати значення експерименту в хімічних дослідженнях, повторити правила техніки безпеки.
Основні поняття: оксиди, основи, кислоти, солі, експеримент.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: урок формування знань, умінь і навичок.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
Хід уроку
І Актуалізація і корекція опорних знань.
Самостійна робота: І Варіант
1. Напишіть рівняння реакцій, що підтверджують перетворення: барій оксид→барій гідроксид→барій нітрат
2. Обчисліть масу солі, яку можна добути з оксиду кількістю речовини1,5моль.(за схемою 1 завдання) ІІ Варіант
1. Напишіть рівняння реакцій, що підтверджують перетворення:сульфур(VI) оксид→сульфатна кислота→натрій сульфат.
2. Обчисліть масу соліяку можна добути з оксиду кількістю речовини1,5моль.(за схемою 1 завдання) ІІ Мотивування учіння.
Сьогодні ми будемо експериментаторами. Ми познайомимося з реакціями, що дозволяють відрізнити одні речовини від інших. Такі реакції називають якісними.
ІІІПовідомлення теми, цілей і завдань уроку.
ІVФормування знань, умінь і навичок.
Лабораторні дослід №11
Розв’язування експериментальних задач.
Мета: закріпити експериментальним шляхом знання про хімічні властивості оксидів, основ, кислот і солей, навчитися визначати неорганічні речовини.
Обладнання:штатив з пробірками, шпатель, порцелянова чашка, спиртівка.
Реактиви:у пронумерованих пробірках розчини таких речовин: сульфатної кислоти, кальцій гідроксиду, калій хлориду; на столах учнів: дистильована вода, розчин арґентум нітрату, барій хлориду, індикатору; кристалічний купрум(ІІ)сульфат, гранули цинку.
Завдання:виконайте роботу згідно із запропонованим завданням, оформіть звіт, заповнивши таблицю.
1. У трьох пронумерованих пробірках містяться розчини сульфатної кислоти, кальцій гідроксиду, калій хлориду. Визначте за допомогою дослідів кожну з речовин.
2. Добудьте цинк сульфат з купрум(ІІ)сульфату.
Повторюємо правила роботи з хімічними речовинами, основні правила поведінки в хімічному кабінеті.
|
Хід роботи |
Спостереження, рівняння реакцій, висновки |
|
. І Визначення речовин 1. Щоб визначити калій хлорид, треба в проби досліджуваних розчинів долити арґентум нітрату. 2. Щоб визначити сульфатну кислоту, треба в проби двох розчинів, що залишилися долити барій хлориду. 3. Щоб перевірити, що в останній пробірці міститься кальцій гідроксид, треба випробувати розчин індикатором. |
Спостереження Пробірка№1________________________ Пробірка№2________________________ Пробірка№3________________________
Рівняння хімічних реакцій Пробірка№1________________________ Пробірка№2________________________ Пробірка№3________________________
Висновки В пробірці№1міститься______________ В пробірці№2міститься______________ В пробірці№3міститься______________
|
|
ІІ Добування запропонованих речовин 1. Наберіть шпателем трохи купрум(ІІ)сульфату насипте в пробірку, долийте 1 – 2мл дистильованої води. Зверніть увагу на колір розчину. 2. Опустіть в розчин гранулу цинку. Почекайте хвилину. Зверніть увагу на колір розчину. 3. Розчин налийте в порцелянову склянку і випарте. |
Спостереження 1. ____________________________ 2. ____________________________ 3. ____________________________
Рівняння реакції___________________________ |
|
Зробіть висновок Для визначення речовин проводять________________ реакції на ці речовини. Щоб добути задану речовину з іншої необхідно знати____________________ |
|
VІПідсумки уроку;повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 65
Тема:Практична робота № 2.Розв'язання експериментальних задач.
Мета:Перевірити знання правил техніки безпеки; навички роботи з лабораторним устаткуванням, хімічними реактивами, навички проведення хімічного експерименту. Перевірити навички практичного використання знань про фізичні й хімічні властивості речовин різних класів неорганічних сполук.
Основні поняття: оксиди, основи, кислоти, солі, експеримент.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: Урок практичного застосування знань, навичок і вмінь.
Обладнання і реактиви: періодична система хімічних елементів
Д.І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування(штатив з пробірками, пробіркотримач, спиртівка, сірники), хімічні реактиви(розчини натрій хлориду, натрій гідроксиду, хлоридної кислоти, сульфатної кислоти; купрум (II) оксид, магній).
Хід уроку
І Перевірка домашнього завдання, актуалізація і корекція опорних знань, навичок і вмінь.
ІІ Повідомлення теми, цілей і завдань уроку.
ІІІ Актуалізація мотивації учіння учнів.
Актуалізація знань учнів про необхідність дотримання правил техніки безпеки під час роботи в хімічному кабінеті. (Бесіда.)
ІVОсмислення змісту й послідовності застосування способів виконання дій.
Вступне слово вчителя.
Інструктаж з техніки безпеки під час виконання практичної роботи.
1. Звільни робоче місце від усіх непотрібних для роботи речей і матеріалів.
2. Уважно прочитай і проаналізуй хід розв'язування задач (склади плани розв'язування).
3. Перевір наявність на робочому столі необхідного обладнання й реактивів.
4. Зверни увагу, що тобі потрібно працювати з їдкими речовинами — кислотами, лугами.
5. Уважно читай етикетки на посуді.
6. Відкривши посудину з реактивом, потрібно класти пробку догори дном, щоб реактив не забруднював робоче місце.
7. Надлишок взятого реактиву не можна зливати назад у посуд.
8. Посудину, з якої взяли реактив, слід відразу ж закрити пробкою і поставити на місце в лоток.
9. Кислоти та луги брати краплями, не допускати їхнього потрапляння на шкіру, одяг, вочі.
10. Реактив наливати за правилом, щоб розчин не попадав на етикетку.
Пам'ятайте правила нагрівання речовин.
11. Тверді речовини — оксиди (МgО, СuО) брати, щоб вони лише вкрили дно пробірки, а рідини — не більше 1/6 об'єму пробірки.
12. Закріпити пробірку в пробіркотримачі і нагрівати тільки в нахиленому положенні. Спочатку рівномірно нагріти всю пробірку, а потім її нижню частину так, щоб полум'я охоплювало лише верхню третину об'єму рідини.
13. Отвір пробірки спрямовувати в бік так, щоб у випадку різкого закипання рідина не потрапила на працюючих.
14. Не зазирайте в пробірку, у якій нагрівається рідина, і не нахиляйтеся над посудиною з будь-якою рідиною, оскільки непомітні бризки можуть потрапити в очі.
15. Гасіть полум'я, накривши його чашкою (ковпачком) і не піднімайте його доти, доки не вляжеться дим.
16. Перш ніж поставити гарячу пробірку в штатив, почекайте хвилину, поки вона охолоне, інакше зіпсується пластмасовий штатив
(плавиться).
17. Відпрацьовані реактиви можна і зливати в раковину тільки після їхньої нейтралізації.
18. Після роботи вимийте посуд, і лоток з обладнанням і реактивами приберіть на демонстраційний стіл.
19. Ретельно вимийте руки.
20. Категорично забороняється проводити досліди, не зазначені в роботі, та самостійно зливати і змішувати реактиви.
VСамостійне виконання учнями завдань під контролем і за допомогою вчителя.
Інструктивна картка.
Експериментальні задачі — це практичні завдання, при виконанні яких необхідно проводити досліди та спостереження.
Задача 1. У трьох пронумерованих пробірках містяться розчини: натрійхлориду, натрійгідроксиду та хлоридної кислоти. Визначте, в якій пробірці міститься кожен із цих розчинів.
План досліду
1. Виявіть розчини дією індикаторів (метилоранжевого або лакмусу).
2.Запишіть свої спостереження.
3.Зробіть висновок, у якій пробірці який розчин міститься.
Задача 2. Як з купрум(II)оксидудобути купрум(II)гідроксид?
1. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення.
2.Результати досліджень запишіть у таблиці.
|
Реакція між... |
Умови перебігу реакцій |
Ознаки хімічних реакцій |
Формули і назви утворених |
|
|
|
|
речовин |
|
|
|
|
|
Задача 3.
Практично здійсніть такі перетворення:
Мg→ МgС12→ Мg(ОН)2→ МgS04.
1. Напишіть рівняння реакцій, за допомогою яких можна здійснити дані перетворення.
2.Результати досліджень запишіть у таблиці.
|
Реакція між... |
Умови перебігу реакцій |
Ознаки хімічних реакцій |
Формули і назви утворених речовин |
|
|
|
|
|
|
|
|
|
|
Додаткові завдання.
1. Складіть рівняння реакцій, за допомогою яких можна здійснити запропоно вані перетворення:
Fе2(SО4)3→Fе(ОН)3→Fе2О3→FеС13.
2. Якими способами можна добути алюміній хлорид? Напишіть рівняння реакцій.
VІ Звіт учнів про роботу і теоретичне обґрунтування отриманих результатів.
VІІ Підсумки уроку й повідомлення домашнього завдання.
Вивчити §. Виконати вправу (с. підручника).
Урок 66
Тема:Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
Мета:Розвивати вміння й навички розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. Повторити хімічні властивості класів неорганічних сполук, генетичний зв'язок між ними. Підготувати учнів до тематичного оцінювання.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: уроквдосконалення знань і вмінь.
Обладнання: Ключові формули, картки – завдання
Хід уроку
І. Актуалізація опорних знань
• Які властивості характерні для оксидів?
• Які властивості характерні для основ?
• Які властивості характерні для кислот?
• Які властивості характерні для солей?
• Сформулюйте закон збереження маси речовини.
II. Повідомлення теми, мети і завдань уроку, мотивація навчальної діяльності.
III. Удосконалення знань та вмінь учнів розв’язувати розрахункові задачі.
Учні самостійно розв’язують задачі за розданими їм картками. Відповідно до кількості розв’язаних задач виставляється оцінка за урок. Упевнитися у правильності розв’язання можна, звірившись із відповіддю та розв’язанням відповідної задачі на дошці.
Задачі, які пропонуються учням для розв’язування
1. Розрахуйте масу цинк хлориду, що утворюється при взаємодії 6,5 г цинку з хлоридною кислотою.
2. Розрахуйте масу купрум (ІІ) нітрату, якщо 2 моль купрум (ІІ) оксиду реагує з нітратною кислотою.
3. Яка маса натрій карбонату реагує з хлоридною кислотою, якщо внаслідок реакції виділяється вуглекислий газ об’ємом 6, 72 л?
4. При термічному розкладі натрій нітрату масою 17 г виділяється кисень. Який об’єм кисню виділиться (н. у.)?
5. При розкладі кальцій карбонату кількістю речовини 2 моль утворюється карбон (І V) оксид об’ємом:
а) 4,48л; б) 22,4 л; в) 44,8 л; г) 67,2 л.
6. Яка кількість барій хлориду утворюється при взаємодії 0,6 моль хлоридної кислоти з достатньою кількістю барій гідроксиду?
7. Розрахуйте масу купрум (ІІ) сульфату, що утворюється при взаємодії 2 моль купрум (ІІ) оксиду з достатньою кількістю сульфатної кислоти.
8. Яку масу барій оксиду необхідно взяти для реакції з сульфатною кислотою, щоб добути барій сульфат масою 23,3 г?
9. Який об’єм карбон (І V) оксиду виділяється при взаємодії 10,6 г натрій карбонату з хлоридною кислотою?
10. Обчисліть масу сульфатної кислоти, яку необхідно взяти для реакції з купрум (ІІ) оксидом масою 16 г.
VІПідсумки уроку;повідомлення домашнього завдання.
Скласти і розвʼязати задачу.
Урок 67
Тема:Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції.
Мета:Розвивати вміння й навички розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції. Повторити хімічні властивості класів неорганічних сполук, генетичний зв'язок між ними. Підготувати учнів до тематичного оцінювання.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти.
Тип уроку: уроквдосконалення знань і вмінь.
Обладнання: Ключові формули, картки – завдання
Хід уроку
І. Актуалізація опорних знань Які властивості характерні для оксидів?
• Які властивості характерні для основ?
• Які властивості характерні для кислот?
• Які властивості характерні для солей?
• Сформулюйте закон збереження маси речовини.
II. Повідомлення теми, мети і завдань уроку, мотивація навчальної діяльності.
III. Удосконалення знань та вмінь учнів розв’язувати розрахункові задачі.
Учні самостійно розв’язують задачі за розданими їм картками. Відповідно до кількості розв’язаних задач виставляється оцінка за урок. Упевнитися у правильності розв’язання можна, звірившись із відповіддю та розв’язанням відповідної задачі на дошці.
Задачі, які пропонуються учням для розв’язування
1. Під час пропускання карбон (І V) оксиду крізь розчин кальцій гідроксиду добули сіль масою 80 г. Визначте об’єм карбон (І V) оксиду (н. у.), який був пропущений крізь розчин.
2. Сульфатна кислота масою 16 г прореагувала з натрій гідроксидом. Обчисліть масу утвореної солі.
3. Натрій оксид масою 12,4 г розчинили у воді. Який об’єм карбон (І V) оксиду (н. у.) потрібний для реакції з добутим натрій гідроксидом?
4. Який об’єм карбон (І V) оксиду (н. у.) необхідно пропустити через розчин, що містить 4 г барій гідроксиду?
5. Обчисліть масу осаду, одержаного дією натрій гідроксиду масою 20 г на купрум (ІІ) сульфат.
6. На реакцію з сульфатною кислотою використали калій гідроксид масою 14 г. Яка маса солі утворилася?
7. До розчину натрій гідроксиду долили нітратної кислоти масою 18 г. Яка маса лугу була в розчині?
8. Реакцією термічного розкладу купрум (ІІ) гідроксиду було добуто 3,2 г купрум(ІІ) оксиду. Яка маса основи розклалася?
9. Яку кількість речовини ферум (ІІІ) оксиду можна добути в результаті термічного розкладу відповідної основи масою 4, 28 г?
10. З алюмінію масою 81 г отримали оксид, який розчинили в натрій гідроксиді. Яка маса натрій гідроксиду вступила в реакцію?
VІПідсумки уроку;повідомлення домашнього завдання.
Скласти і розвʼязати задачу.
Урок 68
Тема:Семінарське заняття з теми: «Основні класи неорганічних сполук».
Мета:Узагальнити, систематизувати та скоригувати знання учнів з теми «Основні класи неорганічних сполук». З'ясувати рівень засвоєння знань, умінь і навичок про класи неорганічних сполук на прикладі оксидів, основ, кислот і солей, їх фізичних і хімічних властивостей, способи одержання, рівень розуміння основних понять, уміння використовувати їх на практиці.
Формування компетентностей: Навчально-пізнавальна, комунікативна, саморозвитку та самоосвіти, здоров’язберігаюча .
Тип уроку: семінарське заняття.
Хід уроку
Семінар двоелементний. Тобто складається з коректуючої і навчаючої частин, які тривають протягом однієї навчальної години.
Вчитель вибірково перевіряє і оцінює результати групової роботи окремих учнів на уроці.
Письмові завдання навчаючої частини учні виконують у двох екземплярах (під копірку). Один з екземплярів здається вчителю після уроку на перевірку.
Коректуючи частина.
(усна перевірка знань) 10 хвилин
Учні працюють в групах. Запитання надруковані і роздані групам.
Опитування проводить консультант і оцінює відповіді в обліковій картці.
1. Які речовини називаються оксидами?
2. Як класифікують оксиди?
3. Перерахуйте хімічні властивості оксидів.
4. Які речовини називаються кислотами?
5. За якими ознаками класифікують кислоти?
6. Перерахуйте хімічні властивостікислот.
7. Які речовини називаються основами?
8. Як класифікують основи?
9. Перерахуйте хімічні властивості кислот.
10. Які речовини називаються солями?
11. Перерахуйте хімічні властивості солей.
12. Назвіть способи добування оксидів.
13. Назвіть способи добування основ.
14. Назвіть способи добування кислот.
15. Назвіть способи добування солей.
Навчаюча частина.
35 хвилин.
І варіант.
1. Написати рівняння нейтралізації, в результаті яких утворюються такі солі:BaSO4, CuCl2, Na2S, K3PO4.
2. Написати по чотири неоднотипні рівняння хімічних реакцій, в результаті яких утворюються: сульфур(IV)оксид, натрій гідроксид.
3. Напишіть рівняння реакцій за допомогою яких можна здійснити перетворення:
Ca→CaO→Ca(NO3)2 →CaSO4
4.Яку масу солі можна добути від дії нітратної кислоти на розчин, що містить 1,25 моль натрій гідроксиду?
5. Який об’єм карбон (І V) оксиду виділиться (н.у.), якщо нанатрій карбонат масою 53 г подіяти надлишком сульфатної кислоти?
ІІ варіант.
1. Написати рівняння нейтралізації, в результаті яких утворюються такі солі:Na2SO4, AlCl3, Ca(NO3)2, NaPO3.
2. Написати по чотири неоднотипні рівняння хімічних реакцій, в результаті яких утворюються: карбон(IV)оксид, калій гідроксид.
3. Напишіть рівняння реакцій за допомогою яких можна здійснити перетворення:
Al→Al2(SO4)3→Al(OH)3→Al2O3
4.Яка маса осаду барій сульфату утвориться, якщо до розчину, що містить 2,61 г барій нітрату, додати натрій сульфат?
5.На ферум(ІІІ)гідроксид кількістю речовини 0,75 моль подіяли сульфатною кислотою. Визначіть масу солі, що при цьому утворилася.
Урок 69
Тема:Контрольна роботаз теми «Основні класи неорганічних сполук».
Мета:Узагальнити й систематизувати знання учнів з теми «Основні класи неорганічних сполук». Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Формування компетентностей:Загальнопредметна, продуктивної творчості, саморозвитку і самоосвіти.
Тип уроку :урок контролю та коригування знань, уміньі навичок
Обладнання : картки – завдання
Хід уроку
І.Організаційний етап
ІІ. Письмова контрольна робота
|
Оцінювання тестових завдань з теми |
Завдання |
Кількість балів |
Час |
|
8 кл. Основні класи неорганічних сполук |
1 - 16 |
0,5 |
30 - 35 хв. |
|
17 – 18 |
1 |
||
|
19 |
2 |
Варіант № 1
Виберіть одну правильну відповідь
1 Вкажіть складові частини кислот:
А атом металу та гідроксогрупаВ атоми металу і кислотного залишку;
Б Гідроген і кислотний залишок; Г два елементи, одним з яких є Оксиген
2 Виберіть частинку, що входить до складу солі:
А SO32-; Б Mg(OH)2; В NO2; Г N2O
3 Вкажіть формулу ферум (III) гідроксиду:
А Fe3O4; Б KFeO3; В Fe(OH)3; Г Fe2O3
4 Виберіть формулу кислотного оксиду:
А NO2; Б Fe2O3; В Na2O; Г BaO
5 Вкажіть тип реакції 2Li+ 2H2O → 2LiOH + H2
А обміну; Б розкладу; В сполучення; Г заміщення
6 Вкажіть валентність кислотного залишку у AlPO4:
АI; Б III; В II; Г IV
7 Виберіть формулу оксиду металу, що утворює Cr(OH)3:
А CrO2; Б CrO3; В Cr2O3; Г CrO
8 Вкажіть значення відносної молекулярної маси цинк сульфату:
А 78 г/моль; Б 156 г/моль; В 161 г/моль; Г 70 г/моль
9 Обчислітькількістьречовинилугу, щовзаємодієз 6 мольалюмінійхлоридом: AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
А 18моль; Б 6 моль; В 12 моль; Г 3 моль
Виберіть кілька правильних відповідей
10 Вкажіть властивості характерні для карбон (IV) оксиду:
А рідина; Б бурий газ; В безбарвний газ; Г розчинний у воді
11 Вкажіть групи, що складаються з формул лугів:
А CsO, K2O, SrO; В KF, NaOH, FeO;
Б LiOH, Ba(OH)2, KOH; Г NaOH, KOH, Sr(OH)2
12 Виберіть з переліку формули одноосновних кислот:
А НNO3; Б К2CO3; В HBr; Г H3PO4
13 Випишіть речовини, з якими реагує магній оксид:
А СO2; Б HCl; В O2; Г BaO
14 Розмістіть метали у порядку збільшення їх активності:
А Mn; Б Sn; В Li; Г Cu
15 Встановіть відповідність між формулами сполук та їх назвами:
Формула Назва
|
1 |
|
|
2 |
|
|
3 |
|
1 СaCO3; Акальцій сульфіт;
2 K2SO3; Б сульфатна кислота;
3 H2SO4; В калій сульфіт;
Г кальцій карбонат
16 Встановіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
|
1 |
|
|
2 |
|
|
3 |
|
1 Zn(ОH)2 → А ZnS + H2O;
2 ZnCl2 + 2KOH → Б ZnO + 2KCl + H2O;
3 ZnO + H2S → В ZnO + H2O;
Г Zn(OH)2 + 2KCl
17 Закінчітьрівнянняхімічноїреакції: Mn(OH)2 + H2SO4 →
18 Здійснітьперетвореннязасхемою: PbO → PbJ2 → PbSO4
19 Обчисліть масу солі, що утвориться при взаємодії бромідної кислоти масою 32,4 г з магній оксидом
Варіант № 2
Виберіть одну правильну відповідь
1 Вкажіть складові частини солей:
А атоми металу і кислотного залишку;В Гідроген і кислотний залишок; Б два елементи, одним з яких є Г атом металу та гідроксогрупа Оксиген
2 Виберіть частинку, що входить до складу основ:
А SiO2; Б MgO; В O2; Г Na2+
3 Вкажіть формулу карбонатної кислоти:
А K2SiO3; Б H2CrO4; В H2CO3; Г H2SO3
4 Виберіть формулу амфотерного оксиду:
А Na2O2; Б ZnO; В N2O3; Г Mn2O7
5 Вкажіть тип реакції 2KMnO4 → K2MnO4 +MnO2 + O2
А сполучення; Б заміщення; В розкладу; Г обміну
6 Вкажіть валентність кислотного залишку у H2SiO3:
АIII; Б II; В IV; Г I
7 Виберіть формулу оксиду неметалу, що утворює Na2CO3:
А CO; Б Na2O2; В Na2O; Г CO2
8 Вкажіть значення відносної молекулярної маси магній нітрату:
А 148 г/моль; Б 74 г/моль; В 142 г/моль; Г 91 г/моль
9 Обчислітькількістьречовинисолі, щовзаємодієз 3 мольбромідноїкислоти: K2S + 2HBr → 2KBr+ H2S
А 2моль; Б 3 моль; В 1,5 моль; Г 6 моль
Виберіть кілька правильних відповідей
10 Вкажіть властивості характерні для натрій карбонату:
А рідина; Б тверда речовина; В розчинний у воді; Г безбарвний газ
11 Вкажіть групи, що складаються з формул кислотних оксидів:
А B2O3, MnO, J2O7; Б SO3, CO2,P2O3; В F2O, Br2O, NO; Г CrO, CO, SiO2
12 Виберіть з переліку формули двокислотних основ:
А NaOH; Б Sr(OH)2; В Ba(OH)2; Г KPO3
13 Випишіть речовини, з якими реагує бромідна кислота:
А FeO; Б H2; В Zn(OH)2; Г N2O
14 Розмістіть метали у порядку збільшення їх активності:
А Mg; Б Ba; В Cr; Г Ag
15 Встановіть відповідність між формулами сполук та їх назвами:
Формула Назва
|
1 |
|
|
2 |
|
|
3 |
|
1 K2СO3; Акалій сульфіт;
2 Mn(OH)2; Б магній гідроксид;
3 Mg(OH)2; В калій карбонат;
Г манган гідроксид
16 Встановіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
|
1 |
|
|
2 |
|
|
3 |
|
1 Fe(NO3)3 +AlBr3 → А FeBr2 + H2O;
2 FeO +2HBr → Б Fe2O3 + 3H2O;
3 2Fe(OH)3 → В FeO + H2O;
Г FeBr3 + Al(NO3)3
17 Закінчітьрівнянняхімічноїреакції: Zn3(PO4)2 + HBr→
18 Здійсніть перетворення за схемою: SO2 →SO3 → BaSO4
19 Обчисліть масу основи, що утвориться при взаємодії купрум (II) броміду з натрій гідроксидом масою 60 г
Бібліографія
1. Програма для загальноосвітніх навчальних закладів Хімія 7 – 9 класи. Затверджено Міністерством освіти і науки, молоді та спорту України. Наказ Міністерстваосвіти і науки, молоді та спорту України від 06. 06. 2012 р. № 666 «Про затвердження навчальних програм для загальноосвітніх навчальних закладів ІІ ступеня»
2. Общая химия. Глинка Н.Л.; под. ред..В.А.Рабиновича, - 5-е узд. - Киев: Вища школа. - 1982.
3. Березан О. Хімія. Тести для школярів і вступників у ВНЗ. - Тернопіль: підручники і посібники - 2007.
4. Хімія. Повний курс. Універсальний довідник для випускників та абітурієнтів /авт. Титаренко Н.В./ К: Літера ЛТД, 2011.
5. Григорович О.В. Хімічний експеримент у школі. 7-11 класи / Упорядкування О.В. Григорович, О.В. Невський – Х.: Веста:
Ранок, 2008. – 192 с.
6. Замулко О. І. Перевірка знань з хімії 8 клас.:Черкаси, 2009.
7. Стахаєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. Посібник для учнів і абітурієнтів, студентів та вчителів. - Тернопіль - Харків:
«Навчальна книга - Богдан» - «Гімназія», 1998.
9. http://teacherjournal.com.ua/
10. http:// metodportal.com/
12. http:// school.xvatit.com/
13. http://subject.com.ua/
14. http://elearning.sumdu.edu.ua/


про публікацію авторської розробки
Додати розробку