Дидактичний матеріал для 7 класу з хімії "Початкові хімічні поняття"
«Сучасна освіта та
інноваційний простір громади - 2018 »

Номінація: Авторський посібник з хімії
Дидактичні матеріали для 7 класу
«Початкові хімічні поняття»
Автор та упорядник
вчитель хімії
Кузьмінчук Вікторія Іванівна
2018
Анотація
Даний посібник містить матеріали, що відповідають навчальній програмі для 5-9 класів загальноосвітніх навчальних закладів (за новим Державним стандартом базової і повної загальної середньої освіти).
Матеріал розподілений за темами програми
Завдання розроблені для кожної теми, підібрані так, що їх можна застосувати для фронтальної, групової та індивідуальної роботи з учнями.
Для активізації пізнавальної діяльності учнів у посібнику містяться фотозавдання, які включають зображення предмета, явища, формули тощо і запитання до нього.
Посібник містить різноманітні ігрові завдання, завдання на послідовність, різноманітні задачі, які можуть бути використані як з метою перевірки рівня навчальних досягнень учнів, активізації навчальної діяльності учнів 7 класів відповідно до програми з хімії для загальноосвітніх навчальних закладів з відповідних тем, так і з метою самопідготовки учнів.
Введення
Тема досвіду: Дидактичні матеріали з хімії для 7 класу «Початкові хімічні поняття».
Автор досвіду: Кузьмінчук Вікторія Іванівна.
Адреса досвіду: Таращанська загальноосвітня школа Ι-ΙΙ ступенів.
Актуальність досвіду: Для зацікавлення дітей хімією та з метою поглиблення знань учнів про хімічні поняття, систематизації та узагальнення знань, формування в учнів умінь застосовувати знання з хімії в практичній діяльності, при вивчені інших предметів, робити висновки, формування в учнів наукового світогляду,розвитку пізнавального інтересу до предмету хімії виконана дана робота.
Ідея досвіду: в основу даного посібника вкладена ідея формування провідних якостей знань учнів: системність, доступність, глибину, усвідомленість, гнучкість; закріплювати кожну тему в системі знань учнів.
Розширювати знання учнів про раціональне використання речовин певних хімічних елементів, їх вплив на здоров’я людини та оточуюче середовище.
Формувати в учнів цілісне уявлення про природу; інтеграцію ідей та методів з точки зору системного підходу до пізнання природи.
Надати учням можливість проявити ініціативу та самостійність.
Стимулювати використання різноманітних методів вивчення теми: експеримент, інтерв’ю, вивчення літератури, пошук додаткової інформації .
Розвивати логічне, самостійне, креативне, критичне, образне та наукове мислення; активність, пізнавальний інтерес до предмету, природи в цілому
Формувати науковий світогляд школярів на основі ідей матеріальної єдності світу, закономірностей його розвитку, систематизувати та узагальнити певну інформацію про початкові хімічні поняття.
Технологія досвіду: представлений посібник забезпечить використання методу: дослідження, експерименту. Узагальнити, систематизувати знання про початкові хімічні поняття. Підвищення інтересу до хімії, переконання у необхідності розумного використання її досягнень, розширення власного кругозору.
Зміст
Вступ
Хімія — природнича наука. Речовини та їх перетворення у навколишньому
світі. Короткі відомості з історії хімії……………………………………………….6
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з
Обладнанням кабінету хімії та лабораторним посудом…………………………………………...........................................................8
Тема 1. Початкові хімічні поняття
Фізичні тіла. Матеріали. Речовини. Атоми, молекули.
Як вивчають речовини. Спостереження й експеримент у хімії………………….11
Фiзичні властивості речовин. Чисті речовини і суміші
(однорідні, неоднорідні). Способи розділення сумішей………………………….15
Атом, його склад. Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з періодичною системою хімічних елементів Д.І. Менделєєва……………………………………………………………………..18
Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів..23
Хімічні формули речовин. Прості та складні речовини………………………….25
Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи……………………………………………………………………………..30
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук……………………………………………………………………...33
Відносна молекулярна маса, її обчислення за хімічною формулою……………..35
Масова частка елемента в складній речовині……………………………………...38
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин………………………………………………………..44
Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння……………………………………………………………………..46
Список використаної літератури……………………………………………….52
Вступ
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії.
Доповніть твердження.
Хімія -_____________________________________________________________.
Графічний диктант.
1.Хімія – це наука про речовини та їх перетворення.
2.Речовини поширені тільки у повітрі.
3.Хімія це природнича наука.
4.Усі природничі науки не пов’язані між собою.
5.Хімія приносить людині лише користь.
6.Становлення науки хімії відбулося в XV столітті.
7. Склад та будову речовин вивчає фізика.
8.Діяльність хіміка неможлива без знання математики.
9. У природі лише в певний момент відбуваються хімічні процеси.
10. Слова : «Широко простягає хімія руки свої у справи людські», належать Антуану Лавуазьє
Гра «Шукач».
1.З кожного стовпця набору літер виберіть літери, що один раз зустрічаються у рядку.
З літер складіть слова-терміни, і ви дізнаєтеся, чим вони є для хімії як науки.
- 2. 3.
В А Р А Е В А П О Е О Р О О З Л А Л К Л О
Ф У Ч У О Ф У Р Е Р А Т В А Р Н Р О А М А
К Е В Е И К Е О С Р С Е Н С І В Р В Н В О
М И М Н А И М Г Н Л Г Л Я Л М С Е Т Е І М
4. 5. 6. 7.
Р Е Д Л Д Е Р П А Р А Е В А И А А Х О І О О
В А М В Е А В И Д И М И В Ч А Е А А М А І А
П Р О Н Р О П Е Н Т Н Н 2Н В В Я В Т И Ї И Т
З О Т О И О З
Завдання «Підбери слова».
Хімія як наука виникла в …………… . Багато таємниць, пов’язаних із перетвореннями речовин, знали лише ……………. . У давніх арабських країнах хімію називали ………… . У Середньовіччі алхімія поширилася в ………… . Чимало алхіміків намагалися добути …………. , що перетворював би будь-який метал на золото, запобігав старінню. Перші теорії перетворень з’явилися в ………., у другій половині ……….. століття, але були помилковими. У XVIII столітті було відкрито…………. . Нині хімія має міцний ………… фундамент. Замість деревини, скла,металів застосовують ………….. . За найвидатніші досягнення в хімії щороку одному або кільком ученим присуджують престижну нагороду - …………… .
Завдання на відповідність
1.Встановіть відповідність між речовиною та хімічним процесом (на основі власних спостережень).
1.живі істоти А) виявляє мийну дію
2.зелене листя Б) нейтралізує рештки кислот у роті
3.мило В) виводить деякі плями на одязі
4.зубна паста Г) вдихають кисень, видихають вуглекислий газ
5.харчова сода Д) розпушування тіста
6.оцет Е) вбирає вуглекислий газ і воду, утворює кисень
7.лимон Є) видаляє накип у чайнику
Фотозавдання.
1. Доповніть малюнки поясненнями.



![]() Хімія в навколишньому світі
Хімія в навколишньому світі





__________ ________ _______________ __________ ____________
Групова робота.
Вправа «Доповнення»
Група 1 1. Доповніть речення. Хімія — це наука про ____________. До суміжних наук, що пов’язані з хімією, належать _______________________.
Властивості та виробництво ліків вивчає ______________ хімія. Геохімія вивчає __________________ 2. Які основні завдання хімії?______________
Група 2 1. Доповніть речення. Предметом вивчення хімії є____________ До природничих наук крім хімії належать ____________________________
Вивченням речовин і процесів, що відбуваються в живих організмах, займається _________________________________________. Космохімія вивчає_____________________ . 2. Для яких промислових виробництв необхідні хімічні знання?_______________________________.
Творче завдання.
1.Підготувати розповідь з теми «Яким було б життя, якби люди не знали хімії».
2.Наведіть приклади знайомих вам речовин, що мають різні властивості.
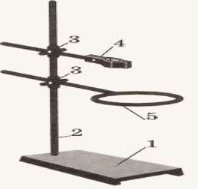
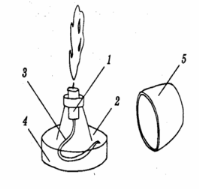
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом.
Тестування.
Виберіть правильні відповіді.
1.Заходити в кабінет хімії можна:
А) до дзвінка;
Б) з дозволу вчителя;
В) будь-коли.
2.Виконувати досліди можна:
А) порадившись із товаришем по парті;
Б) як тільки розпочався урок;
В) з дозволу вчителя.
3.Реактиви не можна:
А) пробувати на смак;
Б) брати руками;
В) нюхати.
4.Якщо в інструкції не вказано кількість твердої речовини, необхідної для досліду, її слід брати в кількості:
А) 1/6 пробірки;
Б) щоби вкрило дно пробірки;
В) 1/2 пробірки.
5.Речовину можна нюхати:
А) піднісши отвір пробірки до носа;
Б) спрямовуючи повітря помахом руки від отвору пробірки до носа.
6.Пробірку треба закріплювати в пробіркотримачі чи лапці штатива:
А) посередині;
Б) біля самого отвору;
В) будь-де.
7.Під час нагрівання речовин отвір пробірки повинен бути спрямований:
А) вгору;
Б) до себе;
В) убік від працюючих.
8.Нагрівати пробірку треба:
А) у нижній частині полум’я;
Б) у верхній частині полум’я;
В) посередині.
9.Нагрівати пробірку з речовиною треба:
А) тільки в тій частині, де міститься речовина;
Б) гріти всю пробірку;
В) спочатку прогріти всю, а потім ту частину, де міститься речовина.
10.Якщо ви налили забагато реактиву, то слід:
А) відлити надлишок назад у склянку;
Б) відлити надлишок реактиву в іншу пробірку;
В) взяти нову пробірку і знову відміряти потрібну кількість реактиву.
11.Якщо ви з необережності розлили або розсипали реактив, то потрібно:
А) швидко витерти чи змести його;
Б) повідомити вчителя або лаборанта;
В) залишити як є.
12.Після виконання роботи необхідно:
А) прибрати робоче місце;
Б) помити руки з милом;
В) залишити все на столі, щоби прибрав лаборант.
Фотозавдання.
1.Підпишіть хімічний посуд .

2.Вкажіть та підпишіть на що вказують забороняючі знаки.

3.Підпишіть наведені попереджувальні знаки. 
|
4.Позначте складові частини полум`я, штатива та спиртівки позначені на малюнках. |
||
|
|
|
|
|
А |
Б |
В |
Тема 1. Початкові хімічні поняття
Фізичні тіла. Матеріали. Речовини. Атоми, молекули.
Як вивчають речовини. Спостереження й експеримент у хімії.
Доповніть твердження.
Фізичне тіло - __________________________________________________
______________________________________________________________;
Матеріал - _____________________________________________________
______________________________________________________________;
Речовина - _____________________________________________________
_______________________________________________________________;
Аморфна речовина - _____________________________________________
______________________________________________________________;
Кристалічна речовина - __________________________________________
______________________________________________________________;
Спостереження - ________________________________________________
_______________________________________________________________;
Експеримент - __________________________________________________
_______________________________________________________________;
Атом - ________________________________________________________
______________________________________________________________;
Молекула - ____________________________________________________
______________________________________________________________;
Завдання «Розподіл»
1.З переліку, виберіть назви фізичних тіл (I варіант) та назви речовин
(II варіант). Відповідь записуйте під тим номером, який вказаний.
1. Цегла. 2. Сірка. 3. Залізо. 4. Плуг. 5. Мідь. 6. Кисень. 7. Парафінова свічка. 8. Залізний цвях. 9. Скло. 10. Колба. 11. Замерзла вода. 12. Алюмінієва ложка. 13. Кухонна сіль. 14. Цукор. 15. Алюміній. 16. Мідна монета. 17. Зелений чай. 18. Крейда. 19.Чашка. 20.Пенал. 21.Олівець.22.Пробірка. 23.Гума. 24.Цвях.
Вправа «Так чи ні»
Укажіть, під якими номерами дано правильні твердження, а під якими — ні. Відповідь записуємо словами «так» чи «ні».
1. Скло — фізичне тіло.
2. Вода — речовина.
3. Кисень — речовина.
4. Залізний цвях — речовина.
5. Алюміній — фізичне тіло.
6. Скляна колба — речовина.
7. Залізна підкова — фізичне тіло.
8. Кухонна сіль — фізичне тіло.
9. Порошок сірки — речовина.
10. Мідна пластинка — речовина.
11. Свинцева куля — фізичне тіло.
12. Вуглекислий газ — фізичне тіло
Гра «Знайди код»
1. Для читання шифрограми використайте український алфавіт, замінивши цифри на відповідну літеру в алфавіті.
25, 12, 17, 12, 33 – 18, 1, 24, 15, 1, 20,21,19, 21,7,28,19,3,11,18,11 23,1 13,26 20,7, 21,7,23,3,19,21,7,18,18,33.
Гра в «хрестики-нулики»
1. Однією лінією з’єднайте речовини.
Колба Стіл Дріт
Кисень Мідь Залізо
Вода Лінійка Шматок мила
2. Однією лінією з’єднайте фізичні тіла.
Алюміній Склянка Вода
Скляна паличка Парафінова свічка Залізо
Цвях Залізна трубка Золото
Гра «Про що йде мова?».
1.Біла кристалічна речовина, розчиняється у воді, після додавання окропу й оцту спінюється.
2.Білий порошок, скрипить на дотик, погано розчиняється у воді, з йодною настоянкою утворює синій осад.
3.Темно-сіра речовина, масна на дотик, не розчиняється у воді, м’яка, легко розшаровується, залишає на папері слід.
4. Біла кристалічна речовина, добре розчиняється у воді, солона на смак.
Робота з таблицею.
- Заповніть в таблиці пропущені рядки.
|
Речовина |
Тіло |
|
Скло |
|
|
Залізо |
|
|
Мідь |
|
|
Пластмаса |
|
|
Деревина |
|
|
|
Чашка |
|
|
М’яч |
|
|
Обручка |
|
Цукор |
|
|
|
Алюмінієва дротина |
|
Кухонна сіль |
|
|
|
Шматок крейди |
|
Алюміній |
|
|
|
Склянка |
|
Оцет |
|
|
Золото |
|
|
|
Ложка |
|
|
Свічка |
|
Олія |
|
Доповніть схему!
![]()
![]() Речовина
Речовина
________________ _________________
Приклади Приклади
__________________ ____________________
__________________ _____________________
![]()
![]()
![]() Агрегатний стан
Агрегатний стан
___________________ _______________ _________________
Приклад Приклад Приклад
___________________ _________________ _________________
___________________ _________________ _________________
![]()
![]() Склад атома
Склад атома
________________________ _______________________
________________________ Заряд _______________________
Фотозавдання.
|
1.Назвіть прилади, які використовують для спостереження. |
||
|
|
|
|
|
А |
Б |
В |
Поміркуй!
1.Наведіть приклади предметів, виготовлених: а) із скла; б) з алюмінію; в) з гуми; г) із сталі.
2.Використовуючи додаткові джерела інформації вкажіть за якими властивостями можна відрізнити між собою сталь, чавун, залізо? Які предмети з них виготовляють?
3.Чим подібні й чим відрізняються за властивостями кухонна сіль, питна сода, зубний порошок?
4. Що являється невід’ємною ознакою речовини?
5.У чому виявляється зв'язок між тілом і речовиною?
Фiзичні властивості речовин. Чисті речовини і суміші
(однорідні, неоднорідні). Способи розділення сумішей.
Доповніть твердження.
Властивості речовини - _____________________________________________
___________________________________________________________________;
Фізичні властивості - ________________________________________________
___________________________________________________________________;
Суміш - ____________________________________________________________
___________________________________________________________________;
Однорідна суміш - ___________________________________________________
____________________________________________________________________;
Неоднорідна суміш - __________________________________________________
____________________________________________________________________;
Чиста речовина - _____________________________________________________
____________________________________________________________________;
Фільтрат – __________________________________________________________
____________________________________________________________________.
Завдання «Хімічне асорті».
Варіант 1 1. У наведеному переліку підкресліть назви чистих речовин. Сірка, земля,мінеральна вода,цукор,мідь, пил, алюміній, повітря, кров, залізо.
2. Доповніть речення. Морська вода — (чиста речовина чи суміш), тому що . 3. Установіть послідовність операцій з розділення суміші піску, соди та заліза: 1. , 2. , 3. , 4. .
А фільтрування В дія магніту Б випарювання Г розчинення
Варіант 2. 1. У наведеному переліку підкресліть назви сумішей. Олово, варення, залізо, нафта, пил, сірка, морська вода, повітря, кисень, алюміній.
2. Доповніть речення. Очищене від пилу повітря — (чиста речовина чи суміш), тому що. 3. Установіть послідовність операцій з розділення суміші піску, тирси та солі: 1. , 2. , 3. , 4.
А випарювання В фільтрування Б відстоювання Г розчинення
Доповнення схеми.
![]()
![]() Методи розділення сумішей
Методи розділення сумішей
![]()
![]()
![]()
![]()
![]() Неоднорідних Однорідних
Неоднорідних Однорідних
__________ __________ ___________ ____________ __________
Фотозавдання.
|
1.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
Групові завдання.
Варіант 1.1.Виписати окремо назви тіл і назви речовин:пробірка, крейда, залізо, цвях,кокс, торф,алюмінієва ложка, вода, кисень,пластмаса, керамічний посуд,бавовна,вироби з капрону,нафта,гас,скло,водяна пара,труба,колба.
2.Якими способами можна очистити воду від бензину?На яких властивостях цих речовин ґрунтується їх розділення?
3.Навести приклади чистих речовин, які зустрічалися в природі. Відповідь обґрунтувати.
Варіант 2. 1.За якими ознаками можна визначити воду,гас, залізні ошурки?
2.Якими способами можна розділити дві тверді речовини, що мають різну розчинність у воді?Відповідь підтвердити прикладами.
3.Назвати речовини, якими користуються у побуті.
Варіант 3. 1.У яких випадках для розділення сумішей не можна використати ділильну лійку?Пояснити на конкретних прикладах.
2.За якими властивостями можна описати речовину? 3.Назвати суміші, що зустрічаються у природі.
Варіант 4. 1.Якими способами і в якій послідовності можна розділити суміш кухонної солі, деревного вугілля і залізних ошурок? На яких властивостях цих речовин ґрунтується їх розділення?
2.Які прилади використовують для визначення властивостей речовин, що перебувають у рідкому стані?
3.Чи спостерігається у природі явище розділення сумішей відстоюванням? Навести приклади.
Варіант 5. 1.За якими ознаками можна визначити етиловий спирт і воду? Які прилади для цього потрібні?
2.Чи можна встановити властивості речовини, якщо вона входить до складу суміші?Відповідь пояснити.
3.Які способи очистки речовин широко застосовуються в промисловості? Навести приклади.
Варіант 6. 1.Природну воду пропустили через фільтр. Чи можна вважати, що вона стала чистою речовиною?Якщо ні, то чому? Якими способами можна добути воду в чистому стані?
2.Чим відрізняються чисті речовини від сумішей?Відповідь пояснити.
3.Які природні суміші мають практичне значення в народному господарстві?
Атом, його склад. Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі. Ознайомлення з періодичною системою хімічних елементів Д.І. Менделєєва
Доповніть твердження.
Електрон - _______________________________________________________
________________________________________________________________;
Протон - ________________________________________________________
________________________________________________________________;
Йон -___________________________________________________________
________________________________________________________________;
Хімічний елемент - ________________________________________________
________________________________________________________________;
Порядковий номер -_______________________________________________
________________________________________________________________;
Період - _________________________________________________________
________________________________________________________________;
Група - _________________________________________________________
________________________________________________________________;
Завдання «Відповідність».
1.Знайдіть відповідність між назвами хімічних елементів та їхніми символами.
![]() Оксиген
Оксиген
![]() Ферум
Ферум
![]() Флуор
Флуор
![]() Хлор
Хлор
![]() Алюміній
Алюміній
![]() Фосфор
Фосфор
![]() Гелій
Гелій
![]()
![]() Іод
Іод
![]() Барій
Барій
![]() Купрум
Купрум
Вправа «Шифр».
1.Визначте за таблицею суміш, речовину або хімічний елемент. З обраних літер запишіть назву хімічного елемента.
|
Назва |
Хімічний елемент |
Речовина |
Суміш |
|
Ферум |
Г |
Д |
Ж |
|
Повітря |
З |
А |
Е |
|
Цукор |
П |
Р |
С |
|
Кухонна сіль |
Т |
М |
Н |
|
Оксиген |
А |
Б |
В |
|
Пил |
Г |
О |
Н |
|
Крейда |
Х |
І |
К |
|
Алюміній |
Й |
Л |
М |
Завдання «Назва елемента».
N O K C Na Si Au
_____ _____ ______ ______ _____ _____ ______
Cl H Ca S Fe Li Be
_____ _____ _______ ______ _____ ______ _____
Завдання «Координати».
1.Вкажіть «координати» в Періодичній системі (номер, період, група, підгрупа) для елементів, що мають такі порядкові номери:
3 – _____________________________________________________________
6 – _____________________________________________________________
12 – ____________________________________________________________
29 – _____________________________________________________________
17 – _____________________________________________________________
47 – _____________________________________________________________
8 – _____________________________________________________________
25 – _____________________________________________________________
16 – _____________________________________________________________
30 – _____________________________________________________________
Вправа «Знавець мови».
1.До певного слова додайте або відніміть певний склад, щоб отримати назву хімічного елемента:
Магніт – т +й =…………..
Мері – і + курка в множині +й =…………..
Кальмар – мар +ціль – ль +й =………………
Кафе – ка + румба – ба =…………………….
Сіль (і=у) +фурор – ор=……………………..
Перші звуки дитини +струм – ст =……………….
Інша назва церкви (а=о) =……………………..
Крик ворони +бонус – ус =……………………..
Б + напій піратів =…………………………………
Гра «Послання від видатних хіміків»
1.Завдання: розшифрувати послання за допомогою періодичної системи Менделєєва. Це зашифровані слова Ломоносова проте, яким повинен бути справжній хімік. Щоб виконати завдання потрібно використати перші літери хімічних елементів, якщо біля нього немає індексу. Індекс показує літеру з назви хімічного елементу.
Ir, S, Tb, Ti2, N, N, Ti2, I Cr, Ir, Mg, Ir, K
O, W, Zn2, N, Cs2, N Be, Cu2, Ti, Zn2
Ti, Be2, O, Re, Ne2, Ti, Zn2, Ca, O, Mg
Ir Pt, Cr2, As, K, Ti, Zn2, Ca, O, Mg
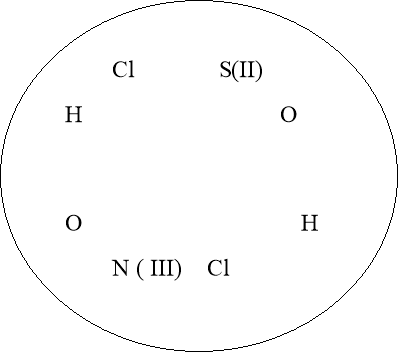
Гра «Хімічна астрологія».
![]() Ви всі мабуть читаєте гороскопи і захоплюєтесь ними, але кожна людина має не тільки свій знак зодіаку, камінь, але й хімічний елемент. Який саме ви зараз всі знайдете , кожен для себе, розрахувавши його. Установіть з допомогою формул хімічний елемент, пов’язаний з датою вашого народження.
Ви всі мабуть читаєте гороскопи і захоплюєтесь ними, але кожна людина має не тільки свій знак зодіаку, камінь, але й хімічний елемент. Який саме ви зараз всі знайдете , кожен для себе, розрахувавши його. Установіть з допомогою формул хімічний елемент, пов’язаний з датою вашого народження.
де N –порядковий номер хімічного елемента;
Х - число народження (1-31);
У – місяць народження (1-12);
Z – передостання цифра року народження (0-9);
U – остання цифра року народження (0-9).
Укажіть заряд ядра, кількість електронів,групу, період, підгрупу.
Гра «Загадайте номер».
- номер елемента збільшити вдвічі;
- до добутку додати 5;
- суму помножити на п'ять.
Відгадка:
Від повідомленого числа відкинути останню цифру; від отриманого числа віднімаємо 2; отримуємо число, яке ви загадували.
Гра «Відгадай елемент».
Сір, ні, он, ній, ге, а, не, ка, лій, зот, кель, маг – із даних складів потрібно скласти назви хімічних елементів.
Гра «Вправність».
Групова форма роботи. За 1 хв. написати всі хімічні елементи, які починаються:
І група - на «К»
ІІ група – на «Р»
ІІІ група - на «А»
Гра «Хто швидше?»
1. Скласти назви елементів із літер: а; б; л; м; е; р; с; х; о; н; г; к.
2. Утворити назви хімічних елементів з літер назви елемента з порядковим номером 91.
Вправа «Поширеність елементів».
1.Напишіть найпоширеніші елементи в:
Атмосфері - ……………………….;
Гідросфері - ………………………..;
Літосфері - …………………………;
Всесвіті - ……………………………;
2.Вставте пропущені слова
Розподіл елементів на нашій планеті вивчає наука ______________. Значний внесок у її розвиток зробив видатний учений _________________. Найпоширенішим елементом у живій природі є _______________________. Організм людини потребує понад _______ хімічних елементів, їх називають ___________________________.
Заповніть таблицю.
|
Хімічний елемент |
Символ елемента |
Вимова символу |
|
Гідроген |
|
|
|
|
|
Ес |
|
|
Аg |
|
|
Кальцій |
|
|
|
Літій |
|
|
|
|
С |
|
|
|
Вr |
|
|
|
|
О |
|
Силіцій |
|
|
|
|
Р |
|
|
|
|
Ен |
|
Алюміній |
|
|
|
|
Мg |
|
|
Ферум |
|
|
Вправа «Пригадай».
1.Заповніть таблицю.
|
Назва елементу |
Символ елементу |
Номер періоду |
Номер групи |
Порядковий номер |
|
Натрій |
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
45 |
|
Фосфор |
|
|
|
|
|
|
|
2 |
|
6 |
|
|
|
|
I |
47 |
|
Магній |
|
|
|
|
Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів.
Доповніть твердження.
Атом – _______________________________________________________________
_____________________________________________________________________;
Атомна одиниця маси – _____________________________________________________________________
_____________________________________________________________________;
Відносна атомна маса – _________________________________________________
_____________________________________________________________________;
Графічний диктант.
1.Важливою характеристикою атома є його маса.
2.Майже вся маса атома зосереджена в електроні.
3.Електрони мають настільки велику масу, що нею нехтують.
4.Атоми зважити на терезах неможливо.
5.Відносна атомна маса показує у скільки разів маса атома більша за 1/12 маси атома Карбону.
6.Позначають відносну атомну масу Ар.
7.Першу таблицю відносних атомних мас склав Дж. Дальтон.
8.Відносні атомні маси пропорційні масам молекул.
9.Співвідношення мас атомів такі самі,що й відносних атомних мас. 10.Майже всі хімічні елементи розміщені в періодичній системі за зростанням атомних мас.
Гра «Дешифрувальник»
Складіть з літер хімічний термін.
1. Дві перші літери назви елемента під порядковим номером 8.
2. Другу літеру елемента під порядковим номером 14.
3. Першу літеру елемента під порядковим номером 16.
4. Дві перші літери в назві елемента з порядковим номером 10.
5. Остання літера в назві елемента з порядковим номером 36.
6. Остання літера в назві елемента з порядковим номером 54.
7. Остання буква алфавіту.
Завдання «Пошук».
1.Знайдіть у Періодичній системі та випишіть окремо відносні атомні маси хімічних елементів:
А) 2-го періоду
![]() (Li) =7, _________________, ________________, ____________________,
(Li) =7, _________________, ________________, ____________________,
____________,______________,_______________,__________________.
Б) головної підгрупи I групи:
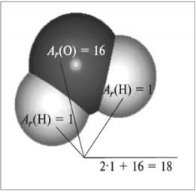
![]() (Н)=1, ___________________, __________________, _________________,
(Н)=1, ___________________, __________________, _________________,
________________,__________________,______________________.
Завдання «Евріка».
1.Користуючись періодичною системою , визначте елементи, яким відповідають подані відносні атомні маси:
![]() (Е) = 12, елемент – Карбон (С);
(Е) = 12, елемент – Карбон (С);
![]() (Е) = 24, елемент - ___________________;
(Е) = 24, елемент - ___________________;
![]() (Е) = 28, елемент – ___________________;
(Е) = 28, елемент – ___________________;
![]() (Е) = 9, елемент – ____________________;
(Е) = 9, елемент – ____________________;
![]() (Е) = 32, елемент – ____________________;
(Е) = 32, елемент – ____________________;
![]() (Е) = 56, елемент – ____________________;
(Е) = 56, елемент – ____________________;
![]() (Е) = 35,5, елемент – ___________________;
(Е) = 35,5, елемент – ___________________;
![]() (Е) = 16, елемент – _____________________;
(Е) = 16, елемент – _____________________;
![]() (Е) = 27 , елемент – _____________________;
(Е) = 27 , елемент – _____________________;
![]() (Е) = 23, елемент – _____________________;
(Е) = 23, елемент – _____________________;
![]() (Е) = 14, елемент – _____________________;
(Е) = 14, елемент – _____________________;
![]() (Е) = 64, елемент – _____________________;
(Е) = 64, елемент – _____________________;
Завдання «Порівняння».
1.Поставте знаки < , > або = замість крапок
![]() (О)……..
(О)…….. ![]() (S);
(S); ![]() (Mg)……..
(Mg)…….. ![]() (Al);
(Al); ![]() (Ca)……..
(Ca)…….. ![]() (P);
(P);
![]() (Li)……..
(Li)…….. ![]() (Na);
(Na); ![]() (F)……....
(F)…….... ![]() ( Fe);
( Fe); ![]() (Ag)……..
(Ag)…….. ![]() (Au);
(Au);
![]() (K)……..
(K)…….. ![]() (Si);
(Si); ![]() (B)………..
(B)……….. ![]() (Br);
(Br); ![]() (Mn)………
(Mn)………![]() (Cl);
(Cl);
![]() (He)……..
(He)…….. ![]() (N);
(N); ![]() (Cu)……….
(Cu)………. ![]() (Ba);
(Ba); ![]() (Hg)…………
(Hg)…………![]() (Pb);
(Pb);
Задачі
1.У 1819 р. шведський учений Йєнс Якоб Берцеліус опублікував таблицю атомних ваг (відносних атомних мас), у якій для Оксигену її прийнято за 100. Яких числових значень треба надати відносним атомним масам Гідрогену,Карбону, Сульфуру, якщо виходити із зазначеної величини для Оксигену.
2. У скільки разів маса 2 атомів Нітрогену менша від маси атома Криптону?
3.У скільки разів маса атома Аргону більша від маси 2 атомів Гідрогену?
Хімічні формули речовин. Прості та складні речовини.
Доповніть твердження.
Хімічна формула - ________________________________________________
________________________________________________________________;
Проста речовина - ________________________________________________
________________________________________________________________;
Складна речовина -________________________________________________
________________________________________________________________;
Коефіцієнт - _____________________________________________________
________________________________________________________________;
Індекс - __________________________________________________________
________________________________________________________________;
Алотропія – _____________________________________________________
______________________________________________________________.
Завдання «Що це?».
Вкажіть в яких випадках йдеться про хімічний елемент, а в яких – про просту речовину? (виправте помилки)
А) До складу малахіту входить мідь.___________________
Б) Дріт зроблений із міді.___________________________
В)У воді розчинений оксиген.__________________________
Г) До складу води входить оксиген.______________________
Д) До складу гемоглобіну крові входить ферум._______________
Е) В земній корі є значні поклади сірки._____________________
Завдання «Розподіл».
Розподіліть дані речовини на прості та складні.
KOH, C,![]() O, Ca
O, Ca![]() , CuO,
, CuO, ![]() O, Mg
O, Mg![]() ,Cu,
,Cu, ![]() , Si, S
, Si, S![]() , Ag,
, Ag, ![]() ,Al
,Al![]() ,
,
Na, ![]() ,
, ![]() ,
, ![]() C
C![]() ,
, ![]() , Fe, ZnS,
, Fe, ZnS, ![]() , HCl, N
, HCl, N![]() , Al, CO, Ca, Mg,
, Al, CO, Ca, Mg, ![]() .
.
Гра «Знайди пару»
З’єднайте попарно назву хімічного елемента та назву утвореної ним сполуки.
1. Аргентум А. Азот
2. Аурум Б. Водень
3. Гідроген В. Вуглець
4. Карбон Г. Золото
5. Меркурій Д. Кисень
6. Нітроген Е. Ртуть
7. Оксиген Ж. Сірка
8. Плюмбум З. Срібло
9. Сульфур И. Свинець
Завдання «Розшифруй».
1.Запишіть хімічні формули, які читаються так:
ес-о-два; ен-аш-три; кальцій-о; алюміній-два-о-три; о-два; аш-хлор; аш-два-це-о-три; магній-це-о-три; арґентум-два-о; силіцій-о-два; аш-ен-о-три; це-о-два; пе-два-о-п’ ять; алюміній-два-ес-о-чотири тричі; барій-хлор-два; ферум – о-аш тричі; кальцій -о-аш двічі; барій- три-пе-о-чотири двічі; це –шість-аш-дванадцять-о-шість; цинк-ес; аш-два-о-два; купрум-о; пе-хлор- п’ять.
2.Запишіть тривіальні назви хімічних формул складних речовин:
CO2 - _______________________________________
H2O - _______________________________________
SiO2 - _______________________________________
CO - ________________________________________
NaCl - _______________________________________
CaCO3 - ______________________________________
Завдання «Що означають записи?».
Поясніть, що означають дані записи:
3![]() , 2H,
, 2H, ![]() , HCl,
, HCl, ![]() ,
,![]() ,
, ![]() , Fe,
, Fe, ![]() ,
, ![]() , KOH, 7C,
, KOH, 7C,![]() O, Ca
O, Ca![]() , 4CuO,
, 4CuO, ![]() O, Mg
O, Mg![]() ,5Cu,
,5Cu, ![]() , Si, S
, Si, S![]() , 8Ag,
, 8Ag, ![]() ,2Al
,2Al![]() , 3Na,
, 3Na, ![]() ,3
,3 ![]() ,
, ![]() C
C![]() ,
, ![]() , 4Fe, ZnS,5
, 4Fe, ZnS,5 ![]() , HCl, N
, HCl, N![]() , 7Al, CO, Ca, Mg,
, 7Al, CO, Ca, Mg, ![]() .
.
Гра «Шифрограма»
Для читання шифрограми використовуйте тільки ті літери, які в рядку прямокутника зустрічаються один раз. Дотримавшись цієї вимоги, ви прочитаєте назви термінів, які використовуються для запису складу речовини.
Ф У О У Р І П Н П П К А О А Е
В М В У В А Д А А Е С Ф С І С
Л І А І І И И К И С Ц І Є Н Т
Завдання на відповідність.
Установіть відповідність між хімічною формулою і кількістю атомів Оксигену у відповідній формульній одиниці речовини.
Хімічні формули: Кількість атомів Оксигену
1.Fe(NO3)3 А) 5
2.FeC2O4 Б) 8
3.Fe(OH)2NO3 В) 7
4.FeOH(NO3)2 Г) 9
Д) 4
Заповніть таблицю.
|
Якісний склад речовини |
Кількісний склад речовини |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хімічний елемент |
Проста речовина |
Відносна атомна маса хімічного елемента |
|
Аргентум |
|
|
|
Аурум |
|
|
|
Меркурій |
|
|
|
Купрум |
|
|
|
Плюмбум |
|
|
|
Карбон |
|
|
|
Нітроген |
|
|
|
Оксиген |
|
|
|
Сульфур |
|
|
|
Фосфор |
|
|
|
Станум |
|
|
|
Ферум |
|
|
Групова робота за картками.
Картка 1. Безбарвна кристалічна речовина, добре розчиняється у воді, належить до найважливіших хімічних продуктів, у дуже великій кількості застосовується у склоробній, миловарній, текстильній і паперовій промисловості, а також у господарстві та в домашньому побуті. Надходить у продаж під назвою «кальцинована сода». Її молекула складається з 2 атомів Натрію, 1 атома Карбону,3 атомів Оксигену. Що це за речовина? Визначте її формулу.
Картка 2. Рідина з різким запахом, використовується для консервування овочів, заправляння салатів. Молекула її складається з 2 атомів Карбону, 4 атомів Гідрогену, 2 атомів Оксигену. Що це за речовина? Визначте її формулу.
Картка 3. Визначте формулу речовини, з якою ви добре знайомі, оскільки кожну подряпину мама обробляє вам саме нею. У чистому вигляді ця речовина є світло-блакитною рідиною, дуже вибухонебезпечною. А от її розчин використовують у медицині. Молекула складається з 2 атомів Гідрогену та 2 атомів Оксигену. Що це за речовина? Визначте її формулу.
Картка 4. Кристалічна речовина синього кольору, добре розчинна у воді. Застосовується для боротьби зі шкідниками сільського господарства. Її молекула складається з 1 атома Купруму, 1 атома Сульфуру, 4 атомів Оксигену. Що це за речовина? Визначте її формулу.
Картка 5. Прекрасні перли, мармурові статуї, черепашник, крейда утворені із солі, молекула якої складається з 1 атома Кальцію, 1 атома Карбону, 3 атомів Оксигену. Що це за сіль? Визначте її формулу.
Задача.
1.Який атом легший: а)Гідрогену чи Оксигену; б)Магнію чи Калію; в) Силіцію чи Літію; г) Аргентуму чи Сульфуру? У скільки разів?
Групові завдання (узагальнюючі).
Варіант 1.
1.Наведіть приклади простих речовин. Відповідь пояснити.
2.За якими ознаками розрізняють атоми різних елементів?
3.Зараз відомі близько 20000000 різних речовин, а елементів – усього лише 118. Як це пояснити?
Варіант 2.
1.Навести приклади складних речовин. Відповідь пояснити.
2.Пояснити, чого більше у природі: хімічних елементів чи простих речовин; простих чи складних речовин; Відповідь обґрунтувати.
3.Скільки видів атомів може входити до складу простої речовини і чому?
Варіант 3.
1. Виписати окремо речення, де говориться про кисень як просту речовину, а де – як про хімічний елемент: до складу повітря входить кисень, кисень підтримує горіння, кисень входить до складу води, киснем дихають живі істоти; кисень – складова частина мінералів.
2.Наведіть шість прикладів простих речовин.
3.Яка відмінність між поняттям «маса атома» і «атомна маса»?
Варіант 4.
1.У скільки разів маса атома Сульфуру більша чи менша від атома Оксигену, атома Феруму – від атома Гідрогену, атома Фосфору – від атома Карбону? (Скористатися таблицею атомних мас елементів).
2.Назвати п’ять складних речовин.
3.Чому кисень і водень належать до простих речовин, а вода – до складних?
Варіант 5.
1.Чи можна сказати, що оксид міді (II) СuО складається з двох речовин: міді і кисню? Якщо ні, то чому?
2.Назвати прості речовини, до складу яких входять такі елементи: Гідроген,Оксиген,Нітроген,Карбон.
3.З якими простими і складними речовинами, що мають практичне значення, ви зустрічаєтесь у побуті й у природі? Навести приклади.
Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи.
Доповніть твердження.
Метали –_____________________________________________________________
_____________________________________________________________________;
Неметали – ___________________________________________________________
_____________________________________________________________________;
Завдання «Знайти помилку».
У кожному рядку речовин знайдіть помилки.
А) Ag, Cu, Fe, F, Mg, S, O, Li, Si, Ca.
Б) O, F, H, K, S, Hg, Cl, Br, P, C, Al, I.
В) Li, K, Cu, Ag, Au, Ti, Zn, Hg, Cr, Pb.
Завдання «Пошук».
Серед запропонованих речовин випишіть металічні елементи.,неметалічні елементи, складні речовини.
![]() , H,
, H, ![]() , HCl,
, HCl, ![]() ,
,![]() ,
, ![]() , Fe,
, Fe, ![]() ,
, ![]() , KOH, C,
, KOH, C,![]() O, Ca
O, Ca![]() , CuO,
, CuO, ![]() O, Mg
O, Mg![]() ,Cu,
,Cu, ![]() , Si, S
, Si, S![]() , Ag,
, Ag, ![]() ,Al
,Al![]() , Na,
, Na, ![]() ,
, ![]() ,
, ![]() C
C![]() ,
, ![]() , Fe, ZnS,
, Fe, ZnS, ![]() , HCl, N
, HCl, N![]() , Al, CO, Ca, Mg,
, Al, CO, Ca, Mg, ![]() .
.
Дайте відповіді на запитання.
1.Наведіть приклади п’яти предметів, виготовлених з металів.
2.Які фізичні властивості легко визначити у металів, а які у неметалів. Відповідь обґрунтуйте.
3. У яких з наведених нижче речень іде мова про метал як просту речовину, а в яких – як про хімічний елемент: алюміній має широке практичне застосування; алюміній входить до складу сполук земної кори; хром має змінну валентність; свинець можна виділити з оксиду відновленням воднем; ртуть перебуває в рідкому стані; метали мають металічний блиск.
4.Протягом століть вважали, що хром, тантал, ніобій, титан, вольфрам, молібден – крихкі метали. Насправді вони м’які й пластичні. Пластичності їм надає очистка від Оксигену, Гідрогену, Карбону,Нітрогену. Позначити перелічені метали хімічними знаками.
5.В електротехніці і напівпровідниковій техніці застосовуються: уран, алюміній, магній, цирконій, натрій, калій, літій, берилій, бісмут, свинець, ртуть, золото, срібло, індій, галій, германій. Позначити перелічені метали хімічними знаками.
Задача.
1. У стародавні часи вважали, що існує лише сім металів.Алхіміки намагалися з допомогою «філософського каменя» будь-який метал перетворити на золото.Що це за сім металів? Чому алхіміки не хотіли вірити в те, що число металів може бути більше? Чим метали відрізняються від неметалів?
Заповніть таблицю.
Опишіть фізичні властивості металів та неметалів, порівнюючи їх.
|
Фізичні властивості |
Метал |
Неметал |
|
|
Залізо |
Сірка |
|
Агрегатний стан |
|
|
|
Колір |
|
|
|
Запах |
|
|
|
Розчинність у воді |
|
|
|
Температура плавлення |
|
|
|
Густина |
|
|
|
Теплопровідність |
|
|
|
Електропровідність |
|
|
Фотозавдання.
|
1.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук.
Допишіть визначення.
Валентність елемента - _____________________________________________
______________________________________________________________;
Графічна формула - _____________________________________________
______________________________________________________________;
Завдання «Складіть формулу».
Знаючи валентність елементів складіть формули речовин:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
![]() ;
; ![]() ;
; ![]()
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
![]()
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.
Завдання «Визначити валентність».
1.Визначте валентність атомів елементів у сполуках з Гідрогеном:
HBr, HCl, ![]() S, P
S, P![]() , HI, HF,
, HI, HF, ![]() .
.
2.Визначте валентність атомів елементів у сполуках з Оксигеном :
MgO, S![]() , FeO,
, FeO, ![]() O,
O, ![]() O, CO.
O, CO.
3.Визначте валентність у сполуках:
CaO, ![]() S, C
S, C![]() ,
, ![]() O, KBr,
O, KBr, ![]() , KCl, KOH, HCl, N
, KCl, KOH, HCl, N![]() .
.
Завдання «Евріка».
Правильно визначивши валентність елементів у сполуках з Оксигеном та Гідрогеном, ви прочитаєте слово – хімічний термін.
|
|
I |
II |
III |
IV |
V |
VI |
VII |
|
|
Е |
К |
Н |
Р |
З |
Л |
М |
|
|
П |
Л |
А |
О |
Д |
З |
Ж |
|
|
Ч |
Я |
Т |
Ф |
Е |
Ю |
С |
|
|
Б |
В |
Г |
М |
П |
Х |
К |
|
N |
И |
Щ |
Е |
У |
Ц |
С |
Р |
|
|
Г |
М |
О |
І |
Д |
Є |
Н |
|
S |
Р |
Й |
А |
И |
П |
Т |
З |
Завдання «Пошук».
1.Яка валентність Нітрогену, Фосфору, Силіцію, Сульфуру в сполуках, що мають формули: ![]() ,
, ![]() , HCl,
, HCl, ![]() ,
, ![]() S.
S.
2.Яка валентність елементів у сполуках, що мають формули: ZnS, ![]() S,
S, ![]() ,
, ![]() ,
,![]() .
.
3.Укажіть елементи, які в наведених сполуках є: а) одновалентними; б) двовалентними; в)тривалентними; г)чотиривалентними; д)п’яти валентними;
![]() O, HCl,
O, HCl, ![]() ,
,![]() , MgO, ZnO,
, MgO, ZnO, ![]() ,
, ![]() , CaO.
, CaO.
4.Напишіть формули сполук з Гідрогеном таких елементів: а)Нітрогену (III);
б) Силіцію (IV); в) Сульфуру (II); г) Брому (I).
5. Напишіть формули сполук з Оксигеном таких елементів: а)Магнію (II);
б) Фосфору (V); в) Силіцію (IV); г) Алюмінію (III); д) Мангану (VII);
е) Сульфуру (VI); є) Осмію (VIII).
Завдання «Коректор».
Виправити помилки у формулах:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Завдання «Хто швидше?».
I група II група
![]() P (V) C(IV)
P (V) C(IV)
N(III)
B ( III)
![]()
Pb (IV) S i(IV)
Ca Al
Тренувальні вправи.
|
Визначити валентність атомів елементів у сполуках |
Скласти хімічну формулу сполуки за валентністю атомів елементів |
|
1. Al2O3, Ag2O, BaO, SiO2 , HBr |
1. IV II VII V I III PbO, HS, ClO, AsO, CsO, BiO |
|
2.SO3 , SiH4 ,Br2O5 ,CuO , Mn2O7 |
2. IV IV V II II III MoO, XeO, IO, HSe, MgO, BO |
|
3.SO2, Br2O7 , K2O, CO2 ,B2O3 |
3. VII VI II I III IV MnO, WO, CaO, NaO, AlO, PbO |
|
4.H2S, CaO, HI, MnO2, CH4 |
4. I II IV III III V CuO, AgO, NO, MoO, NH, PO |
|
5.Cu2O, MgO, Mn2O3, Hg2O, N2O5 |
5. I II II III VI III AgO, HTe, CuO, AuO, TeO, BiH |
|
6.MnO, NH3, P2O5, Cl2O7, CO |
6. III V II IV IV I FeO, NO, VO, TiO, CH, KO |
|
7.PbO2, Li2O, MoO3, HCl, HgO |
7. II III I III VI IV MnO, SbO, HgO, SbH, TeO, CO |
|
8.N2O3, PH3, P2O5, Na2O, SeO3 |
8. II III V IV IV VII CO, PO, AsO, SiH, SiO, ClO |
|
9.Cl2O5, NO2,FeO,Br2O,H2Se |
9. II V III IV I VI TiO, SbO, AsH, GeO, LiO, CrO |
|
10.HF,SeO2, NO,ClO2, I2O5 |
10.III II VI IV VII I BO, SrO, SO, SnO, MnO, The |
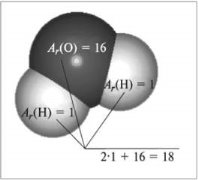
Відносна молекулярна маса, її обчислення за хімічною формулою.
Допишіть визначення.
Відносна молекулярна маса – ______________________________________
______________________________________________________________;
Завдання на обчислення .
Обчисліть: а) відносну молекулярну масу карбон (IV) оксиду СО2; Б) води H2O; В) сульфатної кислоти H2SO4; Г) мідного купоросу CuSO4 · 5H2O.
А)Mr (CO2) = Ar ( ) + 2Ar ( ) = ___________________;
Б) Mr (H2O) = ___________________________________________;
В) Mr (H2SO4) =____________________________________________;
Г) Mr (CuSO4 · 5H2O) = ____________________________________________.
Завдання «Склади і знайди!».
Складіть формулу речовини , молекули яких складаються: А) з двох атомів Ферему і трьох атомів Оксигену; Б) з одного атома Сульфуру і двох атомів Оксигену; В) з одного атома Нітрогену і двох атомів Оксигену; Г) з двох атомів Фосфору і п’яти атомів Оксигену. Обчисліть їхні відносні молекулярні маси.
А) _________________________________________________________;
Б)__________________________________________________________;
В)__________________________________________________________;
Г)__________________________________________________________.
Завдання «Порівняння».
Обчисліть відносні молекулярні маси речовин і поставте знаки < ,> або = замість крапок.
А) Mr (H2)…………. Mr (O2);
Б) Mr (CuO)……….. Mr (MgO);
В) Mr (HCl)………... Mr (HBr);
Г) Mr (MgO)……….. Mr (NaOH).
Завдання на відповідність.
Установіть відповідність між хімічними формулами та їх відносними молекулярними масами.
Хімічна формула Відносна атомна маса
1.P2O3 А) 342;
2.N2O3 Б)114;
3.H2S2O3 В) 80;
4.Al2(SO4)3 Г) 150;
Д) 76
Задачі.
1.До складу напою «Кока – кола» входить: ортофосфатна кислота (H3PO4), вода, вуглекислий газ, цукор (C12H22O11). Обчисліть відносні молекулярні маси речовин та розташуйте формули за порядком збільшення їхніх відносних молекулярних мас.
2. Маса елемента А у вісім разів більша, ніж у елемента В. Визначте елементи А і В, якщо сума мас атомів дорівнює 36 а.о.м. Напишіть формули сполук речовин елемента А з Оксигеном, де А проявляє всі можливі валентності. Напишіть структурні формули цих сполук.
3.Відносна молекулярна маса сполуки Карбону з Гідрогеном дорівнює відносній атомній масі Оксигену. Напишіть формулу цієї речовини.
4.Напишіть формули оксидів (сполук з Оксигеном) Нітрогену і Карбону, які мають однакову відносну молекулярну масу.
5.Невідомий елемент розташований у четвертій групі періодичної системи й утворює оксид (сполуку з Оксигеном), де він проявляє найвищу валентність. Маса цієї сполуки 60 а.о.м. Визначте цей елемент. Напишіть формулу цього елемента з Гідрогеном, де він проявляє таку саму валентність, що й в оксиді. Напишіть структурну формулу цієї сполуки, підрахуйте масу її молекули в а.о.м.
Фотозавдання.
|
1.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
2.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
Масова частка елемента в складній речовині.
Допишіть визначення.
Масова частка елемента в складній речовині – це відношення _______________________________________________________________;
W (E) = 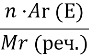 ;
;
Запишіть позначення:
W - __________________________________________________________;
n - ___________________________________________________________;
Ar - __________________________________________________________;
Mr - __________________________________________________________;
Задачі.
1.Допишіть пропущене розв’язання задачі.
![]() Дано: Розв’язання:
Дано: Розв’язання:
![]() H2O W (E) =
H2O W (E) = ![]() ;
;
W (H) - ? 1.Обчислюємо відносну молекулярну масу речовини:
W (O) - ? Mr (H2O) = _________________________________________
2.Знаходимо масові частки елементів за формулою:
W (H) =![]() = ________________________________
= ________________________________
W (O) = ____________________________________________
Відповідь: W(H) = _________________________________________
W (O) = _________________________________________________
2.А) Обчислити масові частки кожного хімічного елемента в сполуці NaNO3;
Б) Обчислити масові частки кожного хімічного елемента в сполуці KMnO4;
В) Обчислити масові частки кожного хімічного елемента в сполуці СaCO3;
Г) Обчислити масові частки кожного хімічного елемента в сполуці Al2 (SO4)3;
3.А) Молекула харчової соди складається з 1 атома Натрію, 1 атома Гідрогену, 1 атома Карбону та 3 атомів Оксигену. Визначте хімічну формулу сполуки. Обчисліть масову частку Карбону в сполуці.
Б) Молекула крейди складається з 1 атома Кальцію, 1 атома Карбону, 3 атомів Оксигену. Визначте хімічну формулу сполуки. Обчисліть масову частку Карбону в сполуці.
4. А) Яка масова частка води в мірабіліті Na2SO4 ·10H2O.
Б) Яка масова частка води в преципітаті CaHPO4 · 2H2O.
Гра «Хто швидше?».
1.Заповніть інформацію про речовину CBr4.
|
Проста чи складна речовина |
|
|
Якісний склад |
|
|
Кількісний склад |
|
|
Відношення мас елементів |
|
|
Відносна молекулярна маса |
|
|
Масові частки елементів |
|
2.Заповніть пропущені рядки в таблиці.
|
|
H |
Mr |
w(H) |
|
Si (IV) |
|
|
|
|
F (I) |
|
|
|
|
N (III) |
|
|
|
|
S (VI) |
|
|
|
|
P (III) |
|
|
|
Пошукова робота в групах.
Група 1.Обчислення маси елемента за відомою масовою часткою.
Різновид мінералу корунду, що має формулу Al2O3, є сапфір, який отримав свою назву за синій колір. Найбільший огранений сапфір – «Чорна зірка Квінсленду» масою 1444 карати (1 карат =0,2 г). Обчисліть масу атомів Алюмінію в цьому сапфірі.
Група 2. Виведення формул речовин за масовими частками елементів.
Аметист – фіолетовий напівкоштовний камінь. За нагрівання до 200о С камінь знебарвлюється, але під час охолодження забарвлення повертається знову. Це найкрасивіший різновид кварцу. Виведіть формулу кварцу, якщо відомо, що масова частка Силіцію в ньому – 46,6%, Оксигену – 53, 4%, а відносна молекулярна маса сполуки – 60.
Група 3.Обчислення маси сполуки за відомою масовою часткою елемента.
«Камінь, що висікає вогонь», - так називали пірит за його здатність давати іскри під час удару. Його формула FeS2. Обчисліть, у якій масі піриту міститься 230 г атомів Феруму.
Група 4.Обчислення масової частки елемента в сполуці.
Родохрозит – один із найдавніших самоцвітів, відомих людству. Його назва перекладається як «колір троянди». І якщо в наш час його здебільшого використовують як руду для отримання марганцю, то тисячоліття тому він виконував тільки естетичну функцію. Вважають, що родохрозит робить людину більш енергійною та завзятою. Основна складова родохрозиту – MnCO3. Обчисліть масову частку всіх елементів у сполуці.
Група 5.Обчислення масової частки елемента в сполуці.
Азурит – мінерал синього кольору, що має хімічну формулу 2CuCO3 · Cu(OH)2. Основним застосуванням мінералу азуриту є колекціонування, і це цілком заслужено. Поціновувачів азуриту приваблює чудовий глибоко-синій відтінок кольору,кристали правильної форми зі скляним блиском. Адже насичено-сині камені в природі трапляються досить рідко. Кристал азуриту масою 150 г містить 83,1 г атомів Купруму. Обчисліть масову частку Купруму в цьому кристалі.
Група 6.Розв’язування задач на виведення хімічної формули речовини за відомими масовими частками.
Вивести формулу сполуки, що містить 40% Купруму, 20% Сульфуру та 40% Оксигену. Розчин цієї речовини використовують для обрискування дерев і чагарників, уражених грибковими хворобами, паршею, антракнозом та шкідниками.
Задачі на обчислення за хімічними формулами (масова частка й масове відношення хімічних елементів у речовині).
Варіант 1.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з двох атомів Калію, одного атома Сульфуру, чотирьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині Ca3N2.
3.Обчисли масове відношення елементів Фосфору й Оксигену в P2O3.
4.Обчисли в якій речовині більший уміст металу – у CuCl2 чи Cu2O?
5.Яка маса Феруму міститься у 15,4 г ферум (II) нітриду?
Варіант 2.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з двох атомів Натрію, одного атома Силіцію, трьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині Cl2O7.
3.Обчисли масове відношення елементів Магнію й Брому в MgBr2.
4.Обчисли в якій речовині більший уміст металу – у Fe2O3 чи FeF2?
5.Яка маса Купруму міститься у 1,6 г купрум (II) сульфіду?
Варіант 3.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з одного атома Аргентуму, одного атома Нітрогену, трьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині HgBr2.
3.Обчисли масове відношення елементів Феруму та Хлору в FeCl3.
4.Обчисли в якій речовині більший уміст металу – у PbO2 чи Pb3P2?
5.Яка маса Кальцію міститься у 29,4 г кальцій йодиду?
Варіант 4.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з одного атома Барію, одного атома Карбону, трьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині N2O5.
3.Обчисли масове відношення елементів Купруму й Сульфуру в Cu2S.
4.Обчисли в якій речовині більший уміст металу – у Fe2O3 чи FeBr3?
5.Яка маса Цинку міститься у 13,6 г цинк хлориду?
Варіант 5.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з одного атома Алюмінію, одного атома Фосфору, чотирьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині Br2O3.
3.Обчисли масове відношення елементів Цинку й Іоду в ZnI2.
4.Обчисли в якій речовині більший уміст металу – у MnO2 чи MnS?
5.Яка маса Плюмбуму міститься у 6,83 г плюмбум (II) фосфіду?
Варіант 6.
1.Обчисли відносну молекулярну(формульну) масу речовини, яка складається з одного атома Цинку, одного атома Карбону, трьох атомів Оксигену.
2.Визнач масові частки хімічних елементів у речовині N3P.
3.Обчисли масове відношення елементів Плюмбуму й Флуору в PbF2.
4.Обчисли в якій речовині більший уміст металу – у K2S чи K3N?
5.Яка маса Барію міститься у 2 г барій броміду?
Задачі на виведення формул (за масовою часткою, за масовим відношенням, за загальними формулами)*.
Варіант 1.
1.Відносна молекулярна маса оксиду елемента другої групи головної підгрупи дорівнює 104. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Магнію в ній становить 13%, а Брому – 87%.
3.Виведи формулу речовини, якщо масове відношення Купруму й Сульфуру – 4:1.
4.Яка формула речовини, якщо w(Na) – 0,43, w(C) – 0,11, W(O) – 0,45.
Варіант 2.
1. Відносна молекулярна маса вищого оксиду елемента сьомої групи головної підгрупи дорівнює 366. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Нітрогену в ній становить 26%, а Оксигену – 74%.
3.Виведи формулу речовини, якщо масове відношення Брому й Оксигену – 10:3.
4.Яка формула речовини, якщо w(Ca) – 0,33, w(S) – 0,27, W(O) – 0,4.
Варіант 3.
1. Відносна молекулярна маса вищого оксиду елемента четвертої групи головної підгрупи дорівнює 151. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Натрію в ній становить 59%, а Сульфуру – 41%.
3.Виведи формулу речовини, якщо масове відношення Хрому й Оксигену – 13:6.
4.Яка формула речовини, якщо w(Ba) – 0,64, w(Si) – 0,13, W(O) – 0,22.
Варіант 4.
1. Відносна молекулярна маса вищого оксиду елемента третьої групи головної підгрупи дорівнює 278. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Фосфору в ній становить 22,5%, а Хлору – 77,45%.
3.Виведи формулу речовини, якщо масове відношення Феруму й Оксигену – 21:8.
4.Яка формула речовини, якщо w(K) – 0,39, w(N) – 0,14, W(O) – 0,47.
Варіант 5.
1. Відносна молекулярна маса вищого оксиду елемента шостої групи головної підгрупи дорівнює 127. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Калію в ній становить 85%, а Силіцію – 15%.
3.Виведи формулу речовини, якщо масове відношення Арсену й Сульфуру – 75:48.
4.Яка формула речовини, якщо w(Fe) – 0,37, w(S) – 0,21, W(O) – 0,42.
Варіант 6.
1. Відносна молекулярна маса вищого оксиду елемента першої групи головної підгрупи дорівнює 282. Визначте елемент, запиши його символ і назву.
2.Виведи формулу речовини, якщо відомо, що масова частка Барію в ній становить 35%, а Іоду – 65%.
3.Виведи формулу речовини, якщо масове відношення Кальцію й Карбону – 10:6.
4.Яка формула речовини, якщо w(Ag) – 0,77, w(P) – 0,07, W(O) – 0,15.
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин.
Доповніть твердження.
Явища –__________________________________________________________
_________________________________________________________________;
Хімічне явище – ___________________________________________________
_________________________________________________________________;
Фізичне явище – ___________________________________________________
_________________________________________________________________;
Вихідні речовини або реагенти – ______________________________________
__________________________________________________________________;
Продукти реакції – _________________________________________________
__________________________________________________________________;
Завдання «Допоможіть розібратися».
Повернувшись додому з уроку хімії, учень подумав: «Як же багато навколо хімічних явищ! Наприклад :
А)іде тепло від батереї опалення; Б) запалилася неонова реклама; В) горять іменинні свічки; Г) мама «гасить» соду оцтом, готуючи тісто; Д) олійна фарба висихає на повітрі; Е) скисає молоко, не випите кішкою; Ж) після включення комп’ютера змінюється колір екрана; З) після додавання цукру чай стає солодким; И) з відкритої пляшки «Фанти» виділяються бульбашки газу; К) на цвяхах у гаражі з’являється іржа. Допоможіть учневі розібратися, які процеси хімічні, а які фізичні.
Гра «Невідоме слово».
|
№ |
Твердження |
Так |
Ні |
|
1 |
У хімічних явищах одні речовини перетворюються на інші |
А |
У |
|
2 |
Добування цукрової пудри з цукру-піску – це хімічне явище |
Ш |
Н |
|
3 |
Горіння палива – це хімічне явище |
Ч |
Т |
|
4 |
Зміна форми тіла – це ознака хімічного процесу |
А |
И |
|
5 |
Поширення запаху парфумів – це фізичне явище |
Д |
Н |
|
6 |
Зміна агрегатного стану – це ознака фізичного явища |
О |
Е |
|
7 |
Утворення інею – це хімічне явище |
Ю |
І |
|
8 |
Виникнення полумя є ознакою хімічної реакції |
Р |
Л |
|
9 |
Фотосинтез – це фізичне явище |
Я |
Е |
|
10 |
У фізичних явищах склад речовини не змінюється |
П |
С |
Гра « Уважний хімік».
Визначте з пререліку явища, які відносяться до хімічних, а які до фізичних.
- Вода замерзає;
- Калюжі висихають;
- Залізо іржавіє у вологому повітрі;
- Сіль розчинилася у воді;
- Свічка горить;
- Сірку змішали із залізними ошурками;
- Магніт притягує залізні предмети;
- Гасіння питної соди оцтом;
- Молоко скисає;
- Сніг розтанув;
- У чайнику утворився накип;
- Почорніння срібних виробів;
- Утворення інею;
- Зі скла виготовляють пляшки, банки, інший посуд;
- Парафін плавиться;
- Змішування холодної і гарячої води;
- Спалюють дрова;
- Розчин фільтрують;
- Утворення туману;
- Шматочок цукру розтирають товкачиком;
- Спалили папір;
- Восени листя жовкне.
Заочна гра «Вигадай».
Згрупуйте слова в історію, яка б їх об’єднала: явище, природа, людина, вогонь,вода, життя, хімічний, повітря, фізичний, кисень, речовина, тепло, світло, сила, Всесвіт, краса.
Фотозавдання.
|
А |
Б |
В |
|
1.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння.
Доповніть твердження.
Закон – ___________________________________________________________
__________________________________________________________________;
Закон збереження маси – _____________________________________________
____________________________________________________________________;
Хімічне рівняння – __________________________________________________
__________________________________________________________________;
Запишіть, ким коли і як був відкритий закон збереження маси речовини________
__________________________________________________________________;
Завдання «Складаємо формули і записуємо рівняння реакцій».
Спочатку складіть формули продуктів реакцій (за валентністю), а потім підберіть коефіцієнти в схемах реакцій.
![]()
![]()
![]() H2 + S H....S Al + N2 Al…N Ca +N2 Ca…N
H2 + S H....S Al + N2 Al…N Ca +N2 Ca…N
![]()
![]() Al + I2 Al…I Al + O2 Al…O
Al + I2 Al…I Al + O2 Al…O
![]()
![]() Al + C Al…C Ca + O2 Ca…O
Al + C Al…C Ca + O2 Ca…O
Завдання «Розшифруй і запиши».
Запишіть рівняння реакції відповідно до опису.
1.Під час нагрівання води до температури 1000°С вона розкладається й утворюються два гази: водень і кисень.
2.Під час сильних злив із блискавкою в повітрі можуть реагувати азот і кисень і утворюватися нова сполука NO.
3.Білі кристали солі NH4NO2 під час нагрівання розкладаються з утворенням азоту й води.
4.Білі кристали солі NH4NO3 під час нагрівання розкладаються з утворенням веселильного газу N2O і води, а за температури вище 280°С – з утворенням трьох речовин:кисню, азоту й води.
5.Літій реагує з азотом за кімнатної температури, й утворюється сполука літій нітрид Li3N.
6.Азот реагує з воднем за високої температури й високого тиску з утворенням отруйного газу амоніаку NH3.
Вправа «Коректор».
В яких рівняннях реакцій неправильно підібрано коефіцієнти. Виправте помилки, підібравши правильні коефіцієнти.
CuO +2HNO3 =Cu(NO3)2 +2H2O
2LiOH + SO3 =Li2SO4 + 2H2O
3Fe + O2 =Fe3O4
4HNO3 =NO2 + 2H2O +O2
2NaOH + H2CO3 =Na2CO3 + H2O
Задачі.
1.Обчисліть кількість вихідних або добутих речовин, користуючись законом збереження маси речовин.
А) При спалюванні магнію масою 4,8 г у кисні утворився магній оксид масою 8 г. Обчисліть масу кисню, яка сполучилася з магнієм.
Б) Нагріванням меркурій (II) оксиду було добуто ртуть масою 20,1 г і кисень масою 1,6 г. Обчисліть масу меркурій (II) оксиду, який розклався.
Тренувальні вправи.
Урівняйте схеми реакцій:
1. Hg → Hg + O2; 31. KOH + AlCl3 → Al(OH)3 + KCl;
2. Zn + H2SO4 → ZnSO4 + H2; 32. CH4 + O2 → CO2 + H2O;
3. Na2S + Pb(NO3)2 → PbS + NaNO3 33. FeO + HCl → FeCl2 + H2;
4. Ca + O2 → CaO; 34. P2O5 + H2O → H3PO4;
5. Na + H2O → NaOH + H2; 35. Ag2O + HCl → AgCl2 + H2O;
6. MgO + H2SO4 → MgSO4 + H2O; 36. Na2O + CO2 → Na2CO3;
7. H2 + O2 → H2O; 37. KClO3 → KCl + O2;
8. Al2O3 + HCl → AlCl3 + H2O; 38. CaCO3 → CaO + CO2;
9. Ca(OH)2 + H2SO4 → CaSO4 + H2O 39. Mg(OH)2 → MgO + H2O;
10. Ba + H2O → Ba(OH)2 + H2; 40. P + O2 → P2O5;
11. NaCl + AgNO3 → AgCl + NaNO3; 41. Al + O2 → Al2O3
12. CaCl2 + NaOH → NaCl + Ca(OH)2; 42. HClO3 → HCl + O2;
13. Al + Cl2 → AlCl3; 43. SO2 + O2 → SO3;
14. Zn + H3PO4 → Zn3(PO4)2 + H2; 44. NO + O2 → NO2;
15. S + O2 → SO2; 45. Fe + Cl2 → FeCl3;
16. SO3 → SO2 + O2; 46. Mg + N2 → Mg3N2;
17. CaO + HCl → CaCl2 + H2O; 47. H2O + CO2 → H2CO3;
18. Ca(OH)2 + HCl → CaCl2 + H2O; 48. C2H6 + O2 → H2O + CO2 ;
19. MgCO3 + HCl → MgCO3 + CO2 + H2O; 49. N2 + H2 → NH3;
20. Fe + S → FeS; 50. H2 + F2 → HF;
21. O2 → O3; 51. H2O + SO3 → H2SO4;
22. H2 +Cl2 → HCl; 52. Al(OH)3 → Al2O3 + H2O;
23. NH3 + O2 → H2O + NO; 53. Cu + O2 → CuO;
24. NaOH + HCl → NaCl + H2O; 54. H2S + O2 → SO2 + H2O;
25. Zn + HCl → ZnCl2 + H2; 55. H2S + O2 → S + H2O;
26. CaO + H2O → Ca(OH)2; 56. NaCl + H2SO4→Na2SO4 + H2O;
27. K2O+ H3PO4 → K3PO4 + H2O; 57. CaC2 + H2O → Ca(OH)2 + C2H2;
28. Zn(OH)2 + NaOH → Na2ZnO2 + H2O; 58. SiH4 + O2 → H2O +SiO2;
29. Zn(OH)2 + HNO3 → Zn(NO3)2 + H2O; 59. H2O → H2 + O2;
30. Na + Br2 → NaBr; 60. CaO + P2O5 → Ca3(PO4)2
Групова робота.
I група
KСlO3 → KCl + O2; NaNO3 → NaNO2 + O2;
Ag + S → Ag2S; Na2 O + H2O → NaOH;
Hg + O2 → HgO; WO3 + H2 → W + H2 O;
(NH4)2CO3 → NH3 + CO2 + H2O; N2O5 + H2O → HNO3;
Al + S → Al2S3; HgO → Hg + O2.
II група
Cr + Cl2 → CrCl3; P2O5 + H2O → H3PO4;
Ca(NO3)2 → Ca(NO2)2 + O2; (NH4)2 Cr2 O7 → NH3 + Cr2O3 + H2O;
K + S → K2S; P + H2 → PH3;
Cu(OH)2 → CuO + H2O; Al2O3 + C → Al + CO2;
Al + HCl → AlCl3 + H2 ; FeO + O2 → Fe2O.
Завдання для лідерів.

Література
- Базелюк І.І. та ін. Довідкові матеріали з хімії. – Київ; Ірпінь:DNA «Перун»,1998.
- Баланюк Т., Максимов І. Зошит для практичних робіт з хімії, 8 клас. Навч. посібники, 2008.
- Буринська Н.М.Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Перун, 2014.
- Гладюк М. М. Дидактичний матеріал з хімії. 8 клас. — Тернопіль, 1999.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з хімії, 7 клас. К.: ЛВК, 20.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з з хімії, 8 клас. К.: ЛВК, 2014.
- Задорожний К.М. Хімія: Дидактичні матеріали до курсу. 7 клас [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2014. – 112 с. – (Бібліотека журналу «Хімія». Вип. 6 (54)).
- Максимов І., Баланюк Т., Берлізова О. Зошит для практичних робіт з хімії, 7 клас. К.: Навч. посібники, 2015.
- Максимов І.О., Філоненко І.О. Хімія. Визначення, закони, формули. Довідник для учнів 7-11 класів та вступників до вузів. К.: ЛВК, 2007.
- Попель П.П., Крикля Л.С. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Академія, 2014.
- Савчин М. М. Уроки хімії у 8 класі. — Львів, 1999. Тематичне оцінювання. Хімія. Різнорівневі завдання. — Х.: Торсінг, 2015
- Старовойтова І. Ю.Усі уроки хімії. 8 клас / І. Ю. Старовойтова, О. В. Люсай. – Х.: Вид. група «Основа», 2008. – 222, [2] с. – (Серія «12-річна школа»).
- Титаренко Н.В. Тести з неорганічної хімії. – К.: Перун, 1998.
- Хімія в побуті / За ред. Коваленка І.Р. – К., 1994.
- Хімія: Довідник для абітурієнтів та школярів загальноосвітніх навчальних закладів: навчально-методичний посібник. – Літера ЛТД, 2010. – 464 с.
- Хімія - завдання та відповіді зовнішнього незалежного оцінювання 2013 року
- Хімія - завдання та відповіді зовнішнього назалежного оцінювання 2016 року
- Хомченко Г. П. Збірник задач з хімії для вступників до вищих навчальних закладів / Г. П. Хомченко, І. Г.Хомченко; Пер. з рос. – К.: Арій, 2010. – 320
- Хомченко Г. П. Посібник з хімії для вступників до вищих навчальних закладів. 2-ге вид. вмправл. / Пер. з рос. – К.: Арій, 2008. – 480 с.: іл.
- Царьова Н. Хімія 8: Збірник рівневих завдань. — Тернопіль, 2004.
- Ярошенко О.Г. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Освіта, 2014.
Інтернет-сайти:
- mon.gov.ua;
- www.elnik.kiev.ua;
- library.tup.km.ua;
- http://chemists.at.ua;
- http://school.xvatit.com;
- http://osvita.ua
1

про публікацію авторської розробки
Додати розробку