Екологічний проєкт "Біотестування забруднення ґрунту та води за пророщеним насінням"
- Презентація.pptx pptx
- Проєкт.doc doc
Відділ освіти Охтирської районної державної адміністрації
Чернеччинська загальноосвітня школа І – ІІІ ступенів
(опорний заклад освіти)
Сумське територіальне відділення МАН
Відділення: Екологія та аграрні науки
Секція: Екологія
Біотестування
забруднення ґрунту та води
за пророщеним насінням
Роботу виконав:
Кириленко Юрій Васильович,
слухач МАН Охтирського районного центру дитячої та юнацької творчості,
учень 10 класу Чернеччинської ЗОШ
І – ІІІ супенів (опорний заклад освіти)
Науковий керівник:
Михайленко Ірина Володимирівна,
учитель хімії та біології
Чернеччинської ЗОШ
І –ІІІ супенів (опорний заклад освіти)
ЗМІСТ
Вступ………………………………………………………………………........3
Розділ І. Загальна характеристика біологічних індикаторів ……………….4
Розділ ІІ. Біоіндикація чинників забруднення довкілля…………………….6
2.1. Біологічні особливості тест-об’єкту……………………………………..6
2.2. Тест-реакція на вплив комплексу зовнішніх факторів…………………7
Розділ ІІІ. Практичні дослідження …………………………………………...9
3.1. Дослідження тест-фактору – грунт……….…………………………….10
3.2. Дослідження тест-фактору – вода……….…………….………………..10
Висновки ……………………………………………………………………...12
Список використаних джерел………………………………………………..14
Додатки ………………………………………………….…………………….15
ВСТУП
Біомоніторинг – оперативний моніторинг навколишнього середовища на основі спостережень за станом і поведінкою біологічних об’єктів. Провідним методом біомоніторингу є біотестування. Біологічне тестування – це засіб дослідження якості факторів середовища, що діють самостійно або спільно з іншими факторами. Стан середовища характеризується морфологічними та анатомічними ознаками, виживанням та поведінкою тест-об’єктів, які перебувають у цьому середовищі.
Біотестування має ряд переваг перед інструментальними методами:
- швидкість, доступність і простота проведення експериментів, відтворюваність і достовірність отриманих результатів, економічність як у матеріальному відношенні, так і за трудовитратами,
- об’єктивність отриманих даних,
- можливість характеризувати стан середовища за тривалий проміжок часу,
- висока чутливість живих організмів до екзогенного впливу,
- на відміну від фізичних і хімічних підходів до оцінювання забруднення, біологічне тестування має прогностичне значення — за станом біоти, її кількісними та якісними змінами можна передбачати зміни, які відбуватимуться із живими організмами за певного рівня забруднення,
- біотестування можна проводити на популяційно-видовому, організменому, органо-тканинному, клітинному, субклітинному та молекулярному рівнях,
- біота реагує на мінімальний токсичний вплив, який можуть не реєструвати технічні прилади.
Біотестування все частіше використовується у природоохоронній сфері для оцінювання екологічної якості природних середовищ (вод, ґрунтів), антропогенних субстратів, відходів, нових речовин, матеріалів тощо.
Розділ І. Загальна характеристика біологічних індикаторів
Біологічні індикатори – це організми чи сукупність організмів, присутність, кількість, особливості розвитку та фізіології яких вказують на природні процеси, умови та антропогенні зміни середовища їхнього проживання. Даний напрямок є досить перспективним, оскільки біологічні маркери є дуже чутливими, особливо це проявляється у мікроскопічних організмів, продуцентів первинної органічної речовини, які становлять основу ланцюгів живлення.
Для використання в якості біомонітора відбирають такі організми:
- із вираженою реакцією на вплив забруднюючої речовини, помітними ознаками ушкодження, зміни швидкості росту, морфологічних змін, порушення цвітіння, зміни продуктивності або врожайності;
- невибагливі до умов вирощування й догляду,
- які мало піддаються впливу шкідників та хвороб.
Актуальність теми полягає утому, що найбільшого впливу господарської діяльності людини зазнають урбанізовані екосистеми, тому важливим є оперативний контроль за станом навколишнього середовища та своєчасний аналіз забрудненості території міста в просторі і часі. Об’єкт дослідження: кресс-салат (Lepidium sativum L.) сорту «Афродита», квасоля сорту «Червона шапочка», редька.
Предмет дослідження: тест-реакція (або відповідна тест-функція) тест-об’єкта на вплив комплексу зовнішніх факторів. Кількісним вираженням тест-реакції є тест-параметр.
Мета дослідження:
- з’ясувати ефективність методу біотестування,
- довести, що якість ґрунту та води впливають на реакції тест-рослин, їхні морфологічні та фізіологічні особливості,
- показати перспективи використання методу.
Для досягнення цієї мети поставлені такі дослідницькі завдання:
- проаналізувати вплив полютантів на фізіологію та морфологію рослин,
- довести ефективність біотестування як доступного та економічного
методу для визначення полютантів та їх концентрацій на окремих ділянках.
Під час дослідження:
- проаналізовано вплив полютантів на фізіологію та морфологію тест-об’єктів,
- виявлено пряму залежність морфології та вегетації тест-об’єкту від хімічного складу ґрунту та води,
- вивчено вплив важких металів, оксидів Сульфуру та Нітрогену на морфологію та вегетацію тест-об’єкту,
- досліджено рівень забрудненості певної території.
Методи дослідження:
- аналіз теоретичних методик постановки експерименту,
- експеримент,
- спостереження,
- статистична обробка результатів.
Розділ ІІ. Біоіндикація чинників забруднення довкілля
Усі сторони сучасної діяльності людини є джерелом різних видів забруднення:
1. Вирубка лісів, осушення і зрошування земель, зміна мережі гідрографії, урбанізація території, промислові і побутові стоки, добрива, пестициди спричиняють за собою зміни режиму екосистем.
2. Розвиток атомної промисловості (радіоактивні осідання, поховання ядерних відходів, скидання ядерних електростанцій) веде до радіоактивного зараження водойм, з подальшою акумуляцією радіоактивних речовин в тілі водних організмів (риби) як безпосередньо з води, так і з об'єктів їх живлення.
3. Скидні води енергетичних підприємств сприяють тепловому забрудненню і є згубними для життя гідробіонтів. З промисловими стоками у водойми надходять важкі метали, хлорорганічні сполуки, пестициди, нафтопродукти.
4. Пестициди і добрива, що використовуються в сільському господарстві, потрапляють у водні об’єкти і створюють надлишок мінеральних речовин. Особливо небезпечними для тварин є амоніак і солі амонію.
5. Особливу небезпеку становлять сполуки оксидів Сульфуру і Нітрогену, що містяться у викидах автотранспорту, хімічних підприємств, випадають у вигляді кислотних дощів.
2.1. Біологічні особливості тест-об’єкту
Флористична характеристика: Крес-салат – однорічна рослина. Стебло може досягати висоти від 20 см до 1м. Нижні листки – черешкові, суцільно лопатеві, стеблові листки – суцільні, сидячі. Багаточисельні мілкі білі квітки зібрані в подовжені суцвіття – китицю. Плоди – яйцевидні крилі двонасінні стручки довжиною 5 – 6 мм. Насіння мілкі, гладкі, дещо приплюснуті, зберігають здатність до проростання 3 – 4 роки.
Біологічні особливості: Крес-салат - швидкоспіла холодостійка рослина, вимоглива до ґрунтової вологи. Помірно світлолюбива. Оптимальна температура для росту – 15 °С. Крес-салат з успіхом вирощують у холодну
пору року на підвіконні.
Крес-салат як тест-об’єкт має підвищену чутливість до забруднення грунту важкими металами та забруднення повітря газоподібними викидами автотранспорту. Цей біоіндикатор має досить швидкі темпи проростання і 97% - 100% проростання, яке помітно знижується в присутності забруднювачів довкілля. Пагони і корені під дією забруднювачів змінюються морфологічно (затримка росту, викривлення пагонів, зменшення довжини та маси вегетативних органів). Крес-салат досить зручний тест-об’єкт, так як дію стресорів можна вивчать одночасно на великій кількості рослин при мінімальній площі робочого місця (чашка Петрі, кювета, піддон тощо).
2.2. Тест-реакція на вплив комплексу зовнішніх факторів
Доволі простими у й той же час ефективними та порівняно недорогими є біологічні тести на проростання насіння. Метод біотестування токсичності субстратів за проростками різних тест-об’єктів має варіанти:
1) вирощування рослин на субстратах, токсичність яких треба оцінити (ґрунт, вода);
2) полив проростків досліджуваними розчинами (витяжкою з ґрунту або стічними водами різних підприємств) з тим чи іншим ступенем їх концентрації та очищення.
Під час досліду фіксують схожість, висоту пагонів і довжину коренів, масу сухої речовини надземної та підземної частин.
Існує багато сучасних підходів і до біотестування токсичності ґрунтів. Основою екологічного моніторингу токсичного забруднення ґрунту з використанням біологічних тест-об’єктів є уявлення про те, що ґрунт як середовище існування становить єдину систему з популяціями різних організмів, які населяють її. Забруднення ґрунту спричиняється різними за масштабом і територіальним поширенням полютантами, що впливають на ґрунт, ґрунтову біоту, сукупний стан ґрунтової екосистеми. Забруднення ґрунту може вплинути на його структуру, пористість і щільність горизонтів, що може призвести до зменшення аерації та дренажу. Це призводить до утруднення проростання насіння і проникнення коренів у ґрунт,
уповільнення росту коренів і пагонів.
Більшість дослідників використовують водні витяжки як модельні середовища для визначення твердих субстратів і ґрунтів. При цьому еталонним об’єктом, щодо якого оцінюють токсичність, у більшості випадків є дистильована вода. Згідно з міжнародними стандартом ISO - 11269, тест-культуру вирощують в умовах безпосереднього контакту з тест-об’єктом. При цьому контрольний ґрунт і досліджуваний ґрунт мають бути максимально подібними за структурою і складом (за винятком досліджуваних хімікатів і забруднювачів). Методика визначення фітотоксичності ґрунтів контактним тестом за стандартом ISO – 11269 ґрунтується на оцінюванні впливу токсичних компонентів на інтенсивність проростання насіння й ранні стадії росту (загальну біомасу й довжину коренів і наземної частини) ряду рослин. (13)
Розділ ІІІ. Практичні дослідження
Практичні дослідження проводяться за методикою Смикун Н. В. (10)
1. Перевірка партії насіння на проростання. На шар піску (1 см), накритий фільтрувальним папером, розкладаємо 50 насінин. Пісок і папір зволожуємо до насичення водою. Зверху насіння також накриваємо фільтрувальним папером. Пророщування проводимо 3 - 4 доби при температурі 20 – 25 °С. Нормою вважається проростання 90 – 95 % насіння.
2. Після перевірки насіння на проростання, його можна використовувати для експерименту, який проводимо за двома варіантами.
3. Пророщування здійснюємо за однакових температури й освітленості протягом 12 – 15 діб із щоденним спостереженням.
4. Фітотоксичний ефект обчислюємо за формулою:
Т = ![]() х 100 %,
х 100 %,
де: Х (контр.) — показник для тест-об'єкту у контрольній пробі,
Х (досл.) — показник для тест-об'єкту у досліджуваному зразку.
5. Для аналізу експерименту обробляємо статистичні дані. (Додаток № 1 - № 6).
Для діагностики рівня токсичності тест-фактору використовуємо градацію за Федоровим А. І. (11):
1 стадія – токсичність відсутня, дія полютантнів не впливає на вегетацію біоіндикатора, проростання насіння – 90 – 100 %, паростки міцні, з ровним стеблом,
2 стадія – дуже слабка токсичність, проростання насіння – 80 – 90 %, паростки міцні, з ровним стеблом,
3 стадія – середня токсичність, проростання насіння – 50 – 80 %, паростки порівняно із контрольними нижчі, стебла нерівні, тоненькі,
4 стадія – висока токсичність, проростання насіння – 20 – 50 %, паростки порівняно із контрольними набагато нижчі, стебло нерівне, тоненьке, деякі пагони мають ознаки хлорозу та некрозу,
5 стадія – дуже висока токсичність - проростання насіння – 0 – 20 %,
пагони мають ознаки хлорозу та некрозу, паростки гинуть після проростання на 3 – 5 день.
Великий вплив на проростання насіння має кислотність грунту та води. Для визначення кислотності середню пробу грунту, взятої з глибини 7 – 10 см, розводимо дистильованою водою (1:3), перемішуємо, даємо відстоятися 15 хвилин, випробовуємо універсальним індикаторним папірцем.
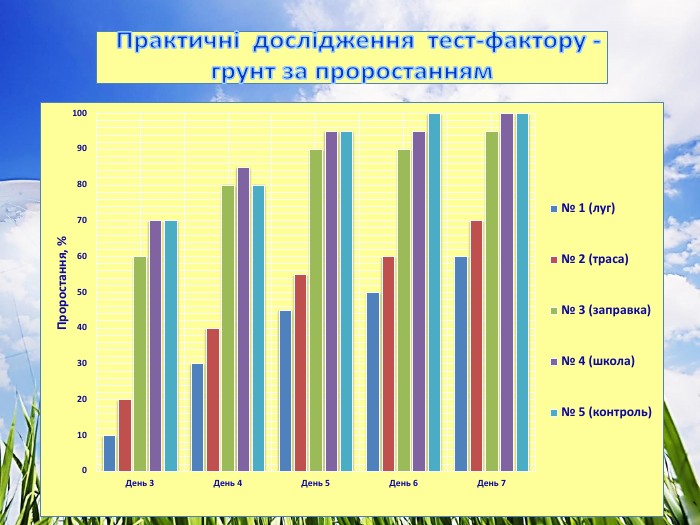
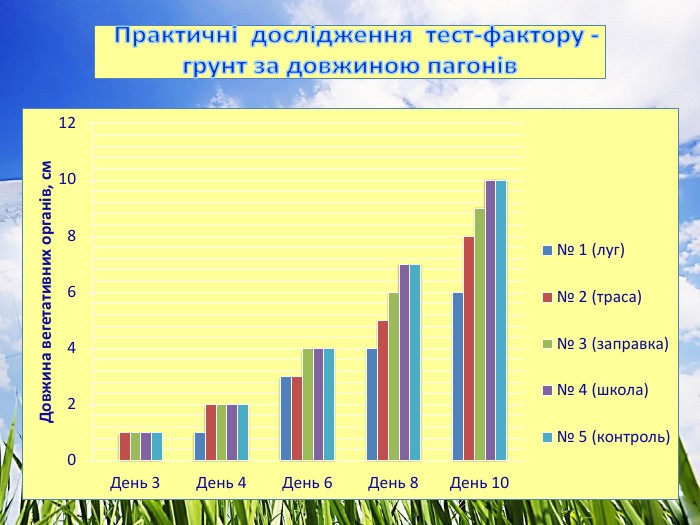
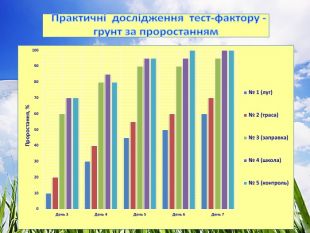
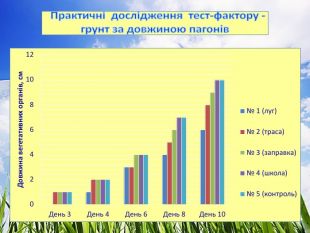
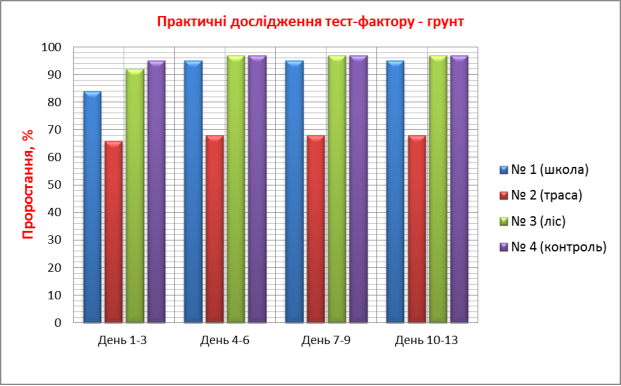
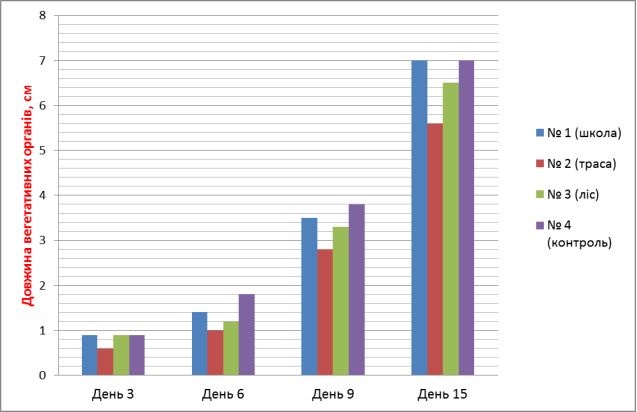
3.1. Практичні дослідження тест-фактору - грунт
Досліджували проби ґрунту (субстрату), який відбирали на трьох екологічно різних територіях. Полив здійснювали водопровідною відстояною водою.
Проба № 1 – грунт відібрано на території школи (дерново – підзолистий)
Проба № 2 – грунт відібрано понад автомобільною трасою міжобласного значення.
Проба № 3 – грунт відібрано в лісі (поблизу с. Риботень).
Проба № 4 – використали підготовлений комплексний грунт для кімнатних рослин (контроль).
Ознаки, за якими було проведено біотестування ґрунту:
- проростання, %, (Додаток №1)
- довжина вегетаційних органів, см, (Додаток № 2)
- щоденний приріст, см (Додаток №3)
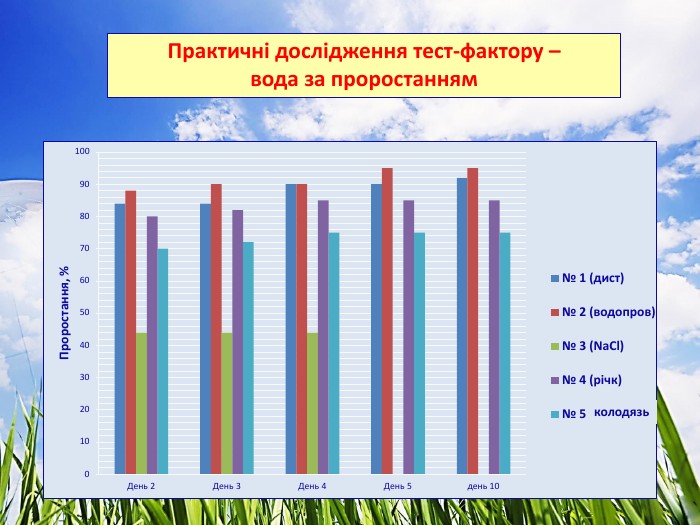
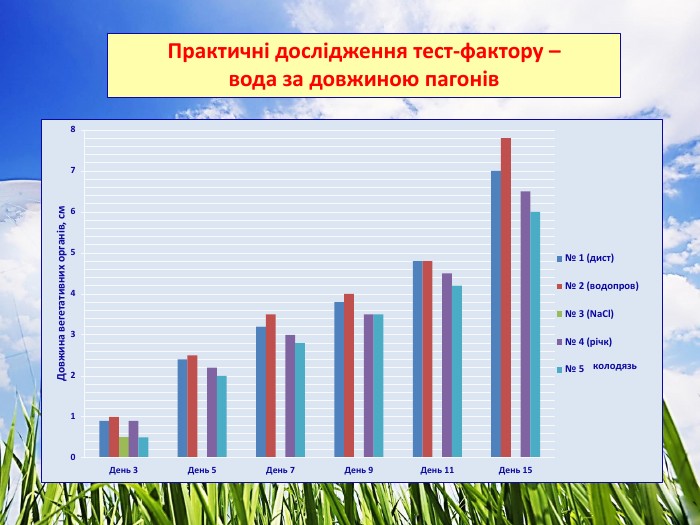
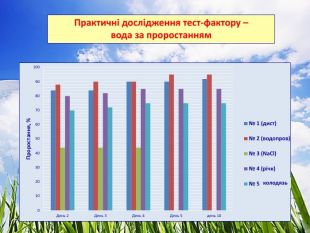
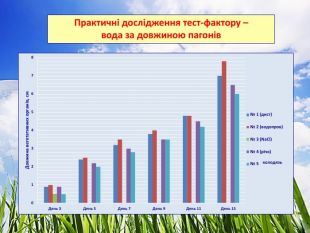
3.2. Практичні дослідження тест-фактору - вода
Досліджували проби води з різними хімічними показниками. Для цього варіанту використовували підготовлений комплексний грунт для кімнатних рослин. Полив здійснювали водою різної якості. Для біотестування використали проби води об’ємом не менше 500 см³ (10). Проби фільтрували через паперові фільтри для видалення завислих частинок не пізніше ніж через 2 год після відбору. Профільтровані проби зберігали у холодильнику.
Проба № 1 – вода дистильована (контроль).
Проба № 2 – вода водопровідна відстояна.
Проба № 3 – вода з W (NaCl) = 0,9 % (фізіологічний розчин).
Проба № 4 – вода відкритої водойми (р. Ворскла)
Проба № 5 – вода з колодязя.
Ознаки, за якими було проведено біотестування води:
- проростання, % (Додаток № 4)
- щоденний приріст, см (Додаток № 5)
- довжина вегетаційних органів, см (Додаток № 6)
Висновки
1. Як накопичувальний індикатор, крес-салат здатен концентрувати токсичні речовини, що в подальшому може використовуватися як тест-реакція. Отримані дані підтвердили, що крес-салат зручно використовувати в якості тест-об'єкта.
2. Кількісним показником морфологічних змін є показники проростання та приросту.
3. Показник проростання насіння найвищий (97 %) на грунтах проби № 3 (ліс) та проби № 4 (контроль - підготовлений комплексний грунт для кімнатних рослин), що свідчить про відсутність забруднення. Найнижчий показник проростання (68 %) – проба № 2 (автотраса) з фітотоксичним ефектом до 33 %. Вздовж автотраси накопичуються викиди продуктів горіння палива, солі важких металів, мікроелементів, кислот. Виявлено реакцію крес-салату на надлишковий вміст металів:
- міді - хлороз (пожовтіння) листків, пагонів,
- марганцю – хлороз та некроз, зморшкуватість молодих листків, викривлення пагонів,
- цинку – побіління листя, відмирання верхівкових бруньок, забарвлення жилок у рожевий колір,
- заліза – хлороз листків, при якому жилки залишаються зеленими, пізнє побіління листка. (14)
4. За показником довжини вегетативних органів найкращі результати виявлено у пробі № 1 (школа) – 7 см та пробі № 4 (контроль) – 7 см, найгірші – у пробі № 2 (траса) – 5.6 см. При цьому у фазі схожості насіння фітотоксичність проби № 2 (траса) досягає 44 %, що і впливає на подальший розвиток рослин.
5. Використання для поливу води з різними хімічними показниками зумовлено тим, що дистильована вода не має розчинних мінеральних солей, водопроводна вода має спеціальну підготовку, річкова вода містить сліди техногенного навантаження, вода з колодязя накопичує техногенні домішки, кислоти, солі металів, йони.
Солона вода (фізіологічний розчин) непридатна для поливу рослин.
Найкращі показники має водопроводна вода – проростання – 95 %, фітотоксичний ефект у порівнянні із контрольним – на 5 % більший. Вода з колодязя протягом тривалого часу накопичувала хімічні речовини, що вплинуло на проростання (75%), довжину вегетаційних органів і приріст (фітотоксичний ефект – 14 % і 11 % відповідно).
6. Великий вплив на проростання та схожість насіння має кислотність грунту та води. Найкисліший грунт проби № 2 (траса) та води проба № 5 (колодязь).
Список використаних джерел
- Боєчко Ф. Ф. Біологічна хімія: Навч. Посібник. - К .:Вища школа. 1995. - 536 с.
- Васильев А. Е., Воронин К. С., Еленевский А. Г., Серебрякова Т. И. Ботаника. Анатомия и морфология растений. - М.: Просвещение,2008. - 341 с.
- Гончарук Т. В. Науково-дослідницька діяльність старшокласників як ресурс розвитку творчого потенціалу / Т. В. Гончарук // Вісник Житомирського державного університету. Вип. 67. Педагогічні науки. — 2013. — С. 123–126.
- Горон М. З. Використання рослинних тест-систем для фітооцінки токсичності нафтозабруднених ґрунтів / М. З. Горон, Н. М. Джура // Матер. наук.-практ. конф. — Одеса: ОДЕКУ, 2011. — С. 17.
- Джура Н. М. Можливості використання рослинних тест-систем для біомоніторингу нафтозабруднених ґрунтів / Н. М. Джура // Біологічні Студії. — 2011. — Том 5 (№ 3). — С. 183–196.
- Довгалюк А. Забруднення довкілля токсичними металами та його індикація за допомогою рослинних тестових систем / А. Довгалюк // Біологічні Студії. — 2013. — Том 7, № 1. — С. 197–204.
- Лисовицкая О. В. Фитотестирование: основные подходы, проблемы лабораторного метода и современные решения / О. В. Лисовицкая, В. А. Терехова // Доклады по экологическому почвоведению. — 2010. — № 1. — Вып. 13. — С. 1–18.
- Москалик Г. Г. Біотестування питної води / Г. Г. Москалик. — Режим доступу: http://www.sworld.com.ua
- Парфенюк А.І. Сорти сільськогосподарських культур, як фактор біоконтролю фітопатогенних микроорганізмів в агрофітоценозах // Агроекологічний журнал. — 2009. — С. 248—250.
- Смикун Н. В. Біотестування колодязної води з використанням деяких рослин. / Н. В. Смикун, С. С. Фурман // Вісник Запорізького національного університету. — 2008. — № 2. — С. 183–185.
- Цингер Н. В., Размологов В. П. Биохимия и филогения растений. - М.:
Наука, 2002. - 354 с.
- Фітотестування як експрес-метод оцінки токсичності нафтозабруднених ґрунтів / [М. Горон, Н. Джура, О. Романюк та ін.] // Вісник Львівського університету. — 2012. — Вип. 58. — С. 185–192.
- Міжнародний стандарт ISO – 11269.
- Визначальник морфофізіологічних змін рослин на вплив окремих йонів. – Інтернет-ресурс.
Додатки
Додаток № 1
Проростання насіння на різних пробах грунту.
|
Проба грунту |
Проростання (фітотоксичний ефект), % |
||||
|
2 доби |
3 доби |
4 доби |
5 діб |
10 діб |
|
|
№ 1 (школа) |
84 (9) |
84 (12) |
90 (7) |
95 (2) |
95 (2) |
|
№ 2 (траса) |
66 (28) |
66 (31) |
68 (30) |
68 (30) |
68 (30) |
|
№ 3 (ліс) |
86 (7) |
92 (4) |
95 (2) |
97 (1) |
97 (1) |
|
№ 4 (контроль) |
92 (1) |
95 (1) |
97 (1) |
97 (1) |
97 (1) |
Додаток № 2
Довжина вегетаційних органів на різних пробах грунту.
|
Проба грунту |
Довжина (фітотоксичний ефект), см |
|||||||
|
3 доби |
4 доби |
5 діб |
7діб |
9 діб |
11 діб |
13 діб |
15 діб |
|
|
№ 1 (школа) |
0.9 (1) |
1.4 (2) |
2.1 (13) |
2.9 (9) |
3.5 (8) |
4.3 (10) |
5.4 (12) |
7.0 (1) |
|
№ 2 (траса) |
0.6 (33) |
1.0 (44) |
1.7 (29) |
2.3 (28) |
2.8 (26) |
3.5 (27) |
4.2 (31) |
5.6 (20) |
|
№ 3 (ліс) |
0.9 (1) |
1.2 (33) |
2.2 (8) |
2.7 (16) |
3.3 (13) |
4.5 (6) |
5.6 (8) |
6.5 ( 7) |
|
№ 4 (контроль) |
0.9 (1) |
1.8 (1) |
2.4 (1) |
3.2 (1) |
3.8 (1) |
4.8 (1) |
6.1 (1) |
7.0 (1) |
Додаток № 3
Приріст на різних пробах грунту.
|
Проба грунту |
Приріст (фітотоксичний ефект), см |
|||||||
|
3 доби |
4 доби |
5 діб |
7діб |
9 діб |
11 діб |
13 діб |
15 діб |
|
|
№ 1 (школа) |
0.9 (1) |
0.5 (44) |
0.7 (+10) |
0.8 (1) |
0.6 (1) |
0.8 (20) |
1.1 (15) |
1.6 (+31) |
|
№ 2 (траса) |
0.6 (33) |
0.4 (56) |
0.7 (+10) |
0.6 (25) |
0.5 (17) |
0.7 (30) |
0.7 (46) |
1.4 (+21) |
|
№ 3 (ліс) |
0.9 (1) |
0.3 (67) |
1.0 (+44) |
0.5 (38) |
0.6 (1) |
1.2 (+20) |
1.1 (15) |
0.9 (18) |
|
№ 4 (контроль) |
0.9 (1) |
0.9 (1) |
0.6 (1) |
0.8 (1) |
0.6 (1) |
1.0 (1) |
1.3 (1) |
1.1 (1) |
Додаток № 4
Проростання насіння з використанням різних проб води.
|
Проба води |
Проростання (фітотоксичний ефект), % |
||||
|
2 доби |
3 доби |
4 доби |
5 діб |
10 діб |
|
|
№ 1 (дистилят, контроль) |
84 (1) |
84 (1) |
90 (1) |
90 (1) |
92 (1) |
|
№ 2 (водопроводна) |
88 (+6) |
90 (+7) |
90 (1) |
95 (+6) |
95 (+5) |
|
№3 (0.9 %NaCl, фізрозчин) |
44 (48) |
44 (48) |
44 (51) |
відмирання |
відмирання |
|
№ 4 (річкова) |
80 (5) |
82 (2) |
85 (6) |
85 (7) |
85 (8) |
|
№ 5 (снігова) |
70 (17) |
72 (14) |
75 (17) |
75 (16) |
75 (19) |
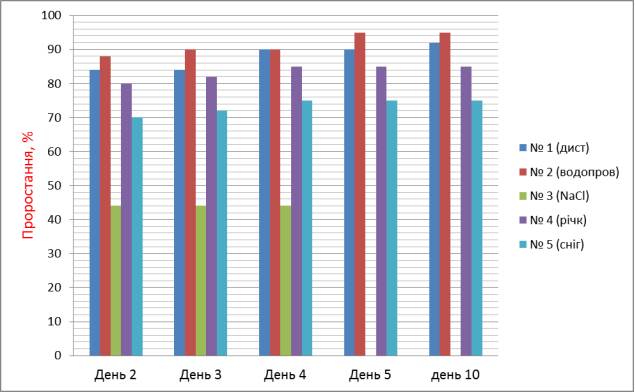
Додаток № 5
Довжина вегетаційних органів з використанням різних проб води.
|
Проба води |
Довжина (фітотоксичний ефект), см |
|||||||
|
3 доби |
4 доби |
5 діб |
7діб |
9 діб |
11 діб |
13 діб |
15 діб |
|
|
№ 1 (дистилят, контроль) |
0.9 (1) |
1.8 (1) |
2.4 (1) |
3.2 (1) |
3.8 (1) |
4.8 (1) |
6.1 (1) |
7.0 (1) |
|
№ 2 (водопроводна) |
1.0(+11) |
1.8 (1) |
2.5 (+4) |
3.5 (+9) |
4.0 (+5) |
4.8 |
6.5 (+7) |
7.8(+11) |
|
№3 (0.9 %NaCl, фізрозчин) |
0.5 (56) |
0.8 (56) |
відмир |
--- |
--- |
--- |
--- |
--- |
|
№ 4 (річкова) |
0.9 (1) |
1.8 (1) |
2.2 (8) |
3.0 (6) |
3.5 |
4.5 (8) |
5.2 (15) |
6.5 (7) |
|
№ 5 (снігова) |
0.5 (44) |
1.0 (44) |
2.0 (17) |
2.8 (12) |
3.5 |
4.2 (13) |
5.0 (18) |
6.0 (14) |
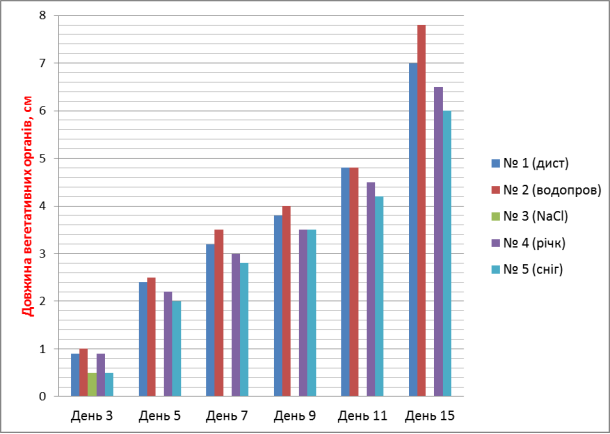
Додаток № 6
Приріст з використанням різних проб води.
|
Проба води |
Приріст (фітотоксичний ефект), см |
|||||||
|
3 доби |
4 доби |
5 діб |
7діб |
9 діб |
11 діб |
13 діб |
15 діб |
|
|
№ 1 (дистилят, контроль) |
0.9 (1) |
0.9 (1) |
0.6 (1) |
0.8 (1) |
0.6 (1) |
1.0 (1) |
1.3 (1) |
0.9 (1) |
|
№ 2 (водопро водна) |
1.0(+11) |
0.8 (1) |
0.7 (+17) |
1.0(+25) |
0.5 (17) |
0.8 (20) |
1.7(+31) |
1.3(+44) |
|
№ 3 (NaCl, фізрозчин) |
0.5 (56) |
0.3 (67) |
--- |
--- |
--- |
--- |
--- |
--- |
|
№ 4 (річкова) |
0.9 (1) |
0.9 (1) |
0.4 (33) |
0.8 (1) |
0.5 (17) |
1.0 (1) |
0.7 (46) |
1.3(+44) |
|
№ 5 (снігова) |
0.5 (44) |
0.5 (44) |
1.0 (83) |
0.8 (1) |
0.7(+17) |
0.7(30) |
0.8 (38) |
1.0 (11) |
1


про публікацію авторської розробки
Додати розробку