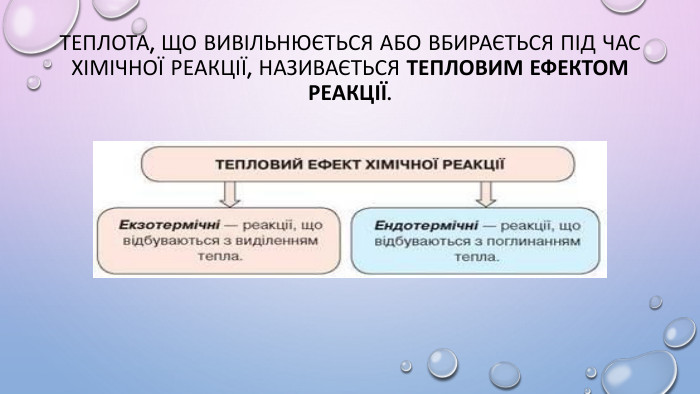
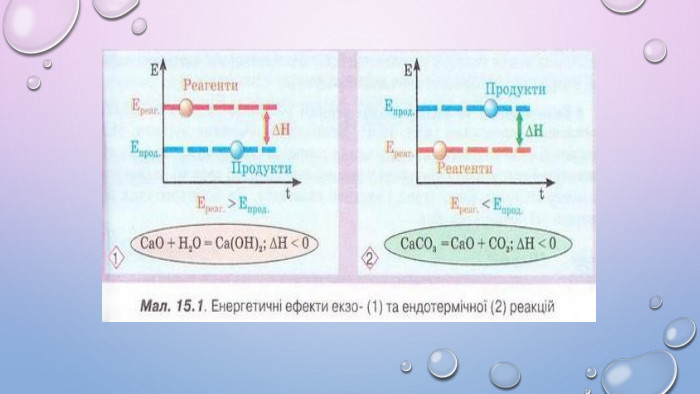
Екзотермічні та ендотермічні реакції. Термохімічні рівняння
Про матеріал
Матеріал та завдання на тему: "Екзотермічні та ендотермічні реакції. Термохімічні рівняння" ,в презентації основні правила та досліди в картинках , приклади термохімічних рівнянь , а також завдання на класифікацію хімічних реакцій за тепловими ефектами. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку