Оборотні та необоротні реакції

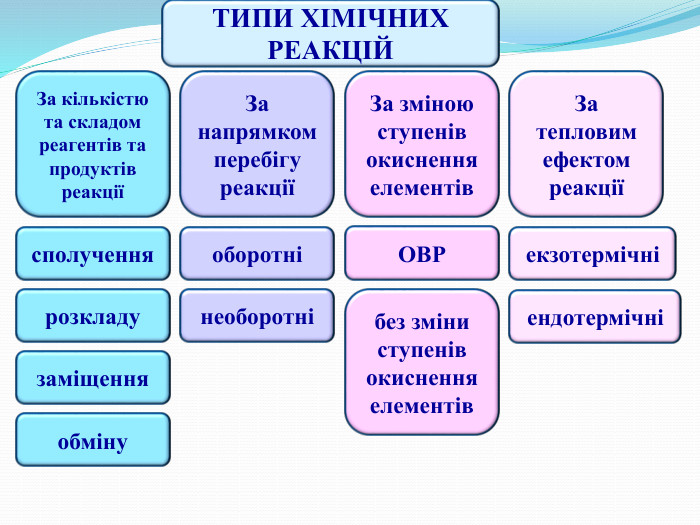

























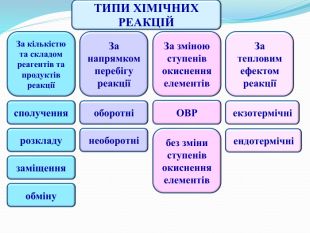
ТИПИ ХІМІЧНИХ РЕАКЦІЙЗа кількістю та складом реагентів та продуктів реакціїсполученнязаміщенняобмінурозкладу. За тепловим ефектом реакціїЗа зміною ступенів окиснення елементів. За напрямком перебігу реакціїоборотнінеоборотніОВРбез зміни ступенів окиснення елементівекзотермічніендотермічні
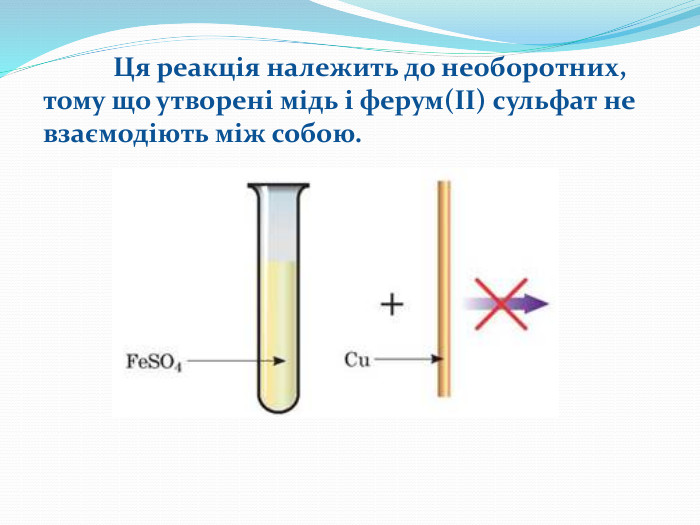
ОБОРОТНІ РЕАКЦІЇ Оборотні реакції — це реакції, що за одних і тих самих умов відбуваються одночасно у протилежних напрямках, тому реагенти однієї реакції є продуктами другої i навпаки. Більшість хімічних реакцій відбуваються не до кінця. Продукти, які утворилися в результаті реакції можуть взаємодіяти між собою. Такі реакції називаються оборотними.
Летка сполука Нітрогену з Гідрогеном амоніак NH3 утворюється з простих речовин азоту і водню за рівнянням реакції сполучення: N2 + 3 H2 → 2 NH3. Одночасно з цією реакцією відбувається реакція розкладу утвореного амоніаку на дві прості речовини — азот і водень:2 NH3 → N2 + 3 H2 Оборотність реакції позначають двома стрілками у протилежних напрямках:
З часом реагенти витрачаються, їх концентрація зменшується. Натомість збільшується маса і концентрація продуктів реакції. У певний момент хімічної взаємодії швидкості прямої й зворотної реакцій зрівнюються й надалі обидві реакції відбуваються з однаковою швидкістю. Такий стан оборотних реакцій називають станом хімічної рівноваги. У цьому стані реакція може перебувати тривалий час, якщо не вдаватись ні до якого впливу на неї. Хімічна рівновага
Стан системи, коли швидкість прямої і зворотної реакцій є однаковими, називають хімічною рівновагою. Стан рівноваги можна змістити, змінюючи концентрацію реагентів або утворених продуктів, тиск, температуру. Зміщення рівноваги буде відбуватися у бік зменшення цього впливу. Зверни увагу!А+В ↔ С+ДVпрямої р-ції = Vзворотної р-ціїХімічна рівновага
Хімічна рівновага — це стан системи, за якого швидкість прямої реакції (1) дорівнює швидкості зворотної реакції (2). За хімічної рівноваги концентрації речовин залишаються незмінними. Хімічна рівновага має динамічний характер: пряма і зворотна реакції за умови рівноваги не припиняються. Динамічний характер рівноваги. Хімічна рівновага
(Стан хімічної рівноваги кількісно характеризується константою рівноваги, що є відношенням констант прямої (К1) та зворотної (К2) реакцій. Для реакції m. A + n. B p. C + d. D константа рівноваги дорівнює: Константа рівноваги залежить від температури та природи реагентів. Чим більше значення константи рівноваги, тим більше рівновага зсунута в бік утворення продуктів прямої реакції.)Хімічна рівновага
Принцип Ле Шательє. Якщо на систему, що перебуває в стані рівноваги, чиниться зовнішній вплив (змінюються концентрація, температура, тиск), то це сприяє протіканню тієї із двох протилежних реакцій, що ослабляє цей вплив: Принцип Ле ШательєФранцузький учений Анрі-Луї Ле Шательє (08.10.1850-17.09.1936)у 1884 р. сформулював загальний принцип зміщення хімічної рівноваги:
1. Тиск. Збільшення тиску (для газів) зміщає рівновагу в бік реакції, що веде до зменшення об’єму (тобто до утворення меншого числа молекул газоподібних речовин). Збільшення P приводить до 1 > 2. Способи зсуву рівноваги. N2(г) + 3 H2(г) ↔ 2 NH3(г) 4 2 Р ↑→ Р ↓←Вплив зміни тиску на стан хімічної рівноваги
Збільшення t° приводить до 2 > 1. Збільшення t° приводить до 1 > 2.2. Температура. Підвищення температури зміщає рівновагу в бік ендотермічної реакції (тобто в бік реакції, що протікає з поглинанням теплоти).2 NO2 ⇄ N2 O4 +58 к. Дж/моль. N2 + O2 ⇄ 2 NO – Q (∆H > 0)Вплив зміни температури середовища на стан хімічної рівноваги
Завдання 4 Покажіть, у який бік зміститься в системі рівновага внаслідок зміни зовнішніх умов:1) підвищення температури:2) підвищення температури та збільшення концентрації речовин, що вступили в реакцію:3) зменшення тиску: Поясніть, як агрегатний стан речовини може вплинути на зсув рівноваги оборотної реакції.
Більшість промислово важливих хімічних реакцій є оборотними. Це означає, що не всі реагенти перетворюються на продукти реакції. Тому після взаємодії з рівноважної суміші необхідно видалити цільовий продукт реакції, а реагенти, що залишилися, повернути в реактор для подальшого перетворення. Трапляються випадки, коли за жорстких умов (і навіть за наявності каталізаторів) ступінь перетворення реагентів на продукти дуже малий (10% і менше). У такому разі технолог підприємства має вирішити технологічну проблему:обрати такі умови реакції, щоб максимально змістити рівновагу в бік продуктів реакції; для зменшення собівартості продукції обрати умови якомога менш жорсткі: нижчу температуру й тиск, зменшити витрати дорогих реагентів і каталізаторів. Використання знань про зміщення хімічної рівноваги для розв'язання технологічних проблем
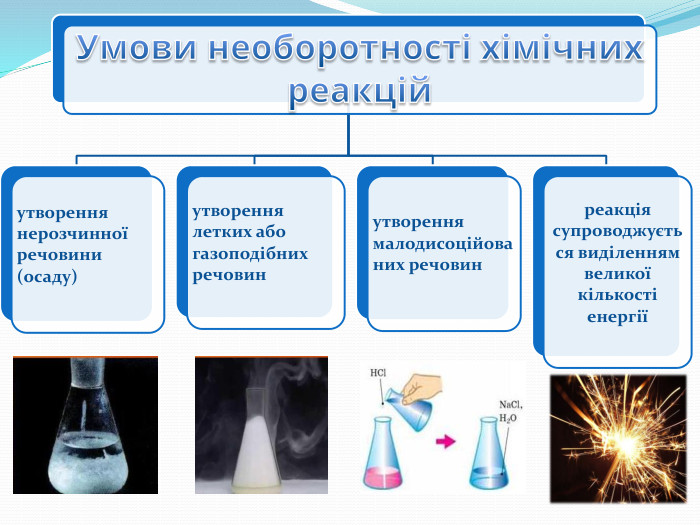
Підсумки За напрямом перебігу реакції поділяють на оборотні й необоротні. Необоротні реакції - реакції, що відбуваються в одному напрямку і закінчуються повним перетворенням реагентів на продукти реакції. Оборотні реакції — це реакції, що за одних і тих самих умов відбуваються одночасно у протилежних напрямках, тому реагенти однієї реакції є продуктами другої i навпаки. Стан системи, коли швидкість прямої і зворотної реакцій є однаковими, називають хімічною рівновагою. На стан рівноваги впливають: тиск(для газів), температура, концентрація реагентів та продуктів реакції..


про публікацію авторської розробки
Додати розробку