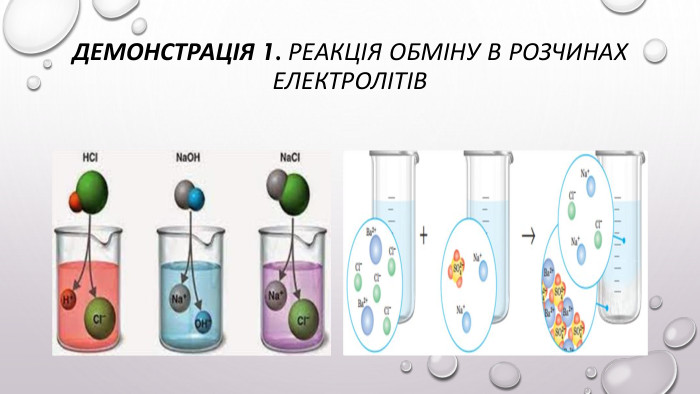
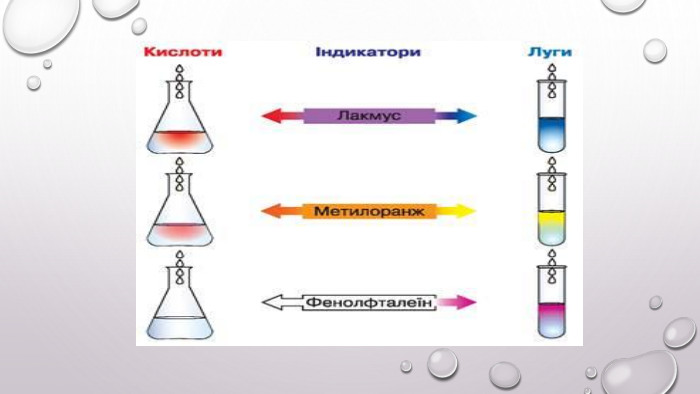
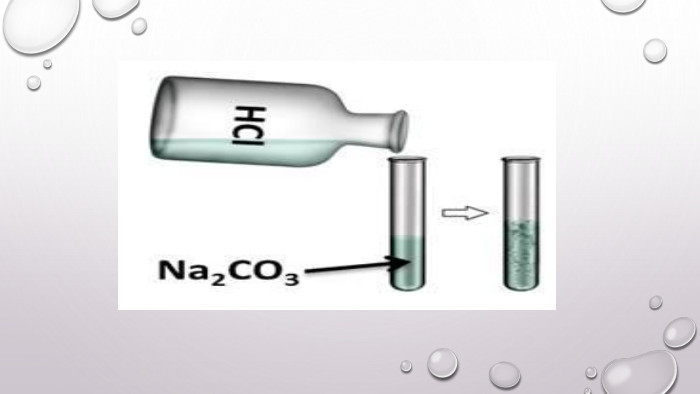
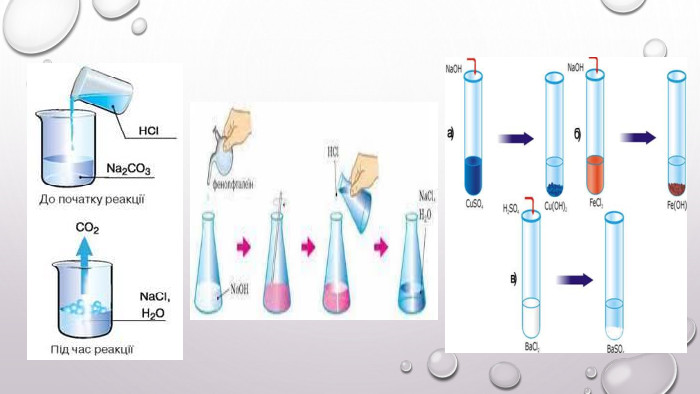
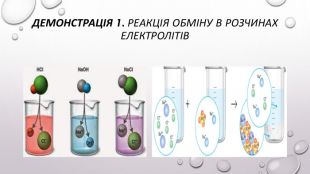
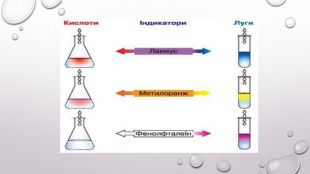
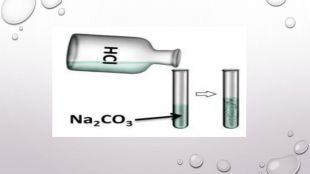
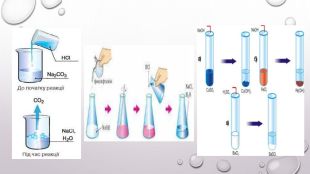
Реакції обміну між розчинами електролітів, умови їх перебігу. Йонні рівняння
Про матеріал
Матеріал та завдання на тему : "Реакції обміну між розчинами електролітів, умови їх перебігу. Йонні рівняння" В презентації опис трьох дослідів реакцій обміну між розчинами електролітів , описано умови перебігу даних реакцій які підтверджуються рівняннями реакцій та картинками виконаних дослідів. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку