"Електролітична дисоціація. Електроліти та неелектроліти"
Клас 9 (програма – ЗПР).
«Електролітична дисоціація. Електроліти та неелектроліти»
Освітньо – виховні завдання теми: створити комфортні умови для навчання, за яких кожен учень відчуває свою успішність, інтелектуальну спроможність, самостійність.
Навчальна мета: сформувати знання учнів про електроліти, неелектроліти, явище електролітичної дисоціації.
Розвиваюча мета: сформувати уявлення про єдину картину світу через єдність предметів природничого циклу.
Обладнання: підручники, комп’ютер, медіапроектор, інтерактивна дошка, мультимедійна презентація до уроку, таблиця розчинності,
МЕТОДИ, ФОРМИ І ПРИЙОМИ НАВЧАННЯ
|
МЕТОД |
ФОРМА |
ПРИЙОМИ |
|
проблемно- пошуковий |
пошукова діяльність учнів(постановка проблемного питання, розв’язання проблеми і проблемних завдань) |
постанова взаємозв’язаних проблемних запитань, здобуття нових знань у процесі проблемного викладу знань, активізація уваги та мислення, різноманітна самостійна робота учнів |
Тип уроку: засвоєння нових знань.
Форма уроку: бінарний (фізика і хімія).
Хід уроку:
І. Організаційна частина
Епіграф: «Щоб пізнати що-небудь слід відповісти на чотири питання:
« Чи є це? »,
« Що це? »,
« Яке це? »,
« Чому це? »
Слова арабського філософа ІХ ст. Ісхака аль-Кінді
ІІ. Актуалізація опорних знань та мотивація навчальної діяльності
Бесіда.
- Чим є електричний струм?
- Які заряджені частинки вам відомі?
- Які речовини проводять електричний струм?
- У яких речовинах існують йони?
На межі XVIII I XIX століть, коли для дослідження властивостей речовин почали застосовувати електричний струм, звернули увагу на те, що одні речовини, перебуваючи у водному розчині, проводять електричний струм, а інші його не проводять. Тому сьогоднішня тема допоможе нам у цьому розібратись.
- Наведіть відомі вам провідники електричного струму. (Метали, сплави металів, водопровідна вода, розчин солі.)
- Які необхідні умови існування електричного струму в середовищі? (Наявність джерела струму і вільних носіїв електричного заряду.)
ІІІ. Вивчення нового матеріалу.
Дослідження речовин на електропровідність (ППЗ «Хімія, 9 клас» або https://www.youtube.com/watch?v=vgkuWqHmG68)
Перевіремо на електропровідність дистильовану воду і водопровідну. Занурюємо електроди у склянку з дистильованою водою – лампочка не горить, занурюємо у склянку з водопровідною - лампочка горить. Чому? (Водопровідна вода містить розчинені солі.)
З'ясуємо електропровідність сухої кухонної солі і її розчину. Сухі електроди помістимо в сухий натрій хлорид – лампочка не світить, зануримо електроди у розчин солі – лампочка засвітиться. Чому?
(В процесі розчинення утворились носії електричного заряду.)
Чи всі речовини здатна так змінювати воду? Проведемо аналогічні дослідження з цукром, хлоридною кислотою, натрій гідроксидом. Результати досліджень записуємо у таблицю.
|
Назва речовини |
Електропровідність |
Тип хімічного зв’язку |
|
|
|
сухої чистої речовини |
її розчину |
|
|
Вода (дистильована) |
- |
- |
Ковалентний полярний |
|
Натрій хлорид |
- |
+ |
Йонний |
|
Сахароза
|
- |
- |
Ковалентний слабо полярний |
|
Натрій гідроксид |
- |
+ |
Йонний |
|
Хлоридна кислота |
- |
+ |
Ковалентний сильно полярний |
Учні роблять висновок, про те, що електричний струм проводять водні розчини речовин із йонним або ковалентним сильно полярним типом хімічного зв’язку.
Розповідь учителя
На дошці записується схема:
![]()
![]() Речовини
Речовини
Електроліти Неелектроліти
Електроліти – речовини, розчини або розплави яких проводять електричний струм. (Кислоти, солі, основи.)
Неелектроліти - речовини, розчини або розплави яких не проводять електричний струм. (Цукор, жир, крохмаль, спирт, ацетон.)
Щоб зрозуміти причину електропровідності речовин після розчинення у воді необхідно пригадати особливості будови молекули води. (Диполь, з ковалентним полярним зв'язком.)
Дослідження процесу електролітичної дисоціації (https://www.youtube.com/watch?v=EjScUis24Xc)
Демонстрація процесу електролітичної дисоціації кухонної солі, речовини з йонним типом зв'язку.
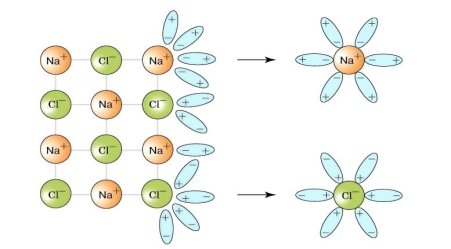
NaCl↔Na+ + Cl-
Демонстрація процесу електролітичної дисоціації хлоридної кислоти, речовини з ковалентним полярним типом зв'язку.
HCl↔ Н+ + Cl-
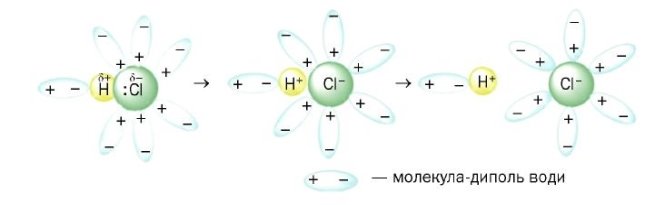
Учні за допомогою вчителя формулюють визначення:
Електролітична дисоціація у водних розчинах – це процес розпаду електроліту на йони під впливом полярних молекул води.
Розповідь учителя
Основні положення теорії електролітичної дисоціації сформулював шведський учений Сванте Август Арреніус у 1887 році, за що у 1901 році отримав Нобелівську премію з хімії.
Основні положення ТЕД:
- Електролітична дисоціація відбувається під впливом полярних молекул розчинника.
- Процес дисоціації є оборотним.
- При розчиненні у воді молекули електролітів дисоціюють на позитивно і негативно заряджені йони: катіони і аніони.
- Йони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода (негативно зарядженого електрода), а негативно заряджені іони у напрямку анода (позитивно зарядженого електрода).
IV. Підбиття підсумків уроку
1) Проаналізуйте зміст етикеток на пляшках різних мінеральних вод. Розподіліть зазначені на них йони у відповідні колонки таблиці:
|
Катіони |
Аніони |
|
|
|
2) Поясніть, чи зміниться електропровідність води, якщо крізь неї пропускати:
а) азот; б) сульфур(VІ) оксид; в) кисень; г) гідроген бромід.
3) У кристалізатор з водою пінцетом обережно помістили невеликий шматочок натрію. Після закінчення хімічної реакції у добутий розчин занурили електроди приладу для вимірювання електропровідності. Опишіть перебіг реакції та запишіть її хімічне рівняння. Чи проводитиме розчин одного з її продуктів (якого саме?) електричний струм? Поясніть чому.
4) Із перерахованих речовин назвіть неелектроліти: водний розчин ферум(III) хлориду; водний розчин цукру; рідкий амоніак; вапнякова вода; дистильована вода; морська вода.
IV. Домашнє завдання.
Наведіть приклади речовин, які зустрічаються в трудовій діяльності ваших батьків, у домашньому господарстві, в природі, які проводять електричний струм.


про публікацію авторської розробки
Додати розробку
