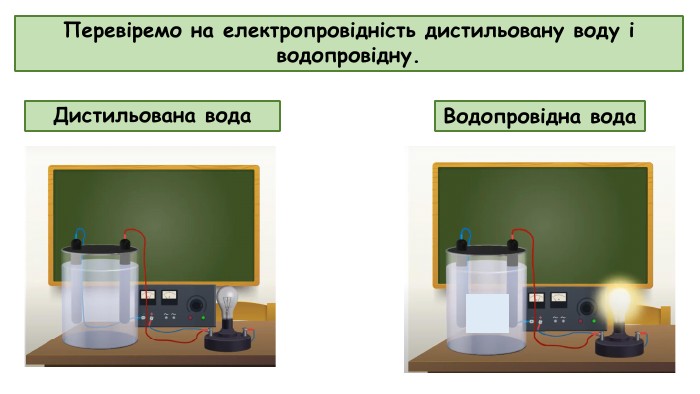
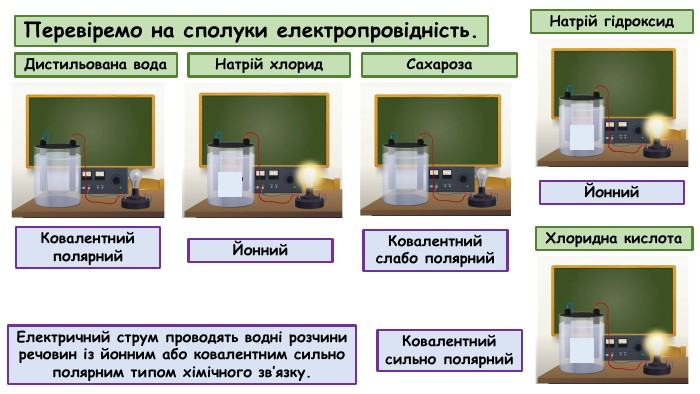
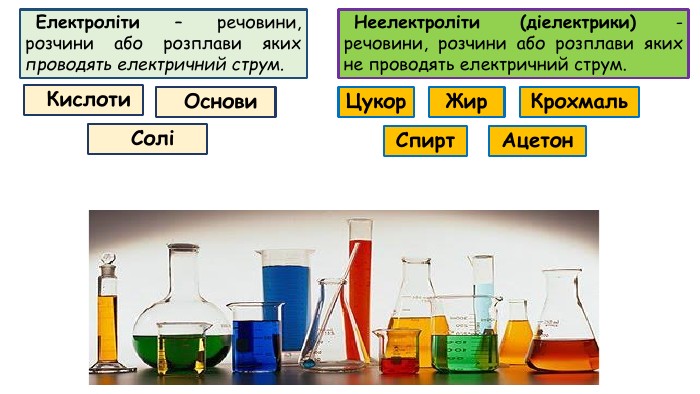
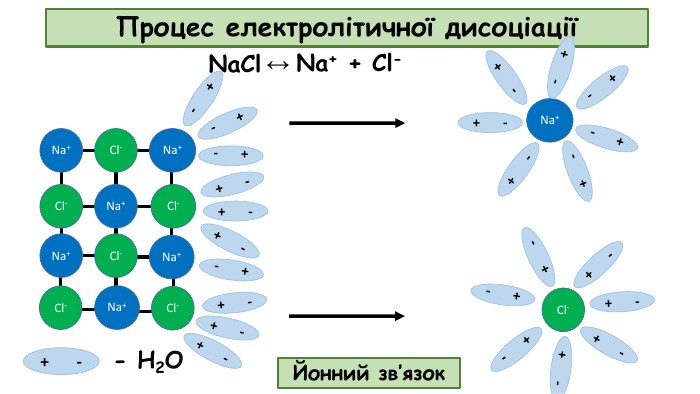
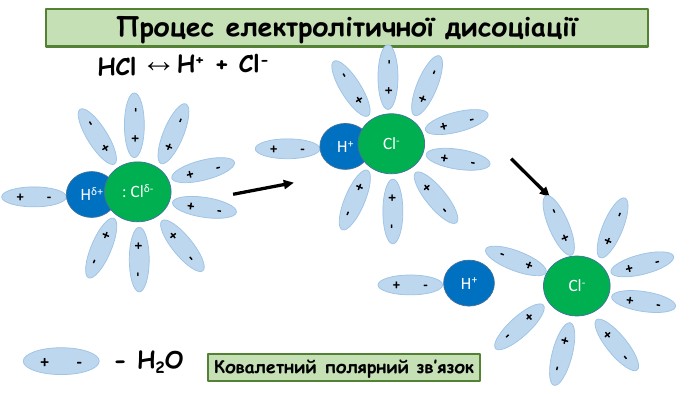
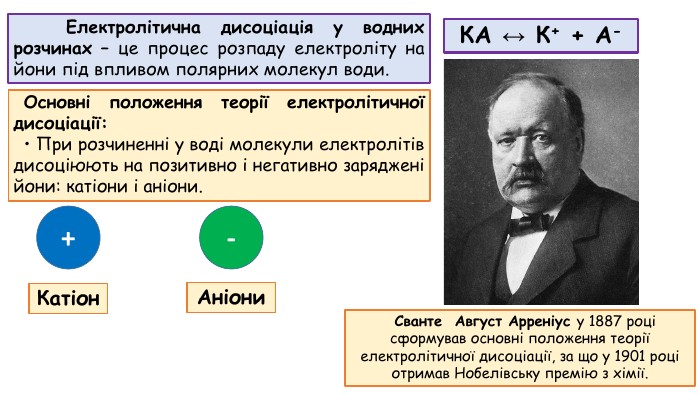
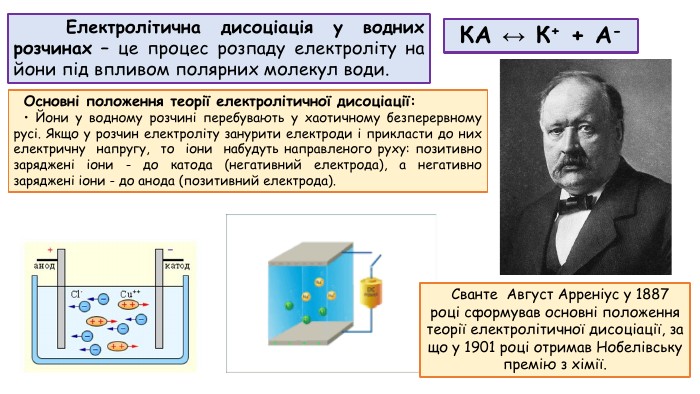
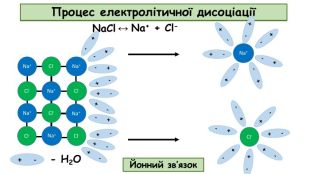
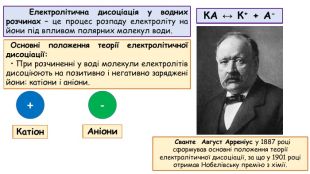
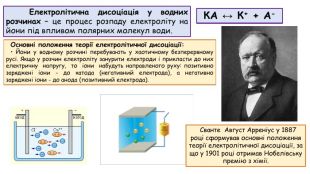
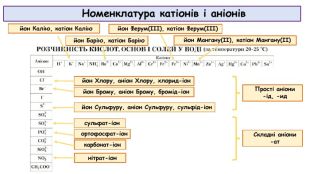
Електролітична дисоціація. Електроліти й неелектроліти.
Про матеріал
Презентація до відео-уроку "Електролітична дисоціація. Електроліти й неелектроліти."
Посилання на відео-урок: https://www.youtube.com/watch?v=0Ge974BsOMg Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Березан О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку