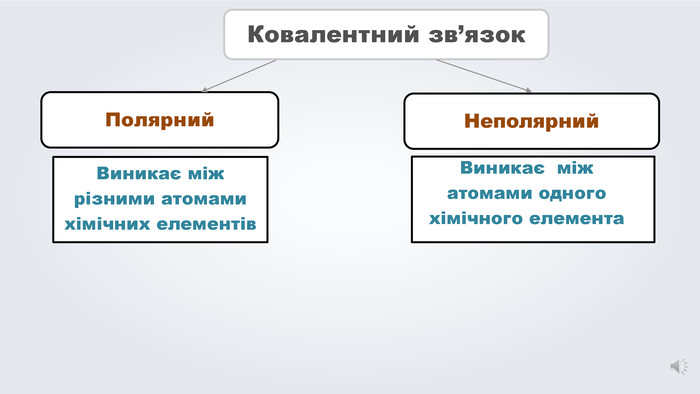
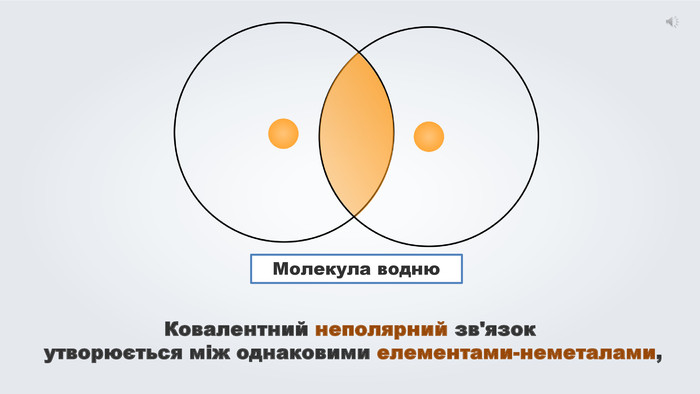
Електронегативність елементів. Ковалентний зв'язок, його утворення. Полярний ковалентний зв'язок.
Про матеріал
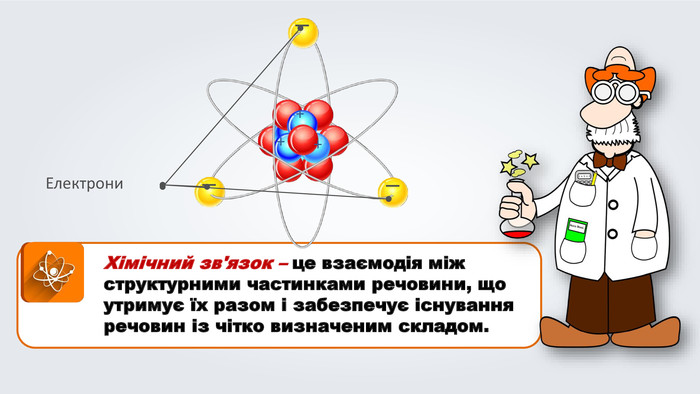
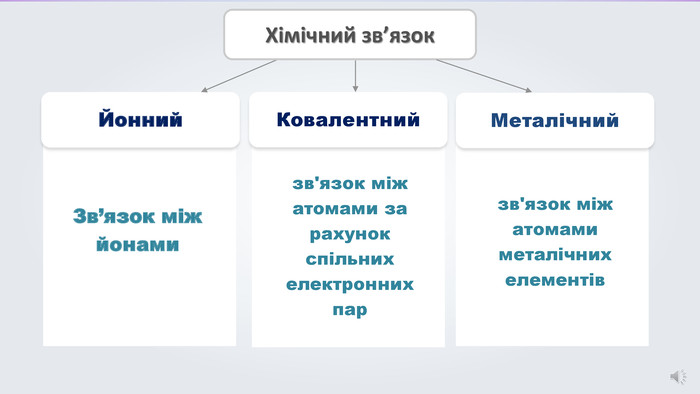
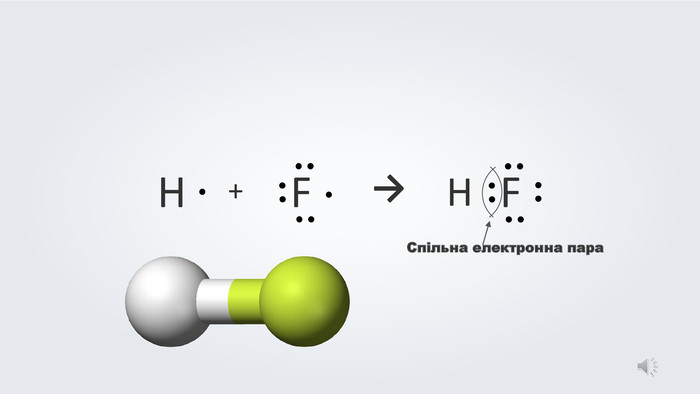
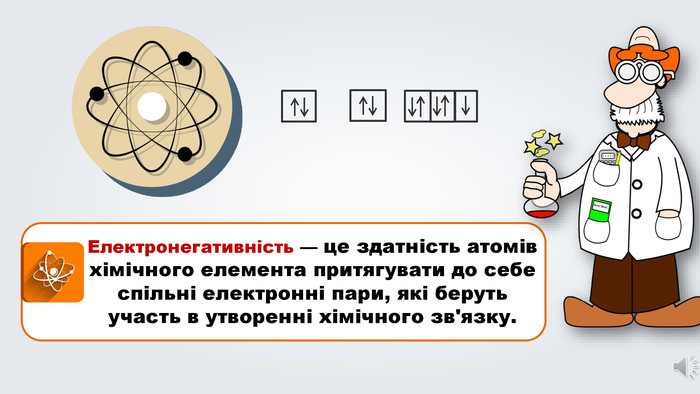
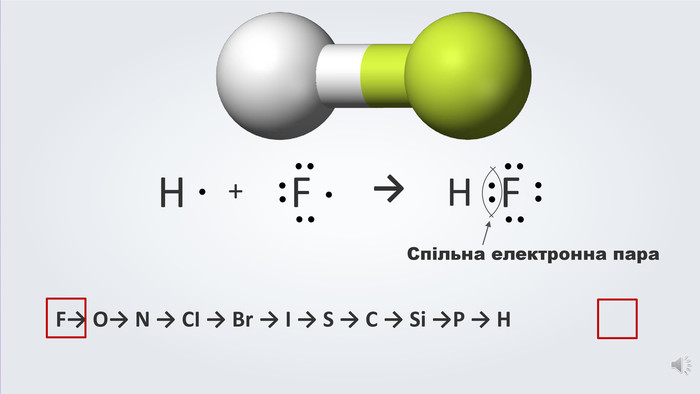
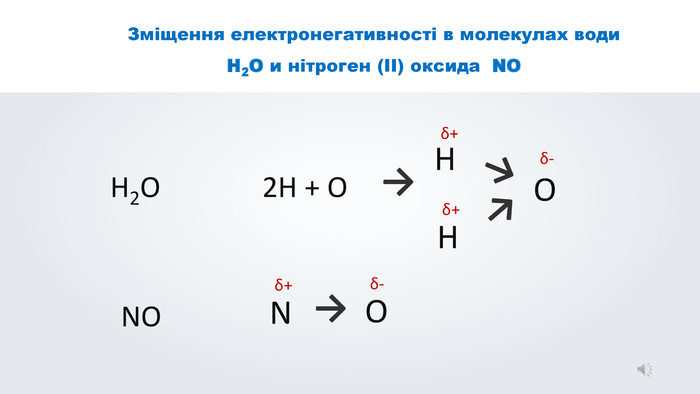
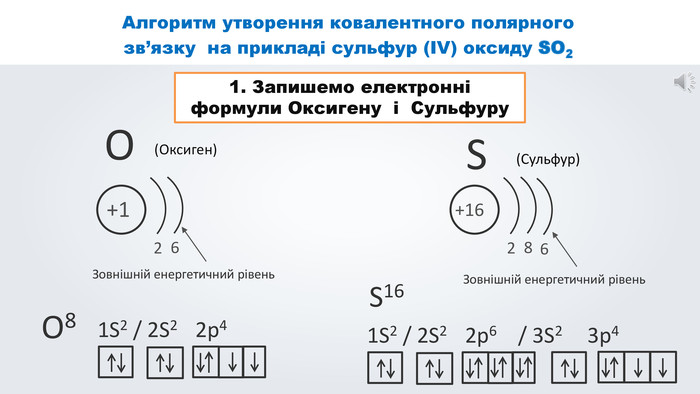
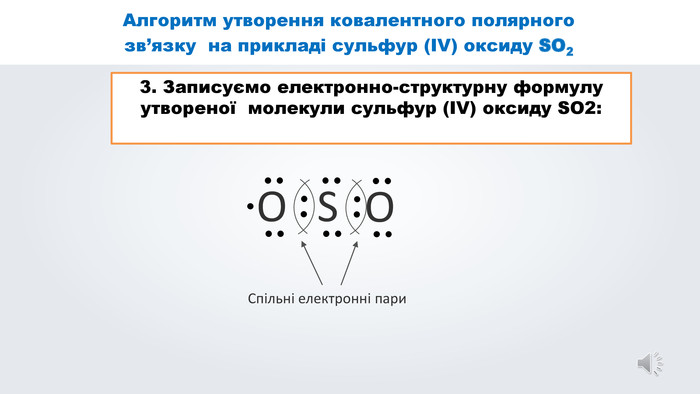
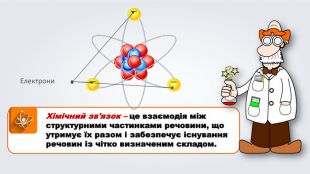
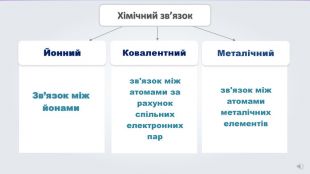
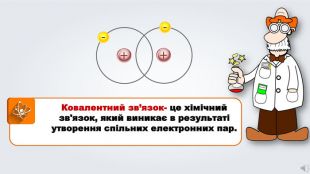
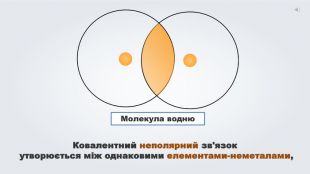
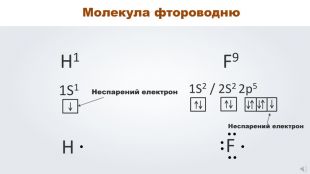
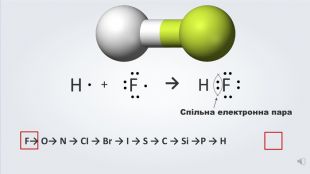
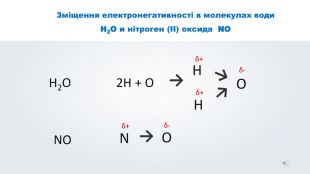
Даний урок формує уявлення про природу хімічного зв'язку, електронегативність, ковалентний зв'язок та механізми його утворення, вчить складати електронні формули молекул.
Відео до уроку можна переглянути за посиланням:
https://www.youtube.com/watch?v=5-dXmsrzHBI&t=202s&ab_channel=%D0%A0%D1%83%D1%81%D0%BB%D0%B0%D0%BD%D0%B0%D0%91%D0%B0%D1%80%D0%BA%D0%BE Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку