Елементи VIA групи та їх сполуки
Про матеріал
Дана презентація містить матеріал, який можна використати під час вивчення теми «Елементи VIA групи (халькогени)» у 11 класі відповідно календарно-тематичного планування укладеного згідно Навчальної програми для закладів загальної середньої освіти «Хімія 10-11класи Профільний рівень» (наказ № 1407 від 23.10.2017 року) Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Велике дякую
-
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


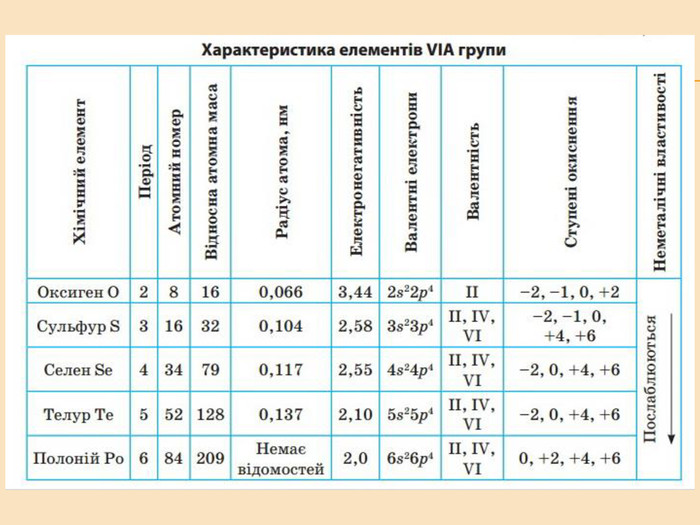
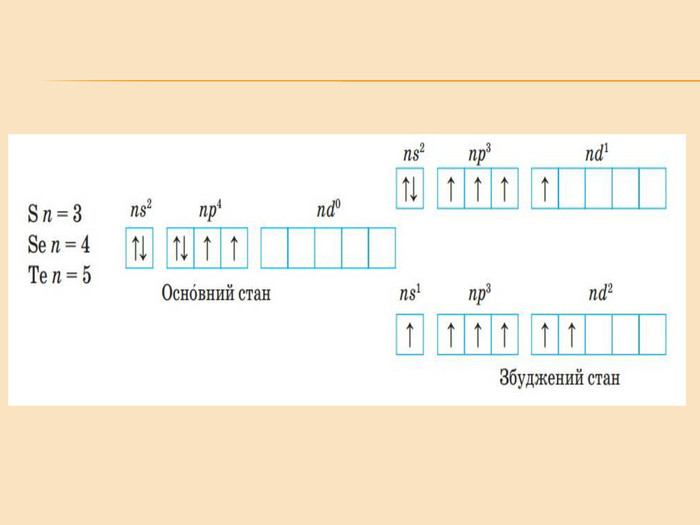
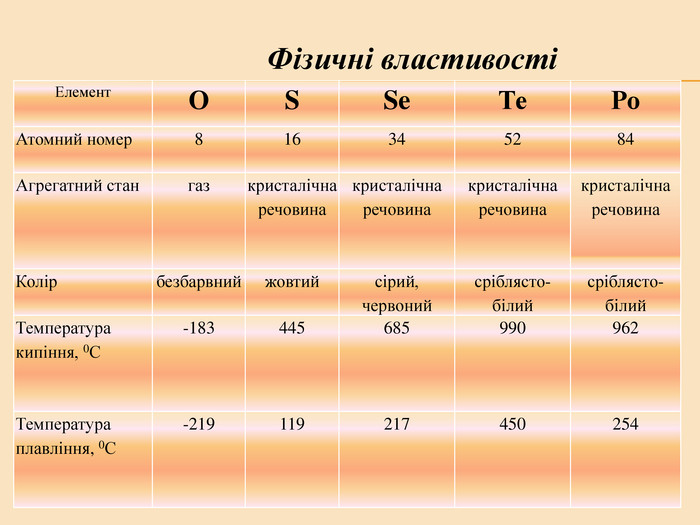
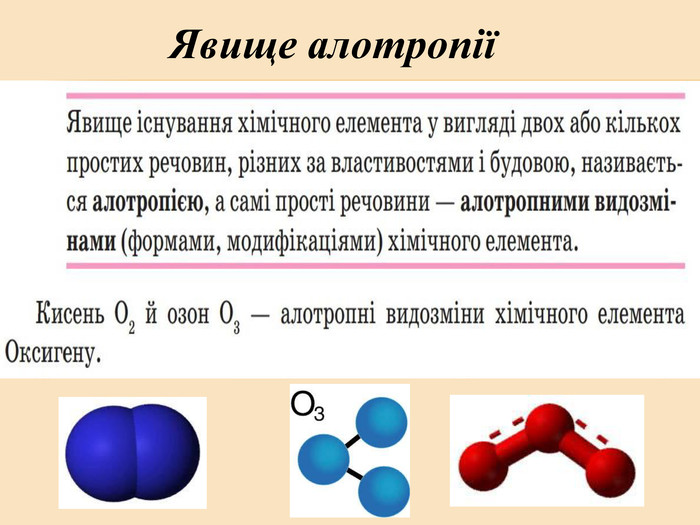
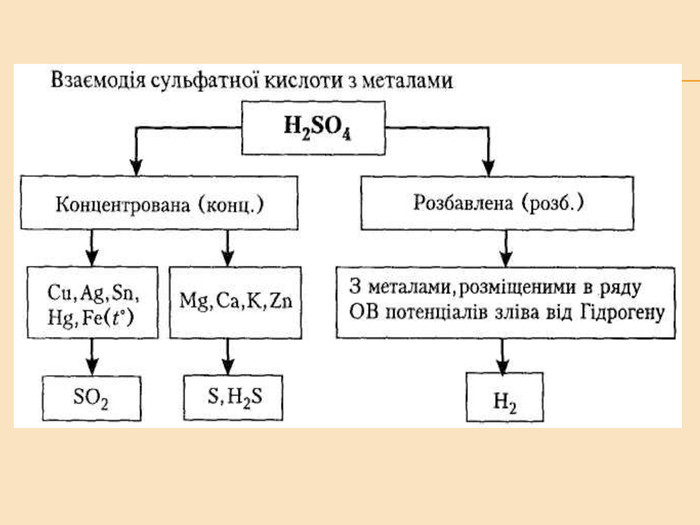
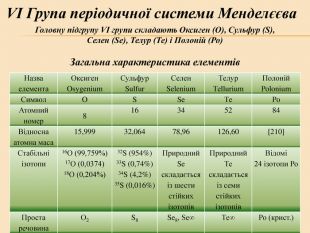
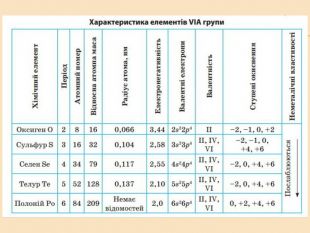
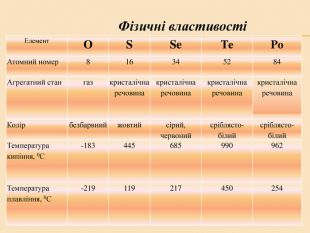
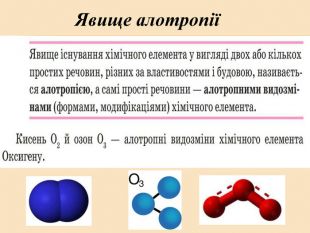
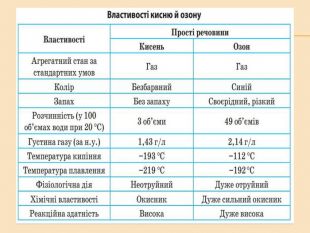
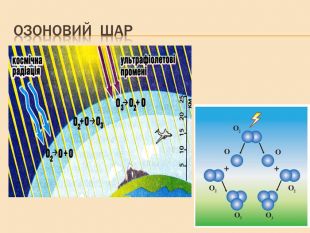
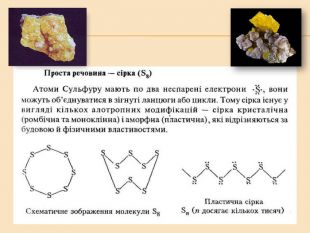
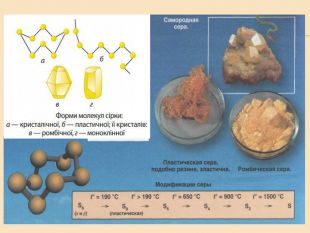
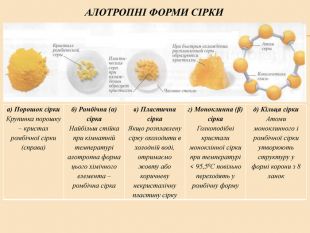
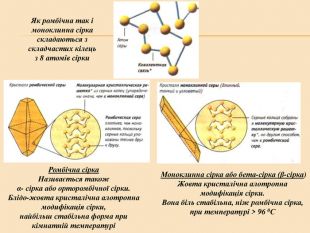
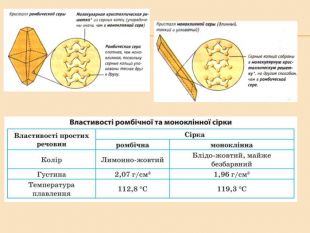
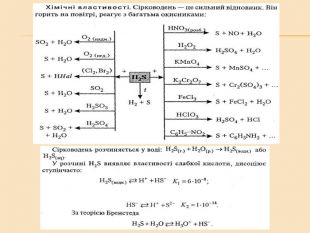
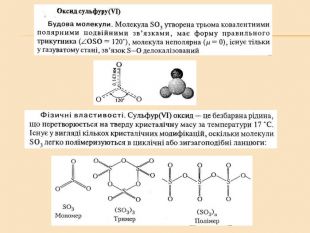
![Головну підгрупу VI групи складають Оксиген (О), Сульфур (S), Селен (Se), Телур (Те) і Полоній (Ро) Загальна характеристика елементів VІ Група періодичної системи Менделєєва Назва елемента Оксиген Osygenium Сульфур Sulfur Селен Selenium Телур Теllurium Полоній Роlonium Символ O S Se Те Ро Атомний номер 8 16 34 52 84 Відносна атомна маса 15,999 32,064 78,96 126,60 [210] Стабільні ізотопи 16О (99,759%) 17О (0,0374) 18О (0,204%) 32S (954%)
33S (0,74%)
34S (4,2%)
35S (0,016%) Природний Se складається із шести стійких ізотопів Природний Те складається із семи стійких ізотопів Відомі 24 ізотопи Ро Проста речовина О2 S8 Se8, Se∞ Те∞ Ро (крист.) Головну підгрупу VI групи складають Оксиген (О), Сульфур (S), Селен (Se), Телур (Те) і Полоній (Ро) Загальна характеристика елементів VІ Група періодичної системи Менделєєва Назва елемента Оксиген Osygenium Сульфур Sulfur Селен Selenium Телур Теllurium Полоній Роlonium Символ O S Se Те Ро Атомний номер 8 16 34 52 84 Відносна атомна маса 15,999 32,064 78,96 126,60 [210] Стабільні ізотопи 16О (99,759%) 17О (0,0374) 18О (0,204%) 32S (954%)
33S (0,74%)
34S (4,2%)
35S (0,016%) Природний Se складається із шести стійких ізотопів Природний Те складається із семи стійких ізотопів Відомі 24 ізотопи Ро Проста речовина О2 S8 Se8, Se∞ Те∞ Ро (крист.)](/uploads/files/348559/224252/240073_images/2.jpg)