Етилен та ацетилен-ненасичені вуглеводні


































































М е т а Ознайомитися із основними фізико-хімічними властивостями, будовою та застосуванням етилену і ацетилену; Навчитися складати рівняння реакцій, що характеризують хімічні властивості ненасичених вуглеводнів; Навчитися встановлювати причинно-наслідкові зв’язки між будовою і властивостями
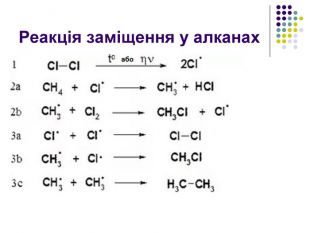
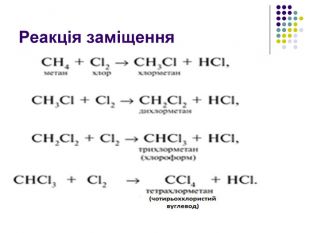
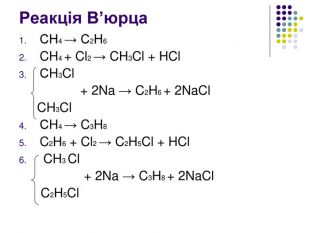
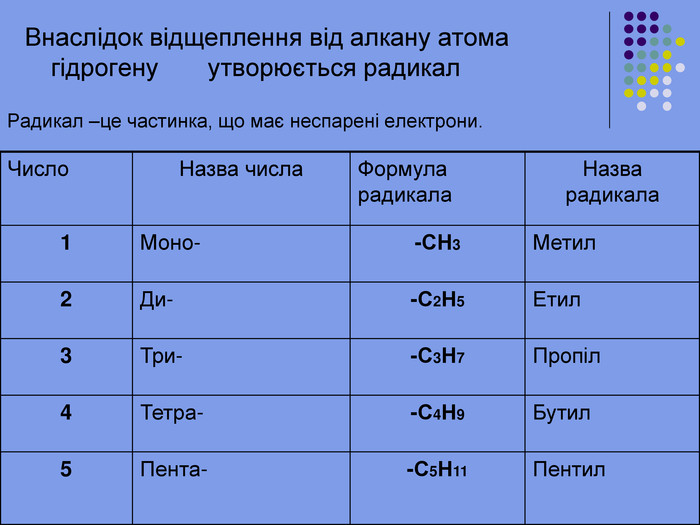
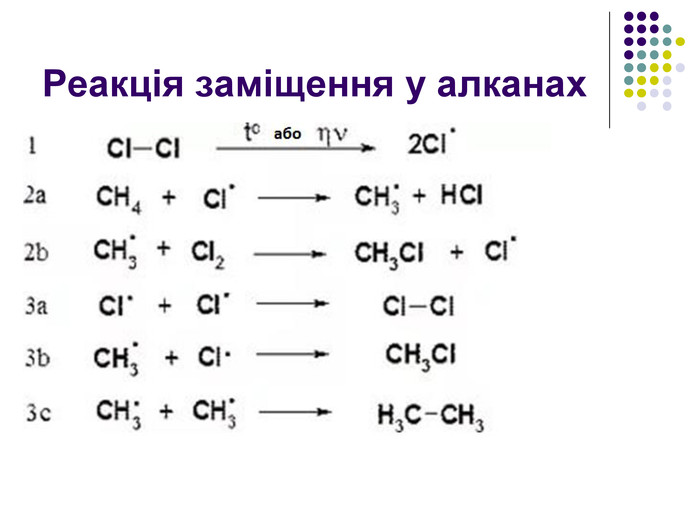
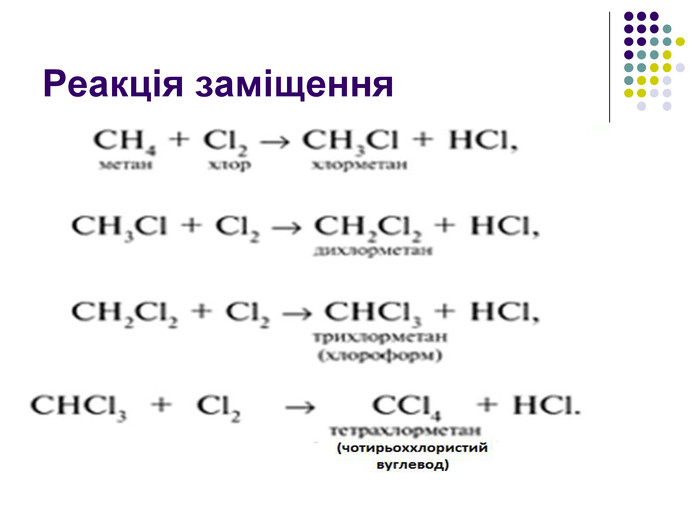
Реакція заміщення Хлорування. Хлор реагує з алканами при нагріванні до 250–400 °С, під дією ультрафіолетового випромінювання або наявності каталізаторів ( пероксиди, йод, хлориди купруму, алюмінію). Хлорування алканів при нагріванні, УФ-випромінюванні проходить за радикальним механізмом SR і складається з трьох основних стадій: 1) зародження ланцюга (ініціювання) Cl2 → Cl2• → 2Cl• 2) зростання ланцюга H3C–H + Cl• → HCl + •CH3 •CH3 + Cl–Cl → H3C•Cl + Cl•
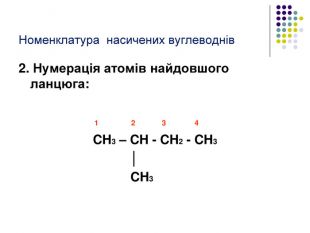
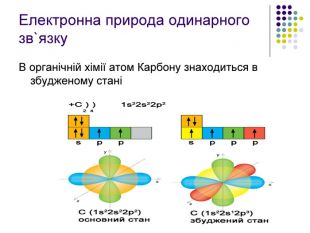
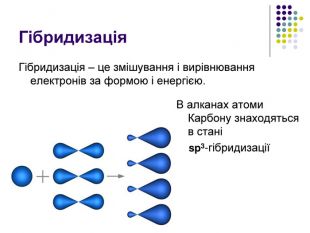
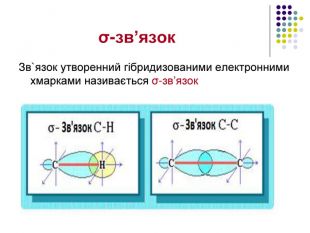
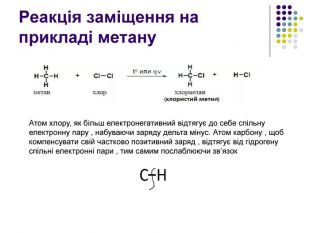
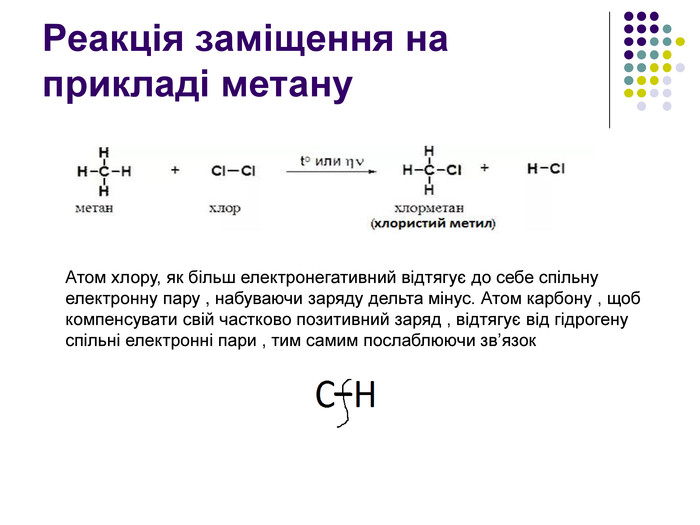
Реакція заміщення на прикладі метану Атом хлору, як більш електронегативний відтягує до себе спільну електронну пару , набуваючи заряду дельта мінус. Атом карбону , щоб компенсувати свій частково позитивний заряд , відтягує від гідрогену спільні електронні пари , тим самим послаблюючи зв’язок
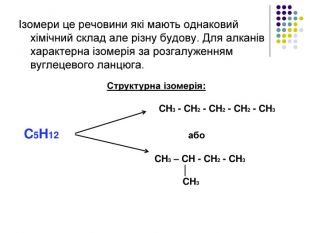
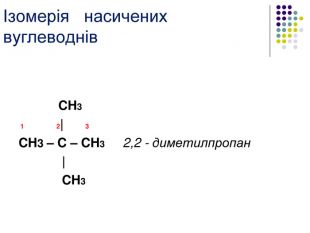
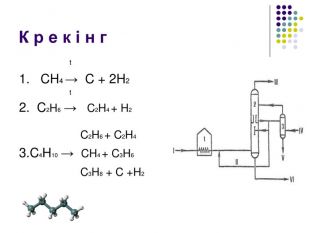
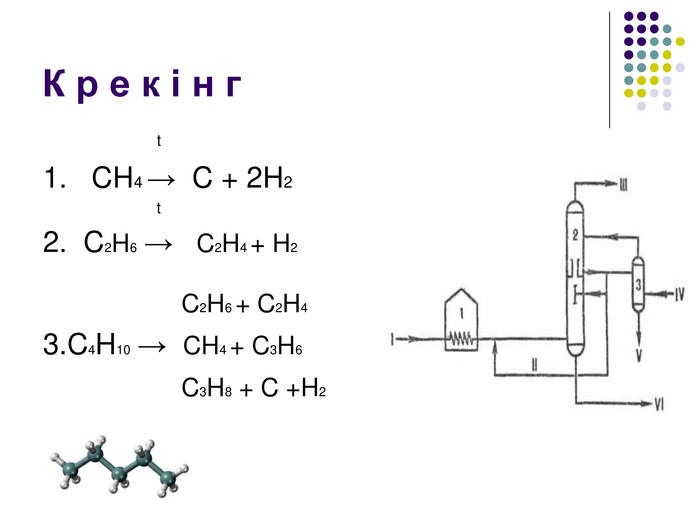
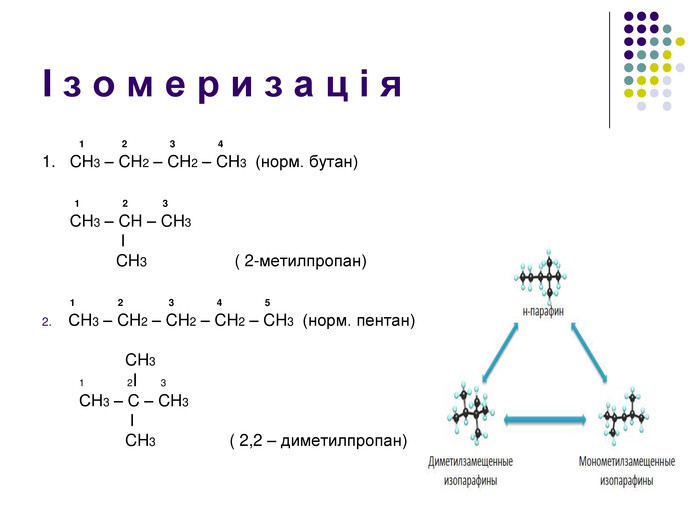
К р е к і н г – термічний розклад Крекінг - розщеплення молекул органічних сполук з розривом зв'язків вуглець - вуглець під дією високих температур. Під час крекінгу алканів утворюються алкани з меншим числом атомів вуглецю і ненасичені сполуки. Ці реакції мають велике промислове значення. Таким чином із нафти отримують бензин, гас та інші цінні продукти. Висновки: алкани – інертні органічні сполуки, не вступають в реакції приєднання, для них характерні реакції заміщення. Чому ми можемо спрогнозувати такі властивості у всіх алканів? Тому, що вони є гомологами. Саме хімічною стійкістю насичених вуглеводнів (алканів), їх інертністю, пояснюється їхня інша назва Парафіни ( від лат.parum– мало, affinis – причетний.)
Г о р і н н я Горі́ння — екзотермічна реакція окиснення речовин, яка супроводжується виділенням диму та (або) виникненням полум'я і (або) світінням. Горіння за сучасними уявленнями — складний фізико-хімічний процес на основі екзотермічних реакцій окиснення-відновлення, який характеризується значною швидкістю перебігу, виділенням великої кількості тепла і світла. Горіння виникає, коли є горюча речовина, окислювач та джерело запалювання. Горіння може бути повним і неповним. Повне — за достатньої або надлишкової кількості окислювача і за такого горіння виділяються нетоксичні речовини. Неповне — відбувається за недостатньої кількості окислювача. За неповного горіння утворюються продукти неповного згорання, серед яких є токсичні речовини (чадний газ, водень).
Значення алканів в сучасному світі величезна. У нафтохімічній промисловості є базою для отримання різноманітних органічних сполук, важливою сировиною в процесах отримання напівпродуктів для виробництва пластмас, каучуку, синтетичних волокон, миючих засобів і багатьох інших речовин. Велике значення в медицині, парфумерії та косметиці.Алкани широко застосовують в органічному синтезі.
Парафін – ще один всім відомий продукт, який представляє собою суміш твердих алканів. Це тверда біла маса, температура плавлення якої становить 50 – 70 градусів. У сучасному виробництві парафін використовується для виготовлення свічок. Цією ж речовиною просочують сірники. У медицині за допомогою парафіну проводять різного роду теплові процедури.
Ще одне джерело алканів – нафта , значення якої для сучасного людства переоцінити важко. До нафтових продуктів відносять: бензин – використовуються в якості палива; гас; дизельне паливо, або легкий газойль; важкий газойль, який застосовують в якості мастильної олії; залишки нафтової перегонки використовують для виготовлення асфальту.
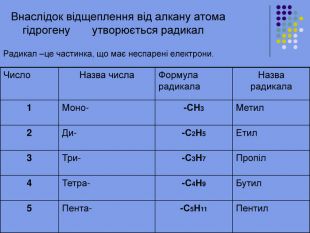
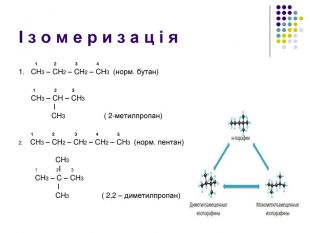
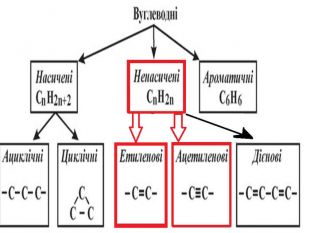
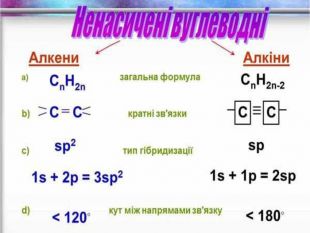
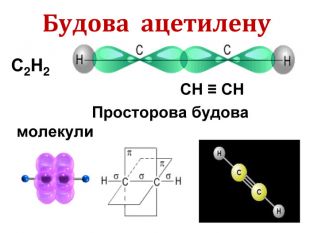
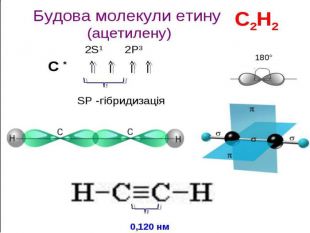
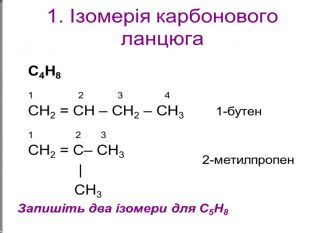
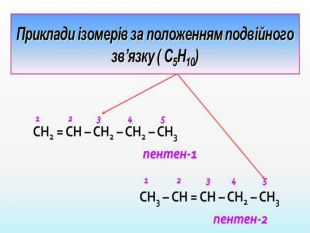
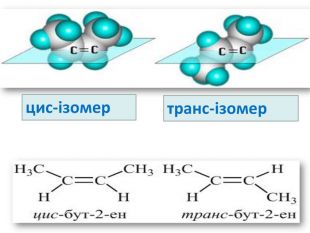
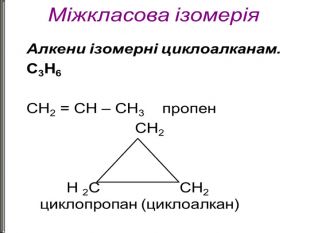
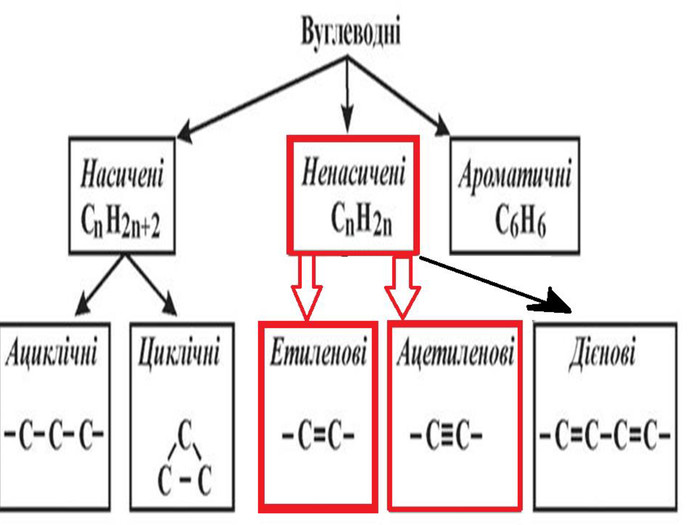
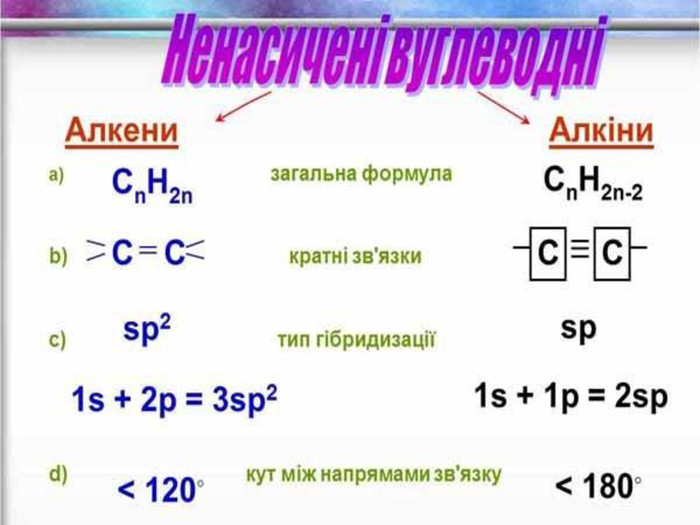
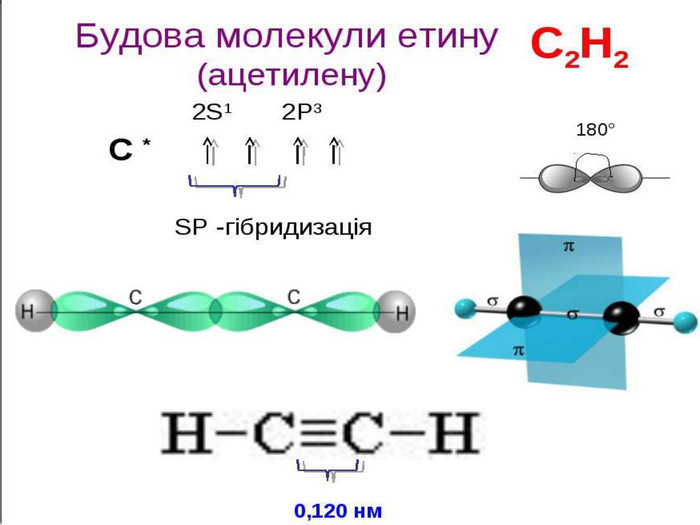
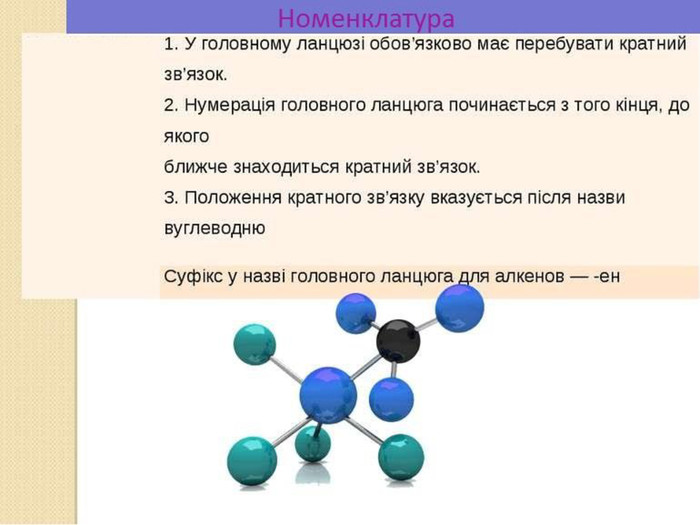
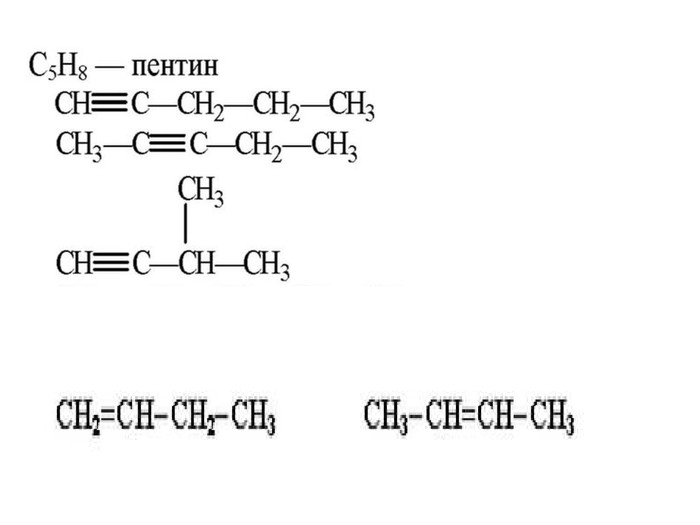
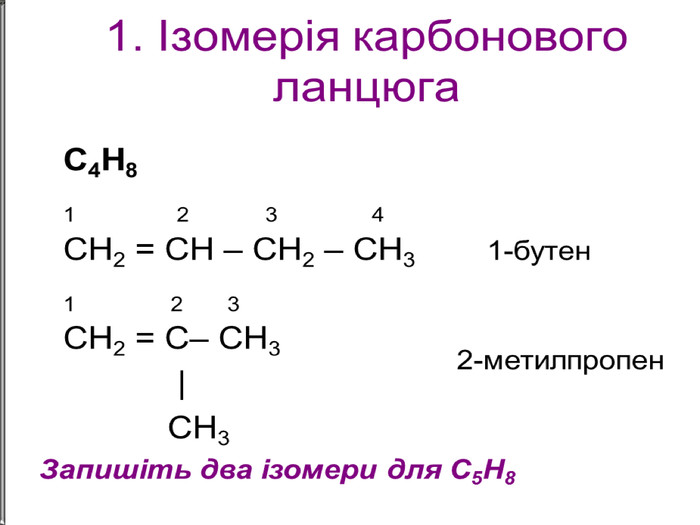
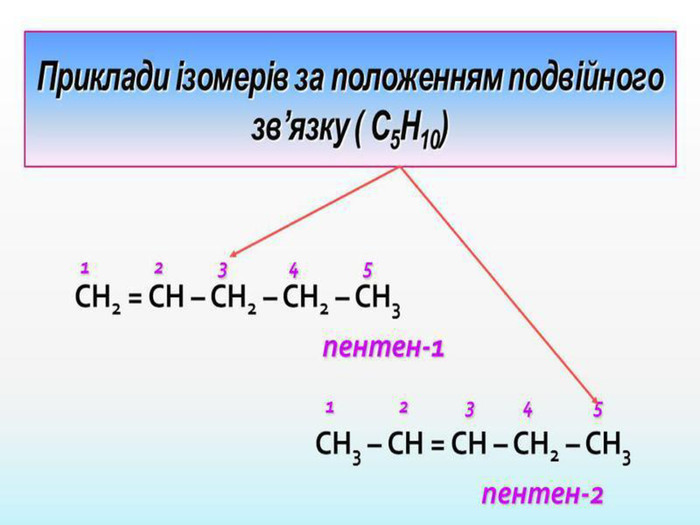
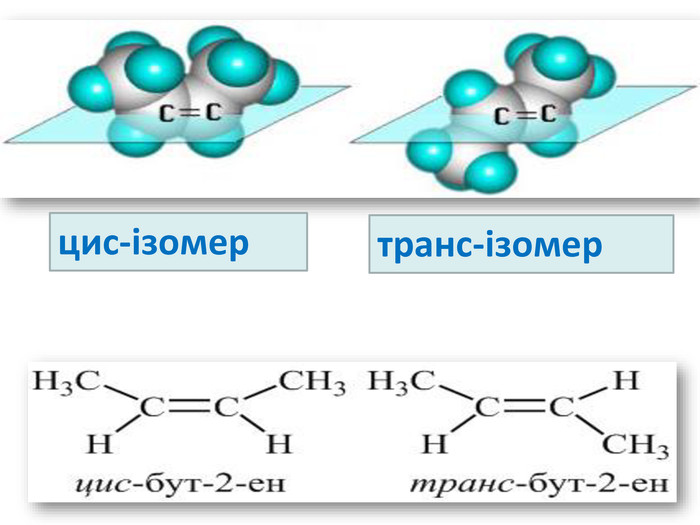
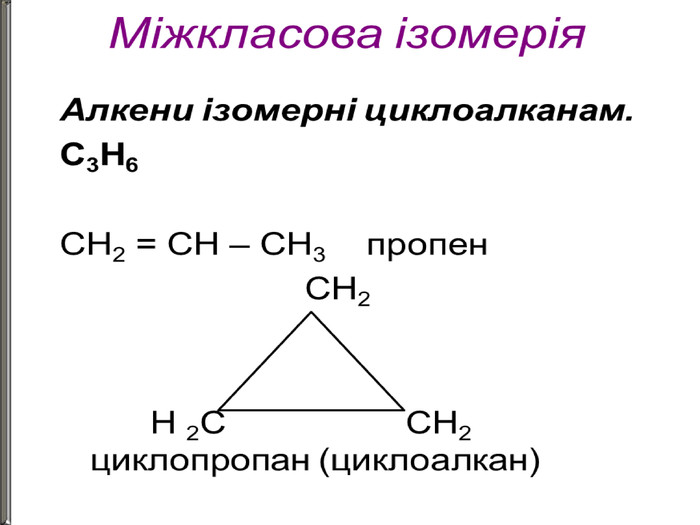
Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С = С – або потрійні – С Ξ С – ) Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв’язок між атомами Карбону. Загальна формула - СnH2n-2 С2Н2 - етин (ацетилен) С3Н4 - пропін С4Н6 - бутин Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв’язок між атомами Карбону. Загальна формула СnH2n С2Н4 - етен (етилен) С3Н6 - пропен С4Н8 - бутен
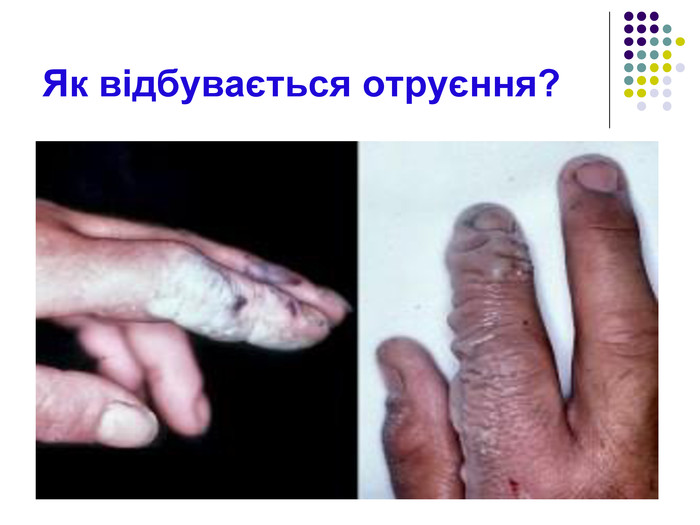
Як відбувається отруєння? При інтенсивному використанні, ситуації, коли можливе отруєння кислотою, трапляються нерідко. Сірчана кислота – надзвичайно небезпечна речовина, що вимагає уважного і обережного поводження Отруєння кислотою відбувається при контакті з нею і в рідкому стані, і у вигляді парів. Однаково сильно і досить важко переноситься отруєння в обох випадках.
Симптоми отруєння Отруєння сірчаною кислотою приводить до такого важкого стану, а симптоми так очевидні, що їх складно переплутати з отруєнням чимось іншим. Отруєння парами Симптоми такого отруєння: Постраждалий отримує опіки очей різного ступеня тяжкості. Слизова органів дихання сильно травмується, в результаті виникають подразнення або опік. У важких випадках відкривається кровотеча з носа. Дихальна система уражається: виникають хрипи, сильні болі в горлі, можливий спазм. Небезпека для життя представляють саме спазм і подальший набряк легенів і гортані, які можуть становити реальну загрозу для життя потерпілого. Органи травлення також травмуються подразненнями і опіками.
Отруєння кислотою в рідкому вигляді Отруєння сірчаною кислотою в рідкому вигляді призводить до ще більш тяжких наслідків. Симптоми: Від концентрації кислоти залежить ступінь отриманих на шкірних покривах опіків і площа ураження всередині: При попаданні кислоти всередину: у всіх органах травної системи відразу ж виникає гостра біль, виникає блювота. Вона містить домішки крові і відрізняється багатством і темним кольором. Розвивається рясне слинотеча, що супроводжується сильним проносом. Сеча забарвлюється в червоний або темно-вишневий колір, що є свідченням сильного ураження нирок. Симптоми отруєння рідиною схожі з отруєнням парами – через деякий час розвивається набряк гортані, що дуже утруднює дихання. Шкірні покриви набувають синюшний відтінок. Починаються порушення в роботі серцево-судинної системи. Губи чорніють, на зубах виступають темно-бурі плями. Отруєння супроводжується сильним больовим шоком. Для смертельного результату цілком достатньо, щоб всередину потрапило всього 5 мг сірчаної кислоти.
При попаданні всередину При отруєнні сірчаною кислотою з-за її потрапляння всередину, потрібно терміново промити шлунок водою (обов’язково кімнатної температури), потім дати потерпілому випити півсклянки олії. Пити його потрібно маленькими ковтками. В цьому випадку також ефективний прийом збитих яєчних білків, вапняного молока, паленої магнезії. Прийом всередину молока кімнатної температури і ковтання льоду також допомагають полегшити стан. Рот прополіскують содовим розчином.
При попаданні в очі При попаданні сірчаної кислоти в очі, їх потрібно відразу ж рясно і ретельно промити водою, після цього очі закапують двопроцентним новокаїном, щоб зменшити біль. Застосовують також масла, вазелінове або персикове масло закладають за повіки, дотримуючись, по можливості, стерильність.
При попаданні на шкіру При опіку шкірних покривів, їх відразу ж необхідно промити в проточній воді, досить довго — протягом як мінімум 10 хвилин. Можна застосовувати мило або лужний розчин. На уражену ділянку шкіри відразу після промивання водою накладають пов’язку, змочену содовим розчином.
В медичних умовах постраждалу слизову знеболюють пов’язками з новокаїном для зменшення больових відчуттів. Новокаїн застосовують у вигляді внутрішньом’язових ін’єкцій. Для запобігання розвитку інфекції в уражених органах призначають курс антибактеріальної терапії. При шлункових кровотечах здійснюють переливання крові, вводять плазму
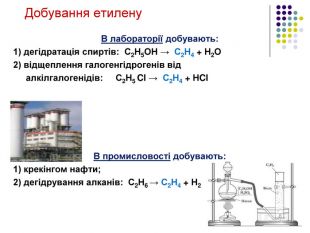
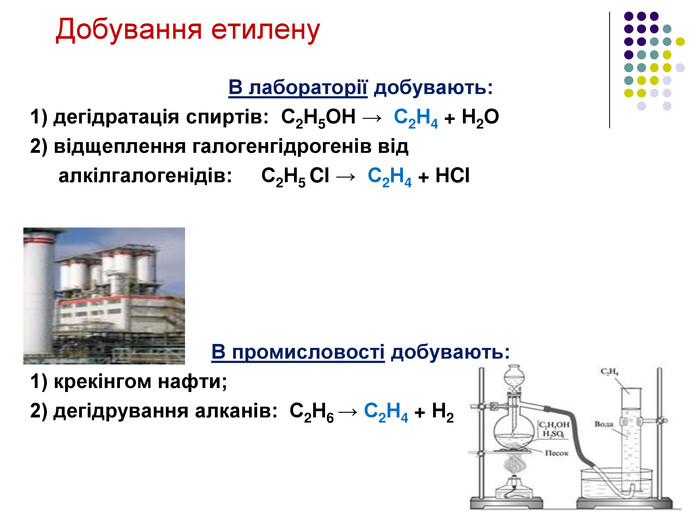
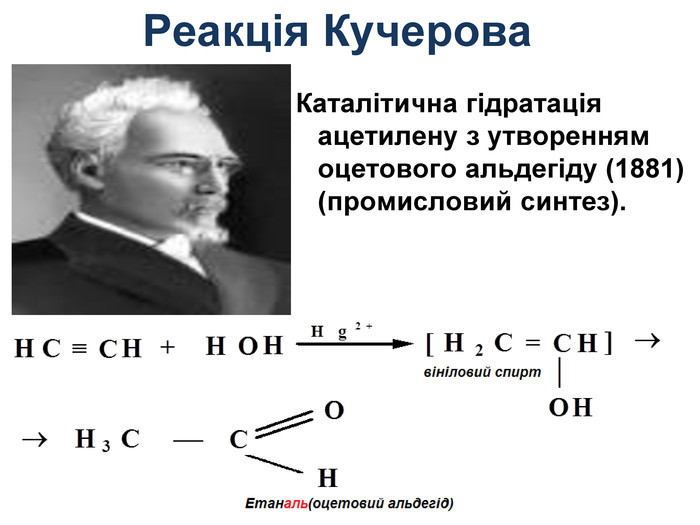
Добування ацетилену 1836р. - відкритий Е. Деві при розкладанні водою калій карбіду. 1862р. - М. Бертло (франц.) вперше синтезув із вуглецю і водню: 2С + Н2 → С2Н2 1. Карбідний метод: СаС2 + 2Н2О → С2Н2 + Са(ОН)2 2. Піроліз метану: t=1500єС 2 СН4 → C2H2 + 3H2 Добування в лабораторії C2H2 ацетилен
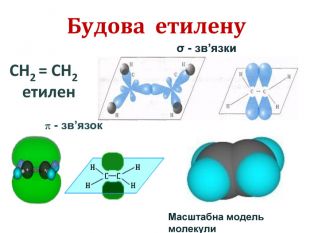
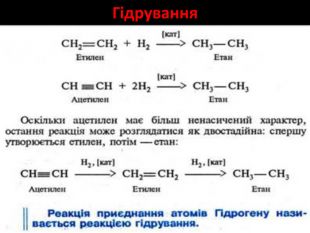
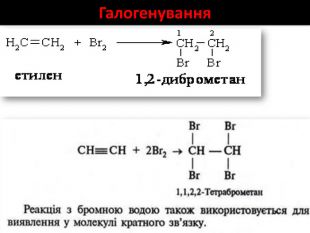
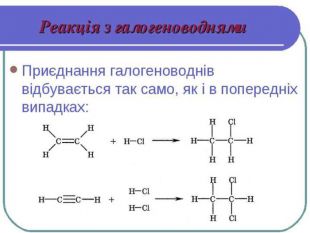
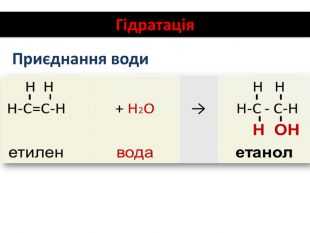
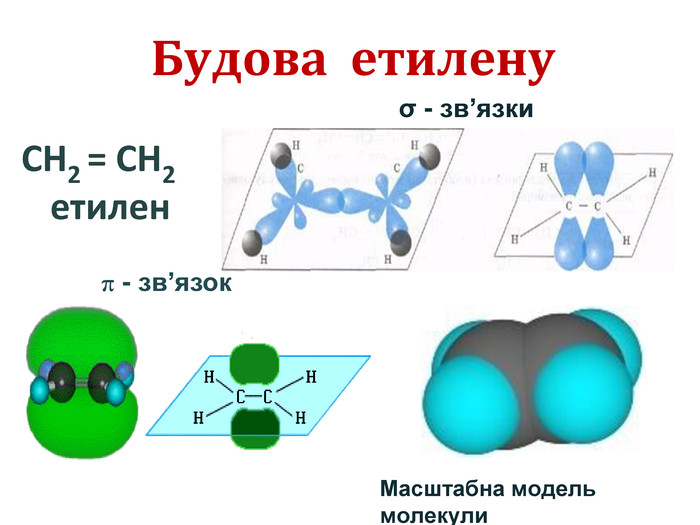
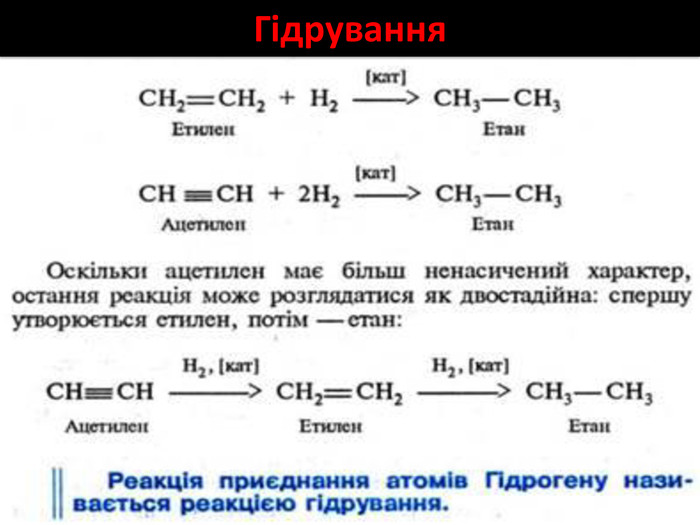
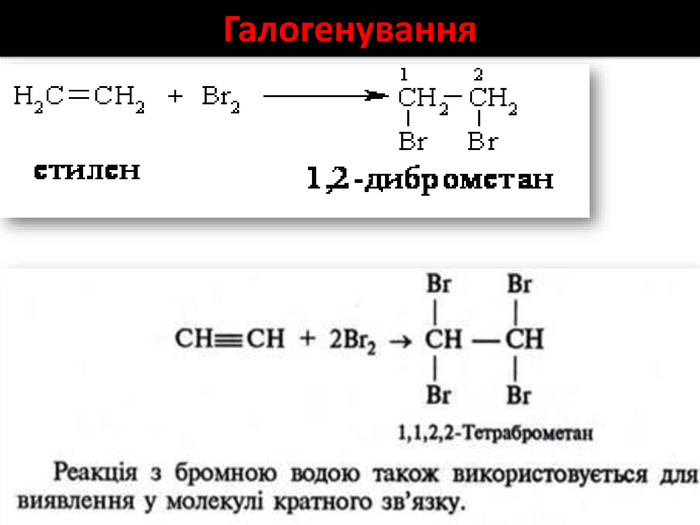
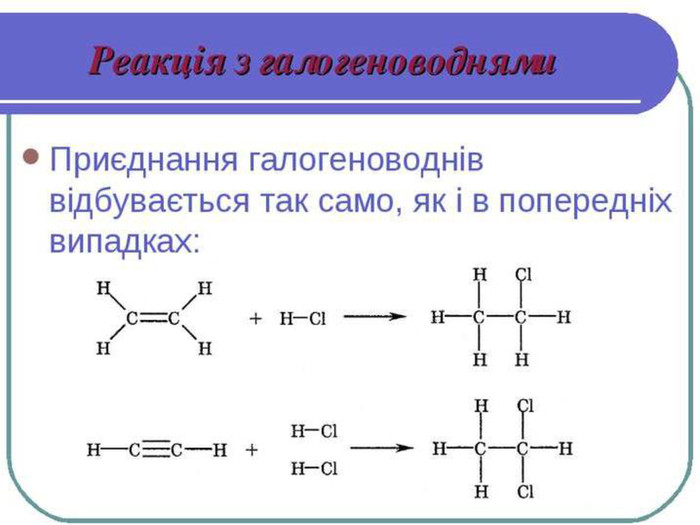
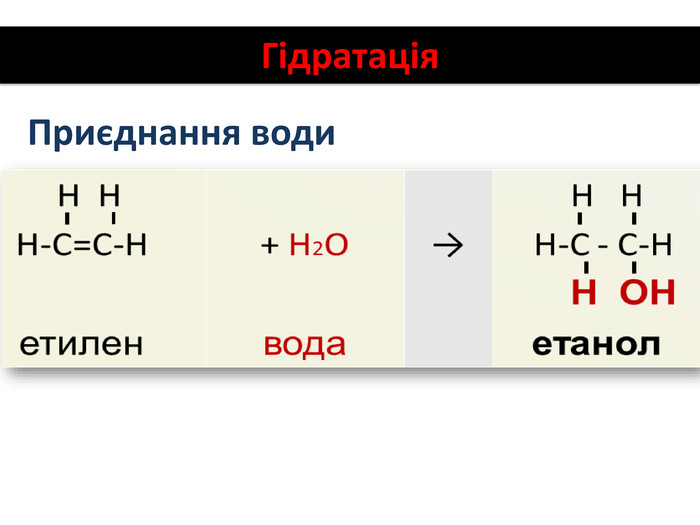
Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2. Реакції приєднання по місцю розриву π - зв’язку: СН2 = СН2 а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6 б) галогенування - приєднання галогенів: С2Н4 + Br2 →С2Н4Br2 Якісне визначення ненасичених вуглеводнів -знебарвлення розчину калій перманганату і бромної води
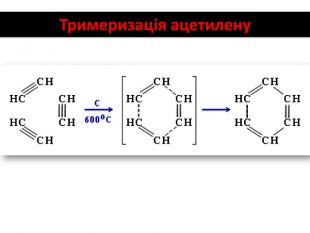
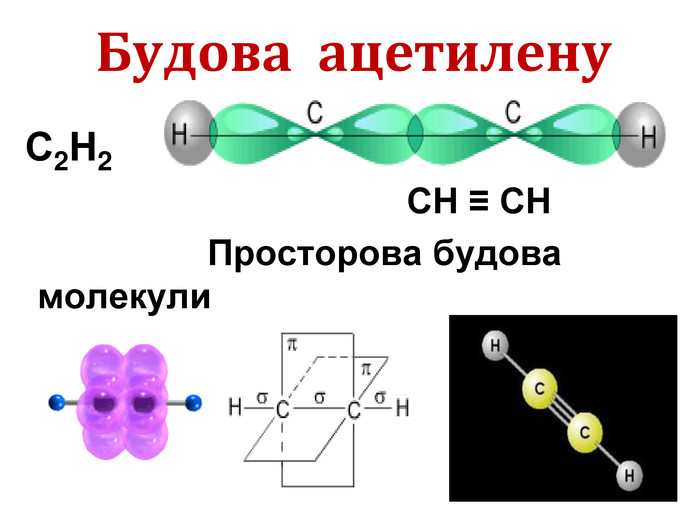
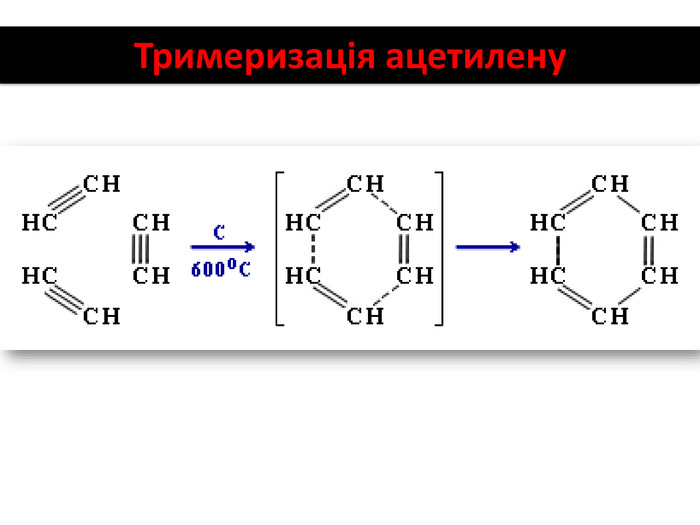
Хімічні властивості ацетилену Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання по місцю розриву π - зв’язків відбуваються у дві стадії а) гідрування (каталітичне): С2Н2 + Н2→ С2Н4 С2Н4 + Н2→ С2Н6 б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен) С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан) Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води розчину калій перманганату.
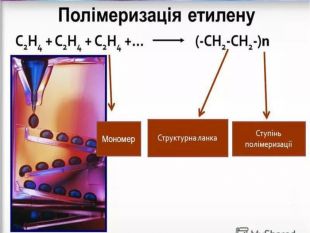
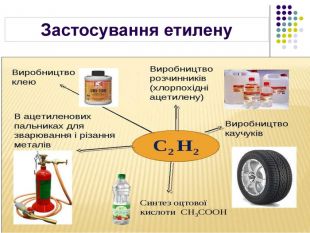
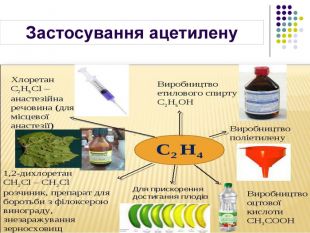
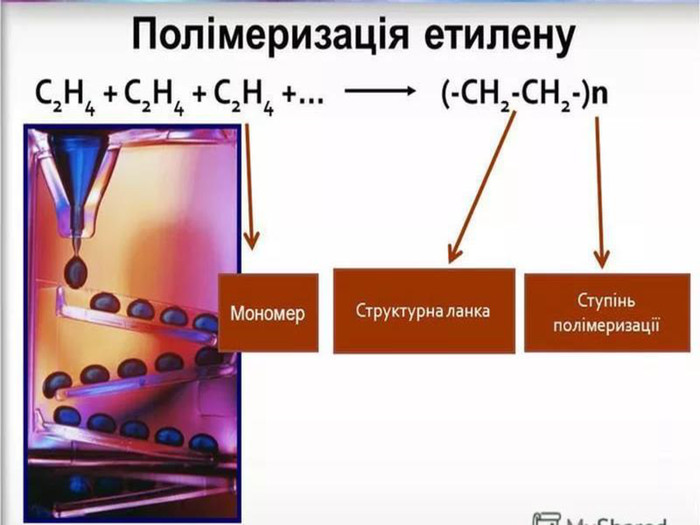
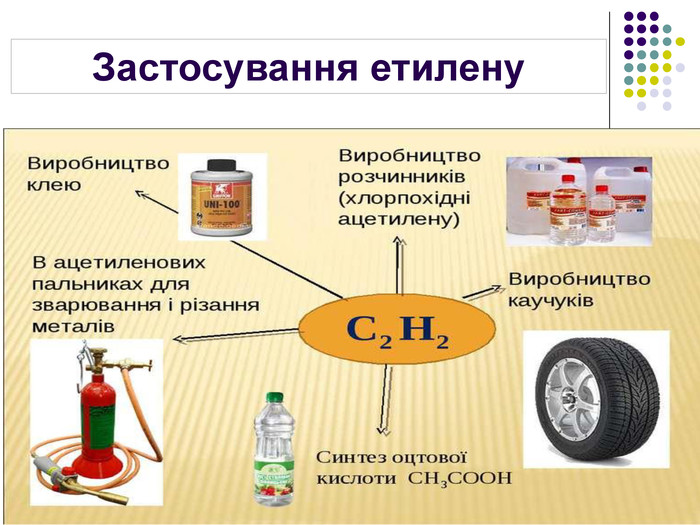
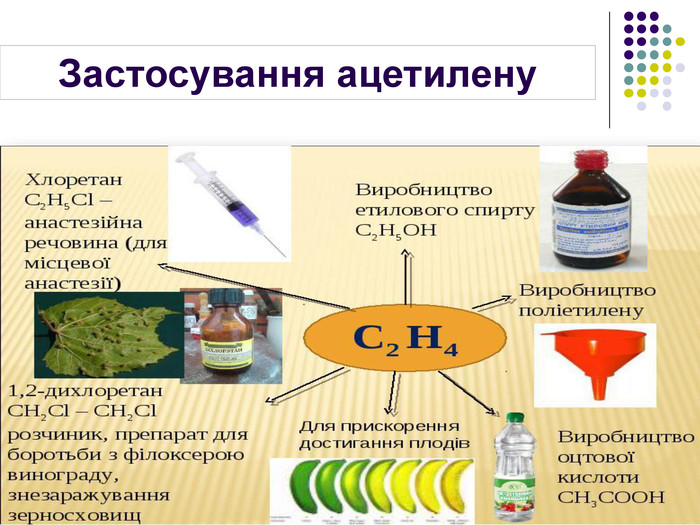
Застосування Етилен Ацетилен Висока реакційна здатність зумовлює використання в хімічній промисловості для добування етанолу та етиленгліколю Використовують для дозрівання плодів Використовують для добування полімеру поліетилену 70% ацетилену використовується для потреб органічного синтезу: виробництво етанолу, ацетальдегіду, оцтової кислоти, полімерів, синтетичних каучуків, органічних розчинників 30% ацетилену використовується для автогенного зварювання і різання металів


про публікацію авторської розробки
Додати розробку