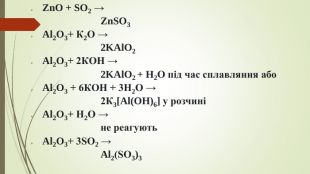Презентація на тему: "Фізичні і хімічні властивості кислотних оксидів".
Презентація уроку на тему: "Фізичні і хімічні властивості кислотних оксидів".
Допоможе учням зрозуміти в які хімічні реакції вступають основні оксиди, зрозуміти, що таке реакція обміну.





























![4. Взаємодія з лугами: А) під час сплавляння утворюється сіль, у якій метал амфотерного оксиду входить до складу кислотного залишку: Zn. O + 2 KOH → K2 Zn. O2 + H2 OБ) у розчині *** (для ознайомлення)Zn. O + 2 KOH + H2 O → K2[Zn(OH)4] калій гексагідроксоцинкат 4. Взаємодія з лугами: А) під час сплавляння утворюється сіль, у якій метал амфотерного оксиду входить до складу кислотного залишку: Zn. O + 2 KOH → K2 Zn. O2 + H2 OБ) у розчині *** (для ознайомлення)Zn. O + 2 KOH + H2 O → K2[Zn(OH)4] калій гексагідроксоцинкат](/uploads/files/1923723/279706/304003_images/34.jpg)

![Виконаємо разом. Закінчіть рівняння можливих хімічних реакцій. Zn. O + H2 O → не реагують. Zn. O + Na2 O → Na2 Zn. O2 Zn. O + 2 Li. OH → Li2 Zn. O2 + H2 O під час сплавляння або. Zn. O + 2 Li. OH+ H2 O → Li2[Zn(OH)4] під час реакції в розчині Виконаємо разом. Закінчіть рівняння можливих хімічних реакцій. Zn. O + H2 O → не реагують. Zn. O + Na2 O → Na2 Zn. O2 Zn. O + 2 Li. OH → Li2 Zn. O2 + H2 O під час сплавляння або. Zn. O + 2 Li. OH+ H2 O → Li2[Zn(OH)4] під час реакції в розчині](/uploads/files/1923723/279706/304003_images/36.jpg)
![Zn. O + SO2 → Zn. SO3 Al2 O3+ К2 O → 2 KAl. O2 Al2 O3+ 2 КOН → 2 KAl. O2 + H2 O під час сплавляння або. Al2 O3 + 6 КOН + 3 H2 O → 2 К3[Al(OH)6] у розчиніAl2 O3+ Н2 O → не реагують. Al2 O3+ 3 SО2 → Al2(SО3)3 Zn. O + SO2 → Zn. SO3 Al2 O3+ К2 O → 2 KAl. O2 Al2 O3+ 2 КOН → 2 KAl. O2 + H2 O під час сплавляння або. Al2 O3 + 6 КOН + 3 H2 O → 2 К3[Al(OH)6] у розчиніAl2 O3+ Н2 O → не реагують. Al2 O3+ 3 SО2 → Al2(SО3)3](/uploads/files/1923723/279706/304003_images/37.jpg)






Основний оксид Ва. О взаємодіє з кислотами. Ba. O + 2 HNO3 = Ba(NO3)2 + H2 OBa. O + 2 HBr = Ba. Br2 + H2 OКислотні оксиди Р2 О5 і СО2 взаємодіють з лугами, основними оксидами. P2 O5 + 6 KOH = 2 K3 PO4 + 3 H2 OP2 O5 + 3 Ca. O = Ca3(PO4)2 CO2 + 2 KOH = K2 CO3 + H2 OCO2 + Ca. O = Ca. CO3
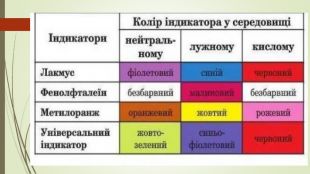
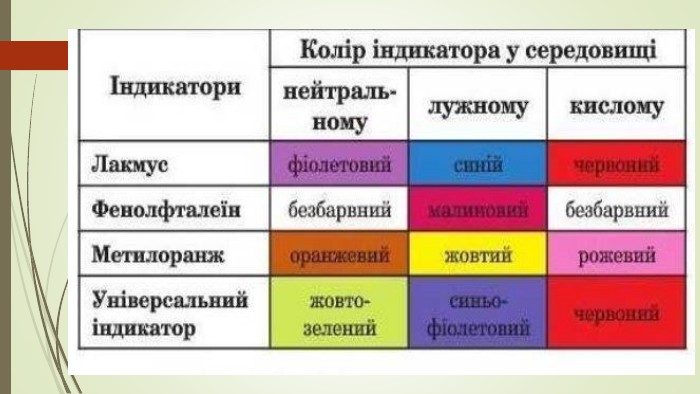
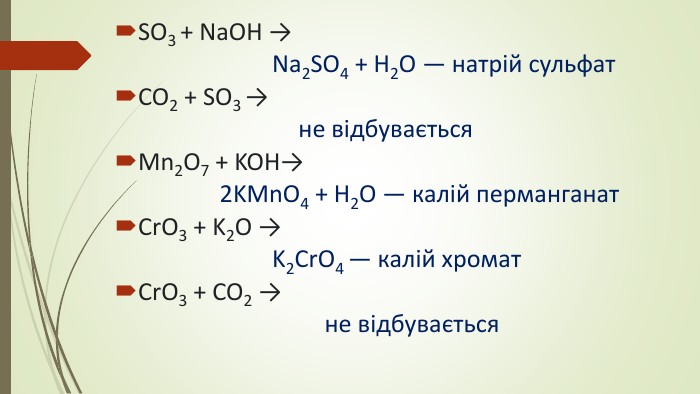
2. Кислотні оксиди взаємодіють із лугами з утворенням солі й води. Формула солі містить кислотний залишок кислоти, що відповідає даному кислотному оксиду6 Na. OH + P2 O5 → 2 Na3 PO4 + 3 H2 О – натрій фосфатhttps://www.youtube.com/watch?v=O3 F8 BI-CHiw&ab_channel=AQUAДля досліду був узятий розчин натрій гідроксиду Na. OH. Розчини речовин, які беруть участь у реакції, і тих, що утворюються, не мають кольору. Тому використовують індикатор фенолфталеїн. Під час додавання до лугу він стає малиновим, після реакції з фосфор(V) оксидом знебарвлюється. Це свідчить про утворення нейтральної речовини солі й води
3. Кислотні оксиди взаємодіють із оснóвними та амфотерними оксидами з утворенням солей. У цьому випадку також дивимося на формулу кислотного оксиду й визначаємо формулу кислоти (гідрату), що йому відповідає. У формулу записуємо метал, що входить до складу основного оксиду, і кислотний залишок кислоти, що відповідає кислотному оксиду. Далі ставимо індекси відповідно до значень валентностей. P2 O5 + 3 Mg. O → Mg3(PO4)2 магній ортофосфат CO2 +Ca. O → Ca. CO3 кальцій карбонат. SO2 + Zn. O → Zn. SO3 Амфотерний цинк сульфіт
Амфотерні оксиди. Амфотерні оксиди — це оксиди, які в хімічних реакціях можуть виявляти кислотні або основні властивості залежно від того, з якою сполукою вони взаємодіють. Амфотерним оксидам відповідають амфотерні гідроксиди: Zn(OH)2 ↔ Zn. O ↔ H2 Zn. O2 Al(OH)3 ↔ Al2 O3 ↔ H3 Al. O3 Основа оксид кислота. Знайдіть закономірність у тому, як із формули амфотерного оксиду зробити формулу основи та як — кислоти.
1. Взаємодія з кислотними оксидами утворюється сіль, у якій метал амфотерного оксиду пишуть на початку формули: Zn. O + CO2 → Zn. CO3 — цинк карбонат. Al2 O3 + 3 SO3 → Al2(SO4)3 — алюміній сульфат. Сr2 O3 + P2 O5 → Cr. PO4 — хром(ІІІ) ортофосфат. Cr2 O3 + 3 SO3 → Cr2(SO4)3 — хром(ІІІ) сульфат
3. Взаємодія із основними оксидами (під час сплавляння).утворюється сіль, у якій метал амфотерного оксиду входить до складу кислотного залишку: Ca. O + Zn. O → Ca. Zn. O2 K2 O + Be. O → K2 Be. O2 Mg. O + Al2 O3 → Mg(Al. O2)2 Al2 O3 + Na2 O → 2 Na. Al. O2 Для написання рівнянь таких реакцій із формули амфотерного оксиду робимо формулу кислоти, умовно припускаючи, що він реагує з водою: Zn. O + H2 O → Н2 Zn. O2, Zn. O2 — кислотний залишок цинкатної кислоти, з ним утворюємо сіль;Al2 O3 + H2 O → Н2 Al2 O4 → НAl. O2 — скорочуємо індекси на 2 й використовуємо кислотний залишок Al. O2.
Амфотерний оксид. Амфотерний гідроксид. Відповідна йому кислота. Кислотний залишок. Формуланазва. Формула. Назва. Формула й валентність. Назва. Zn. OZn(OH)2цинк гідроксид. H2 Zn. O2 Цинкатна IIZn. O2 Цинкат. Sn. OSn(OH)2станум(ІІ) гідроксид. H2 Sn. O2 Станатна. IISn. O2 Станат. Pb. OPb(OH)2плюмбум(ІІ) гідроксид. H2 Pb. O2 Плюмбатна. IIPb. O2 Плюмбат. Al2 O3 Al(OH)3алюміній гідроксид. H3 Al. O3 Алюмінатна. IIIAl. O3 Алюмінат. Амфотерні гідроксиди та відповідні їм кислоти й солі


про публікацію авторської розробки
Додати розробку